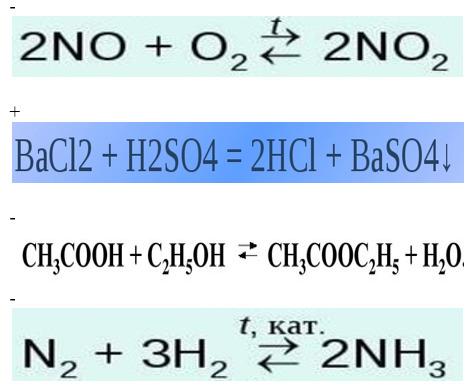Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Какой метод используется при расстановке коэффициентов в уравнении
Тесты по химии 11 класс. Тема: «Химические реакции»
Правильный вариант ответа отмечен знаком +
Вариант 1
1. К химическим реакциям по изменению степени окисления не относятся химические реакции:
2. К реакциям разложения относятся:
— взаимодействие лития с кислородом
+ распад оксида ртути на ртуть и кислород
— взаимодействие цинка с соляной кислотой
3. К реакциям соединения относятся:
+ взаимодействие алюминия с серой
— взаимодействие уксусной кислоты с магнием
— взаимодействие магния с водородом
4. К реакциям замещения относятся:
+ взаимодействие цинка с соляной кислотой
— взаимодействие углерода с водородом
— взаимодействие лития с кислородом
5. Процессы, в результате которых происходит изменение степеней окисления, называются:
+ окислительно – восстановительными реакциями
6. Какой метод используется при расстановке коэффициентов в уравнении?
7. По числу и составу исходных и образующихся веществ не относится реакция:
+ по радикальному механизму
8. К реакциям разложения относится:
+ 2 KClO3= 2 KCl + 3O2 (газ)
— 2 Fe + 3 Cl2 = 2 FeCl3
— HCOOH + NaOH — ≥ HCOONa + H2O
9. К реакциям соединения относится:
+ 2 Fe + 3 Cl2 = 2 FeCl3
— CH4 + Cl2 — ≥(свет) CH3Cl + HCl
— 2 СH4 =(t) C2H2 (газ) + 3H2 (газ)
тест 10. К реакциям характерным для органических веществ относится:
+ идущие по ионному механизму
11. По тепловому эффекту реакции подразделяются на:
+ экзотермические и эндотермические
— обратимые и необратимые
— идущие по радикальному механизму и ионному механизму
12. Экзотермическими называют реакции, которые:
+ идут с выделением теплоты
— идут с поглощением теплоты
— идут до полного израсходования одного из реагирующих веществ
13. Эндотермическими называют реакции, которые:
— идут с выделением тепла
+ идут с поглощением тепла
— идущие при данных условиях во взаимно противоположных направлениях
14. Примером эндотермической реакции является:
— H2(г) + Сl2 (г) = 2 HCl ( г) + 184.6 кДж
+ ½ N2(г) + 1/2O2 (г) = NO( г) – 90.4 кДж
— H2(г) + 1/2O2 (г) = H2O( жидк.) + 285.8 кДж
15. Теплотой образования называют:
+ уровень теплоты, который выходит или используется при выделении одного моля соединения из простых веществ
— уровень теплоты, который выходит при сгорании одного моля вещества
— уровень теплоты, выходящий или используемый при реакции
16. Теплотой сгорания называют:
— уровень теплоты, выходящий или используемый при выделении одного моля соединения из простых веществ
+ уровень теплоты, выходящий при сгорании одного моля вещества
— уровень теплоты, выходящий или используемый при реакции
17. Термохимическими называют реакции, в которых указано:
— уровень теплоты, выходящий или используемый при образовании одного моля соединения из простых веществ
— уровень теплоты, выходящий при сгорании одного моля вещества
+ уровень теплоты, выходящий или поглощаемый при реакции
18. По признаку обратимости реакции подразделяются на:
+ обратимые и необратимые
— экзотермические и эндотермические
— замещения, обмена, разложения, соединения
19. Необратимой называется реакция:
+ идущая до конца, то есть до полного израсходования одного из реагирующих веществ
— которая идет во взаимно противоположных плоскостях
— идущая с выделением теплоты
тест-20. Обратимой называется реакция:
— идущая до конца, то есть до полного израсходования одного из реагирующих веществ
+ которая идет во взаимно противоположных плоскостях
— идущая с выделением теплоты
Вариант 2
1. Чему равен коэффициент окислителя в реакции, протекающей согласно схеме Al + H2SO4 = Al2(SO4)3 + H2?
— единице
2. Выберите вещества, после вступления в реакцию которых образуется химический процесс, который можно описать сокращенным ионным уравнением 2H + + CO3 2- = H2O + CO2:
3. К соединительным реакциям относится:
+ взаимодействие Al с S
— взаимодействие CH3COOH с Mg
— взаимодействие Mg с H2
— все ответы верные
4. Какая реакция не является окислительно-восстановительной?
5. Из представленных ниже вариантов выберите необратимую реакцию:
6. Как называется раствор, вещество в котором при определённой температуре не подлежит растворению?
7. К обратимой относятся реакции, которые:
— протекают до конца
+ идут во взаимно противоположных плоскостях
— заканчиваются выделением тепла
— происходят лишь с применением катализатора
8. Повысить скорость химического взаимодействия, описываемого уравнением 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q, возможно, если:
+ мелко подробить железный колчедан
— применять воздух, насыщенный азотом
— абсорбировать SO2 водой
9. Как называется метод, предназначенный для уравнения химических реакций?
тест 10. Гидролизу не подвергается соль:
11. Окислительно-восстановительная реакция — это:
— нейтрализация CH₃COOH гидроксидом кальция
12. Газ, выделяющийся вследствие реакции между СaC2 и Н2О:
13. Что подразумевается под «теплотой сгорания»?
— степень тепла, вышедшая либо израсходованная в процессе выделения 1 моль вещества из простого соединения
— изменение энтальпии химической системы за счёт протекания взаимодействующей реакции
+ количество тепла, получаемое при сгорании 1 моль вещества
— нет правильного ответа
14. Щелочной показатель рН характерен для раствора:
15. Какой тип химических реакций не классифицируется по количеству и составу исходных и конечных веществ?
+ по радикальному механизму
16. Кислотный рН характерен для водного раствора:
17. Реакцией разложения является:
— взаимодействие Li с O2
+ распад HgO на Hg и O2
— взаимодействие Fe с CuSO4
— взаимодействие Zn с HCl
18. В результате какой реакции состав вещества остаётся прежним?
19. На смещение равновесия системы N2(г) + О2(г) = 2NO(г) – Q не влияет:
— повышение концентрации NO
— уменьшение концентрации N2
тест-20. Скорость прямого взаимодействия в системе N2 + 3H2 = 2NH3 + Q возрастает при:
+ увеличении концентрации азота
— уменьшении концентрации аммиака
— уменьшении концентрации азота
— увеличении концентрации аммиака
21. По характеру обратимости реакции классифицируются на:
— идущие с изменением и без изменения степени окисления атомов
— соединения, разложения, обмена, замещения
22. Взаимодействие NaOH с H₃PO₄ относится к реакциям:
23. Какая соль в водном растворе изменяет цвет фенолфталеин на малиновый?
24. К реакциям замещения относится:
+ взаимодействие Zn с HCl
— взаимодействие NaOH с HCl
— взаимодействие C с H2
— взаимодействие Li с O2
25. Кислый рН характерен для водного раствора:
26. Уравнение 2Na + 2H2O = 2NaOH + H2 + Q описывает реакцию:
27. Какое вещество образуется путём соединения водных растворов Na2CO3 и Al₂(SO₄)₃:
28. Эндотермические реакции – это те, которые:
+ идут с поглощением теплоты
— протекают в обычных условиях, но в противоположных направлениях
— невозможны без участия катализатора
— протекают с выделением теплоты
29. Укажите, чему равно значение коэффициентов химической реакции Mg + HNO3 = Mg(NO3)2 + N2 + H2O:
тест_30. К какому типу относится реакция, отображенная на рисунке ниже?
Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
http://testua.ru/testy-po-khimii/179-testy-po-khimii-11-klass/1686-testy-khimicheskie-reaktsii-11-klass-s-otvetami.html
http://www.poznavayka.org/himiya/kak-rasstavlyat-koefficzienty-v-himicheskih-uravneniyah/