Какой нейрофизиологический процесс формализует уравнение нернста
• Мембранный потенциал возникает за счет электрохимического градиента, который существует по обеим сторонам мембраны, селективно проницаемой для ионов
• Величина мембранного потенциала как функции концентрации ионов рассчитывается по уравнению Нернста
• В клетке поддерживается отрицательное значение мембранного потенциала покоя. При этом внутренняя среда клетки, по сравнению с внешней, характеризуется несколько большим отрицательным зарядом
• Существование мембранного потенциала является необходимым условием генерации электрических сигналов, а также направленного транспорта ионов через мембрану
Важным свойством клеток является способность поддерживать такие внутриклеточные концентрации метаболитов, которые существенно отличаются от их содержания во внеклеточной среде. В случае ионов, различия в их концентрации по обеим сторонам мембраны приводят к различиям в электрическом заряде: внутриклеточная среда заряжена несколько более отрицательно, чем среда снаружи клетки. Совместное действие разности зарядов и концентраций проводит к возникновению электрохимического градиента. Электрохимический градиент поддерживается за счет действия селективных каналов и белков переносчиков в плазматической мембране.
Для того чтобы понять, каким образом возникает электрохимический градиент, вначале рассмотрим простой случай, когда мембрана оказывается проницаемой только для одного вида ионов. На рисунке ниже представлены два компартмента, А и В, разделенные тонкой мембраной. Эти компартменты содержат раствор КС1 разной концентрации. В растворе хлорид калия диссоциирован на гидратированные ионы К+ и Cl-. Поскольку оба компартмента содержат эквимолярные концентрации ионов, то каждый обладает нейтральным зарядом.
Если бы мембрана была непроницаема для ионов, то величина ее электрического потенциала, измеренная с помощью вольтметра, равнялась бы нулю.
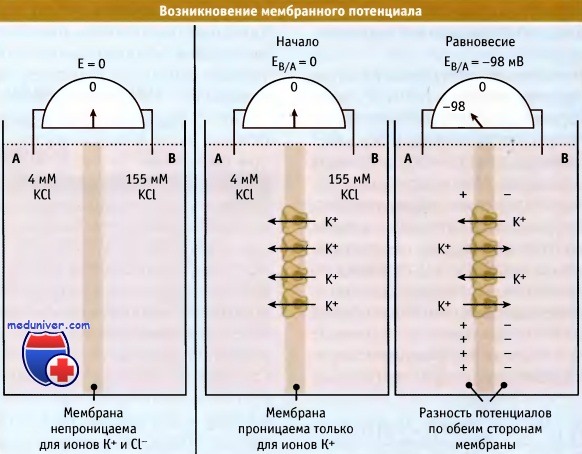
Теперь рассмотрим случай, когда мембрана проницаема только для ионов калия (например, когда в мембране находятся К+-каналы). Диффузия растворенных веществ по градиенту концентрации является энергетически выгодным процессом (выражается в виде отрицательной величины разности энергии AG). Поэтому ионы К+ будут диффундировать в сторону более низкой их концентрации, т. е. из компартмента В в компартмент А. При этом распределение заряда на мембране будет меняться. По мере накопления в компартменте А положительно заряженных ионов, возрастают силы отталкивания между ними. Эти силы затрудняют переход ионов К+ в компартмент А.
Когда в системе достигается электрохимическое равновесие, градиенты концентрации и электрических зарядов взаимно уравновешиваются, и движение ионов К+ через мембрану прекращается. При этом транспорт ионов К+ из одного компартмента сдерживается их транспортом из другого компартмента.
Однако в компартменте А содержится больше положительно заряженных ионов, чем в компартменте В. Этот избыток ионов К+ (в компартменте А) взаимодействует с избытком ионов Cl- (в компартменте В) через тонкую мембрану, в результате чего по обеим ее сторонам выстраиваются электрические заряды. Разница зарядов по обеим сторонам мембраны выражается в виде разности потенциалов и называется мембранный потенциал. Равновесный (мембранный) потенциал компартмента В по отношению к компартменту А имеет отрицательное значение.
Этот пример иллюстрирует необходимость наличия двух условий, необходимых для возникновения мембранного потенциала клетки, не равного нулю:
• различные концентрации ионов по обеим сторонам мембраны, которые приводят к разделению зарядов и
• мембрана, обладающая селективной проницаемостью по крайней мере к одному виду ионов.
Поэтому величина мембранного потенциала является функцией концентрации ионов. В состоянии равновесия эту функцию для ионов X можно выразить количественно с помощью уравнения Нернста:
• Е — равновесный потенциал (в вольтах)
• R — универсальная газовая постоянная (2 кал моль -1 К -1 )
• Т — абсолютная температура (К; 37 °С = 307,5 К)
• z — валентность ионов (электрический заряд)
• F — число Фарадея (2,3 х 10 4 кал вольт -1 моль -1 )
• [Х]А — концентрация свободных ионов X в компартменте А
• [Х]в — концентрация свободных ионов X в компартменте В
В формировании мембранного потенциала в клетках животных, главным образом, участвуют ионы К+, Na+ и Cl-. Ионы Са2+ и Mg2+ в меньшей степени участвуют в формировании мембранного потенциала покоя. Плазматическая мембрана обладает селективной проницаемостью к перечисленным ионам (т. е. мембрана содержит ионные каналы, селективные к каждому типу ионов). Это обстоятельство, а также мембранная проницаемость (Р) для каждого иона учитывается в уравнении Гольдмана-Ходжкина-Каца, которое представляет собой расширенную форму уравнения Нернста.
Для основных ионов это уравнение выражает мембранный потенциал как функцию их проницаемости и концентрации внутри (i) и снаружи (о) клетки:
Величина отрицательного мембранного потенциала покоя зависит от типа клеток и колеблется от -200 мВ до -20 мВ. В клетках млекопитающих мембранный потенциал покоя в основном создается при работе К+-каналов и ионного насоса, который называется Na+/К+-АТФаза. Основной вклад в формирование отрицательного мембранного потенциала вносит небольшой поток ионов К+ через плазматическую мембрану. Этот поток осуществляется через К+-каналы, лишенные воротного механизма (т. н. калиевые каналы покоя).
В отличие от большинства других К+-каналов, которым необходим сигнал для открытия, эти каналы в клетке, обладающей определенным потенциалом покоя, открыты постоянно. В покоящейся клетке также открыты несколько каналов для других ионов. Движение ионов К+ из клетки, по направлению электрохимического градиента, помогает клеточному содержимому поддерживать отрицательный заряд. Пока мы не знаем всех источников ионов калия, которые участвуют в этом процессе. В некоторых клетках, например у растений и бактерий, а также в митохондриях, мембранный потенциал покоя создается за счет градиента протонов, а не ионов К+.
Для того чтобы происходила диффузия ионов К+ из клетки через К+-каналы, их концентрация в клетке должна быть выше, чем в окружающей среде. Градиент концентрации создается в результате работы Na+/К+-АТФа-зы, которая закачивает в клетку два иона калия на каждые три иона натрия, которые этот ионный насос удаляет из клетки. Поэтому насос функционирует как генератор заряда: удаляется больше электрических зарядов, чем привносится к клетку. Таким образом, наряду с K+-каналами, лишенными воротного механизма, Na+/К+-АТФазы участвуют в создании отрицательного внутриклеточного потенциала. Если происходит инактивация Na+/K+-АТФаз, то концентрации ионов Na+ и К+ по обе стороны мембраны уравниваются. Это происходит потому, что липидный бислой очень плохо пропускает ионы. Иными словами, без прохождения первичных процессов активного транспорта с участием Na+/К+-АТФаз значение мембранного потенциала равнялось бы нулю.
Мембранный потенциал покоящейся клетки представляет собой довольно постоянную величину. Однако при связывании лигандов, механическом стрессе или при изменении электрического заряда происходит открытие специфических ионных каналов, и мембранный потенциал изменяется. Если ионные каналы находятся под контролем электрического заряда, то изменения мембранного потенциала влияют на прохождение через них ионов. Открытие и закрытие канала контролируются воротным механизмом (гейтингом). Мембранный потенциал зависит от тех ионов, для которых каналы в основном, открыты. Например, при открытии Na+- или Са2+-каналов происходит деполяризация мембраны.
При этом соответствующие ионы начинают поступать в клетку в направлении их электрохимического градиента. Это приводит к тому, что мембранный потенциал становится более положительным. Напротив, при реполяризации мембраны (гиперполяризации) потенциал становится еще более отрицательным. Это происходит при открытии калиевых каналов и выходе из клетки ионов К+ в направлении градиента, что и влечет за собой увеличение отрицательного мембранного потенциала. Движение ионов по ионным каналам происходит быстро и исчисляется миллисекундами. Для изменения мембранного потенциала достаточны лишь незначительные различия в концентрации ионов по сторонам мембраны, и основная концентрация их в клетке не меняется.
Поток лишь 10 -12 моль К+ через 1 см2 мембраны приводит к ее быстрой гиперполяризации и к установлению мембранного потенциала, равного -100 мВ. Локальное передвижение относительно небольших зарядов через мембрану позволяет цитозолю и внеклеточной среде оставаться электрически нейтральными и сводит к минимуму электрическое отталкивание зарядов.
С энергетической точки зрения, мембранный потенциал представляет собой некий энергетический резервуар, энергию которого можно использовать для выполнения определенной работы. По расположению отрицательно заряженных ионов в цитозоле и положительно заряженных на наружной стороне мембраны, клетка напоминает электрический конденсатор или батарею, т. е. приспособление, способное сохранять электрическую энергию и служить ее источником. Энергия высвобождается в виде ионов, мигрирующих по направлению их электрохимического градиента, и может использоваться в процессах транспорта других ионов или метаболитов против градиента концентрации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Мембранный транспорт. Лекция 7 Ж (1). Физические процессы в биологических мембранах
| Название | Физические процессы в биологических мембранах |
| Анкор | Мембранный транспорт |
| Дата | 08.11.2021 |
| Размер | 0.7 Mb. |
| Формат файла |  |
| Имя файла | Лекция 7 Ж (1).doc |
| Тип | Лекция #266686 |
| страница | 2 из 2 |
| Подборка по базе: Переходные процессы вариант 14 -1.docx, Термические процессы переработки нефти и газа.pdf, Лекция ГОСТ Р ИСО_МЭК 12207. Основные процессы и взаимосвязь меж, Лекция ГОСТ Р ИСО_МЭК 12207. Основные процессы и взаимосвязь меж, ОСТ 36-28-78 Система стандартов безопасности труда. Процессы про, Базовые информационные процессы.docx, Опасные природные процессы Солодовникова.docx, Общие проблемы малой группы. Динамические процессы в малой групп, Романов. Д.В. Базовые информационные процессы и технологии_ИК.do, ПК_ПЛАН-КОНСПЕКТ ФИЗИЧЕСКИЕ КАЧЕСТВА В БАДМИНТОНЕ.docx Как известно , на мембране существует разность потенциалов, следовательно, в мембране имеется электрическое поле. Оно ока зывает влияние на диффузию заряженных частиц (ионов и элект ронов). Между напряженностью поля Е и градиентом потенциала d / dx существует известное соотношение (см. § 12.1): Заряд иона равен Ze. На один ион действует сила Скорость направленного движения ионов пропорциональна дей ствующей силе [см. (11.4), (11.5)]: Чтобы найти поток вещества (ионов), выделим объем электролита (рис. 11.12) в виде прямоугольного параллелепипеда с ребром, численно равным скорости ионов. Все ионы, находящиеся в параллелепипе де, за 1 с пройдут через площадку S . Это и будет поток Ф. Число молей этих ионов можно найти, умножая объем параллелепипеда ( S ) на молярную концентрацию ионов с: Плотность потока вещества найдем, используя формулы (11.24) и (11.25): В общем случае перенос ионов определяется двумя факторами: неравномерностью их распределения, т.е. градиентом концентра ции [см. (11.11)], и воздействием электрического поля [см. (11.26)]: Это уравнение Нернста — Планка. Используя выражение для подвижности (11.12), преобразуем уравнение (11.27) к виду Это другая форма записи уравнения Нернста—Планка. Используем уравнение Нернста—Планка для установления за висимости плотности диффузионного потока от концентрации ионов и от напряженности электрического поля. Предположим, система находится в стационарном состоянии, т. е. плотность потока J постоянна. Электрическое поле в мембране примем за од нородное, следовательно, напряженность поля одинакова, а по тенциал линейно изменяется с расстоянием. Это позволит счи тать, что — вспомогательная величина (безразмерный потенциал). С учет ом (11.29) получим уравнение Нернста—Планка в виде: Разделим переменные и проинтегрируем уравнение: Вообще говоря, формула (11.33) справедлива как для положи тельных ( Z > 0, > 0), так и для отрицательных ( Z 0, ионов. Однако для отрицательных ионов целесообразно видоизме нить это выражение, подставив в него отрицательное значение безразмерного потенциала: Разделим числитель и знаменатель этого выражения на е — : При использовании этой формулы необходимо помнить, что отри цательные значения Z и уже учтены в самой формуле, т. е. — положительная величина. Уравнения (11.33) и (11.34) устанавливают связь плотности стационарного потока ионов с тремя величинами: 1) проницаемо стью мембран для данного иона, которая характеризует взаимо действие мембранных структур с ионом; 2) электрическим полем; 3) молярной концентрацией ионов в водном растворе, окружаю щем мембрану (ciи c0). Проанализируем частные случаи уравнения (11.33): а) = 0, что означает либо Z = 0 (нейтральные частицы), либо отсутствие электрического поля в мембране ( м = 0), либо и то, и другое: Найдем пределы отдельных сомножителей. Эту неопределенность можно раскрыть по пра вилу Лопиталя: Отсюда получаем, как и следовало ожидать, уравнение (11.21): б) одинаковая молярная концентрация ионов по разные сторо ны от мембраны ( c i = с 0 = с ) при наличии электрического поля: Это соответствует электропроводимости в электролите (см. § 12.9). Для нейтральных частиц ( Z = 0 и = 0) J = 0; в) если мембрана непроницаема для частиц (Р = 0), то, естест венно, плотность потока равна нулю. Явления переноса (см.§ 11.3 и §11.4) относятся к пассивному транспорту: диффузия молекул и ионов в направлении их мень шей концентрации, перемещение ионов в соответствии с направле нием силы, действующей на них со стороны электрического поля. Пассивный транспорт не связан с затратой химической энергии. Наиболее общая классификации видов пассивного транспорта веществ через мембрану включает в себя простую диффузию, диф фузию через поры и диффузию с переносчиком. Простая диффузия через липидный бислой подчиняется урав нению Фика для молекул (11.21) или, в более общем случае для нейтральных и заряженных частиц, — уравнению Нернста— Планка (11.28). В живой клетке такая диффузия обеспечивает прохождение кислорода и углекислого газа (см. рис. 11.13, а). Ряд жирорастворимых лекарственных веществ и ядов также про никает через липидный бислой по схеме, изображенной на рисун ке. Как уже отмечалось в § 11.1, определенная конфигурация ли пидов способствует диффузии поперек мембраны благодаря пере мещению «кинков». Однако подобная простая диффузия протекает достаточно мед ленно и не может снабдить клетку в нужном количестве питатель ными веществами. Поэтому есть иные механизмы пассивного пе реноса веществ через мембрану, к ним относятся диффузия через канал (пору) и диффузия в комплексе с переносчиком. Два по следних варианта называют иногда облегченной диффузией (рис. 11.13, б, в). Порой или каналом называют участок мембраны, включаю щий липидные или белковые молекулы и образующий в мембране проход (см. рис. 11.13, б). Этот канал допускает проникновение через мембрану не только малых молекул, например, молекул во ды, кислорода, но и более крупных ионов. Диффузия через поры также описывается диффузионными уравнениями, однако нали чие пор увеличивает коэффициент проницаемости Р. Каналы могут проявлять селективность (избирательность) по отношению к разным ионам, это проявится и в различии проницаемости для разных ионов. Еще одно «облегчение» диффузии — перенос ионов специаль ными молекулами-переносчиками (см. рис. 11.13, в). При этом пе реносчик может быть подвижным либо неподвижным. Так, антибиотик валиномицин при связывании с ионом калия образует рас творимый в липидах комплекс и проходит через мембрану. Молекулы другого антибиотика, грамицидина, образуют времен ную цепочку поперек мембраны и «по эстафете» передают перено симое через мембрану вещество (ионы натрия) от одной молекулы переносчика к другой. За способность переносить ионы через мембраны валиномицин, грамицидин и другие переносчики получили название ионофоров. Следует отметить, что диффузия комплекса переносчика и иона также описывается общим уравнением диффузии, посколь ку облегченная диффузия происходит от мест с большей концент рацией диффундирующего вещества к местам с меньшей концент рацией. Вывод о том, что имеет место облегченная диффузия, по зволяют сделать некоторые особенности, отличающие ее от простой. Во-первых, перенос вещества с помощью переносчика любого типа идет с существенно большими скоростями, по сравнению с простой диффузией. Во-вторых, для облегченной диффузии ха рактерно «насыщение», когда с увеличением концентрации дан ного вещества с одной стороны мембраны плотность его потока становится больше только до определенного предела, зависящего от количества молекул переносчика. Наконец, при облегченной диффузии возможна конкуренция близких по структуре веществ за связывание с молекулой переносчика. Наряду с пассивным транспортом в мембранах клетки проис ходит перенос молекул в область большей концентрации, а ионов — против силы, действующей на них со стороны электрического по ля. Такая разновидность переноса поручила название активного транспорта. Если пассивный транспорт может происходить в любых полупроницаемых мембранах, как биологических, так и искусственных, то активный транспорт присущ только биологи ческим мембранам. Благодаря активному транспорту сохраняет ся пространственная неоднородность в клетке (отличие внутри клеточной среды от внеклеточного пространства), создаются и поддерживаются градиенты концентраций, электрических потен циалов и т. д. Активный перенос веществ через мембрану осу ществляется за счет энергии гидролиза молекул (АТФ). С В результате пассивного транспорта ионы натрия диффундиру ют из наружного раствора в кожу. При этом цитоплазма заряжа ется положительно относительно этого раствора. Ионы калия, проходя из цитоплазмы во внутренний раствор, заряжают ее от рицательно. Таким образом, на коже лягушки между внутренним и внешним барьерами возникает разность потенциалов. В уста новке имеется блок компенсации напряжения, позволяющий ус тановить разность потенциалов на коже, равную нулю. Это можно контролировать вольтметром. Концентрацию ионов с наружной и внутренней сторон поддерживают одинаковой. Если бы при этих условиях перенос ионов определялся только пассивным транспортом, потоки частиц в обе стороны были бы одинаковыми, а суммарный поток через мембрану был бы равен нулю. Однако с помощью амперметра был зарегистрирован ток в це пи, проходящий через кожу лягушки. Это свидетельствует о том, что через кожу лягушки происходит односторонний перенос заря женных частиц. Методом меченых атомов было показано, что имеет место движение ионов натрия от наружного раствора к внутреннему. Таким образом, результаты опыта Уссинга показа ли, что перенос ионов натрия через кожу лягушки не подчиняет ся законам пассивного транспорта. В этом случае имеет место активный перенос ионов. Согласно современным представлениям, в биологических мембранах имеются ионные насосы — специальные системы интег ральных белков (транспортные АТФазы). Известны четыре вида ионных насосов, три из которых обеспечивают перенос ионов Na + , К + , Ca 2+ и Н + через мембраны за счет энергии гидролиза АТФ. Ме ханизм переноса протонов при работе дыхательной цепи митохондрий изучен менее всего. Натрий-калиевый насос работает при условии сопряжения переноса ионов калия и натрия. Это означает, что если во внеш ней среде нет ионов калия, не будет активного переноса ионов натрия из клетки, и наоборот. Другими словами, ионы натрия активируют натрий-калиевый насос на внутренней поверхности клеточной мембраны, а ионы калия — на внешней. Натрий-калиевый насос переносит из клетки во внешнюю сре ду три иона натрия в обмен на перенос двух ионов калия внутрь клетки. Один акт переноса требует затраты энергии одной молекулы АТФ. При этом создается и поддерживается разность потенциалов на мембране, причем внутренняя часть клетки имеет отрицательный заряд. Надо отметить, что существует также активный перенос сахаров, аминокислот, нуклеотидов, но кинетика этих процессов не достаточно хорошо изучена. Интересно, что до сих пор нет досто верных сведений об активном транспорте анионов, хотя они игра ют важную роль в жизнедеятельности клеток (в особенности ионы хлора). По-видимому, анионы попадают в клетку путем пассивно го переноса. источники: http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta http://topuch.ru/fizicheskie-processi-v-biologicheskih-membranah-v2/index2.html |
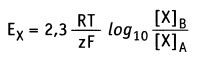
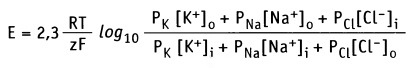
 (11.22)
(11.22) ; сила, действующая на 1 моль ионов, равна
; сила, действующая на 1 моль ионов, равна (11.23)
(11.23) (11.24)
(11.24)
 (11.26)
(11.26) (11.27)
(11.27) (11.28)
(11.28) где м — разность потенциалов на мембране. Упростим запись слагаемого в уравнении (11.28):
где м — разность потенциалов на мембране. Упростим запись слагаемого в уравнении (11.28): 
 (11.29)
(11.29) (11.30)
(11.30)

 (11.31)
(11.31) 

 (11.32)
(11.32)  (11.33)
(11.33)
 (11.34)
(11.34)




 уществование активного транспорта через биологические мембраны впервые было показано датским ученым Уссингом в опытах с переносом ионов натрия через кожу лягушки, которая имеет более сложную структуру, чем одиночная мембрана. Кожу лягушки можно представить как два последовательно располо женных барьера (1 и 2 на рис. 11.14). Наружный барьер 1 (мемб рана) отличается тем, что он избирательно проницаем для ионов натрия, но не калия. В то же время внутренняя мембрана 2 более проницаема для калия, чем для натрия. Экспериментальная ка мера Уссинга, изображенная на рис. 11.14, разделена на две части кожей лягушки. На рисунке кожа лягушки располагается между наружным и внутренним раствором: снаружи и изнутри камеры заполнены раствором Рингера, содержащим ионы натрия, калия, кальция и хлора.
уществование активного транспорта через биологические мембраны впервые было показано датским ученым Уссингом в опытах с переносом ионов натрия через кожу лягушки, которая имеет более сложную структуру, чем одиночная мембрана. Кожу лягушки можно представить как два последовательно располо женных барьера (1 и 2 на рис. 11.14). Наружный барьер 1 (мемб рана) отличается тем, что он избирательно проницаем для ионов натрия, но не калия. В то же время внутренняя мембрана 2 более проницаема для калия, чем для натрия. Экспериментальная ка мера Уссинга, изображенная на рис. 11.14, разделена на две части кожей лягушки. На рисунке кожа лягушки располагается между наружным и внутренним раствором: снаружи и изнутри камеры заполнены раствором Рингера, содержащим ионы натрия, калия, кальция и хлора.