Адиабатный процесс. Изопроцессы в термодинамике
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На этом уроке мы будем работать с уже известными нам физическими понятиями, но в несколько иной области применения. А именно с изопроцессами в термодинамике. Мы рассмотрим, какие изменения в первый закон термодинамики (закон сохранения энергии в тепловых процессах) внесут протекания этих самых процессов при неизменном макроскопическом параметре газа. Также мы рассмотрим новый, ранее неизвестный процесс – адиабатный.
Адиабатный процесс в термодинамике
Вы будете перенаправлены на Автор24
Адиабатный процесс или адиабатический — это термодинамический процесс, происходящий при отсутствии теплообмена с окружающей средой.
Рисунок 1. Адиабатический процесс. Автор24 — интернет-биржа студенческих работ
Есть несколько основных факторов, которые характеризуют данный класс. Например, адиабатный процесс может происходит динамично и укладывается в достаточно короткий период времени. Происходят все адиабатные процессы в термодинамике, как правило, мгновенно.
Уравнение первого закона термодинамики для исследуемого класса имеет следующий вид: $du = -dl = -pdv$. Из этой формулы видно, что работа адиабатического процесса расширения совершается в результате постепенного уменьшения внутренней энергии идеального газа и, следовательно, температура самого элемента уменьшается. Работа адиабатного сжатия всегда идет на только увеличение внутреннего энергетического потенциала, то есть на повышение температурных параметров. Таким образом, изменения условий работы системы в адиабатном процессе эквивалентны по величине и противоположны по знаку.
В реальных условиях указанное термодинамическое явление возможно осуществить двумя методами:
- провести физический процесс так быстро, чтобы теплообмен не успел произойти;
- полностью изолировать систему от факторов внешней среды.
После введения в эксперименты вышеуказанных способов получаем такое уравнение: $dU + dA = 0$. Графически на координатной плоскости адиабатный процесс практически всегда изображается кривой, которая называется в физике адиабатой. Она падает намного круче, чем более постоянная изотерма, поскольку при этом явлении изменение давления происходит с помощью одновременного уменьшения температуры и увеличения объема.
Готовые работы на аналогичную тему
Этот вывод теоретически подтверждает формула: $p = nkT$, ведь увеличение общего объема идеального газа ведет автоматически к уменьшению концентрации молекул изучаемого вещества, следовательно, уменьшение давления обусловливают два показателя — концентрация молекул $n$ и температура газа $T$.
Связь с первым началом термодинамики
Рисунок 2. Адиабатический процесс. Автор24 — интернет-биржа студенческих работ
Адиабатный процесс возможно легко связать с первым законом термодинамики. Его определение “по умолчанию” звучит следующим образом: изменение количества тепловой энергии в системе при протекании в ней определенного термодинамического процесса будет прямо пропорционально сумме изменения тепла идеального газа и работы, которая совершается данным элементом.
Если записывать первое начало термодинамики в его первоначальном, стандартном виде, то получим такое выражение: $dQ = dU + dA$. А теперь попробуем видоизменить это уравнение применительно к действию адиабатического процесса. Как было сказано ранее, подобные явление протекают только при условии отсутствия теплообмена с окружающей средой.
В таком случае новая формула, описывающая более детально первое начало термодинамики, примет уже совершенно иной вид: $dA = -dU$. Теперь немного подробнее о самом видоизменении.
Если говорить о том, что теплообмена между активно действующими в конкретной системе телами не происходит, тогда изменение количества тепловой энергии (обозначенное в уравнении первого термодинамического закона через $dQ$) будет в обязательно порядке равно нулю. Следовательно, можно перенести одну из слагаемых частей из правой части в левую, после чего получить модернизированную формулу, приведенную к описанному ранее виду.
Влияние первого начала термодинамики на адиабатический процесс
Рисунок 3. Первый закон термодинамики к различным процессам. Автор24 — интернет-биржа студенческих работ
Чтобы определить воздействие первого закона термодинамики на адиабатный процесс, необходимо чисто теоретически предположить, что в системе произошло уже данное явление. В этом случае возможно, не вдаваясь в мельчайшие нюансы и детали, утверждать, что газ при постепенном расширении совершает работу, но при этом теряет собственную внутреннюю энергию. Другими словами, совершаемая при адиабатном расширении газа работа будет осуществляться только посредством убыли энергетического потенциала.
Следовательно, в качестве недопущение такого исхода лучше применять понижение температуры действующего в системе вещества. Абсолютно логично можно определить, что, если газ будет адиабатически сжат, его тепловая энергия вырастет в несколько раз. Несложно заметить, что в ходе этого процесса будут изменяться все ключевые характеристики исследуемого вещества. Речь идет о его объеме, давлении и температуре. Поэтому, грубой ошибкой исследователей стало название адиабатического процесса изопроцессом.
Вскоре после того, как был открыт и описан адиабатический процесс, физики начали проводить огромное количество различных исследований. Так, была разработана первая теоретическая модель, которая имеет непосредственное отношение к универсальному циклу Карно. Именно она позволила ученым установить условные границы, ограничивавшие дальнейшее развитие тепловых машин. Однако в случае некоторых природных явлений осуществлять данную модель достаточно трудно. Все дело в том, что в его состав в основном входят изотермы, которые требуют изначального задания определенной скорости термодинамических процессов.
Использование адиабатного процесса в теоретических циклах тепловых машин
На самом деле на сегодняшний день более 90% электроэнергии вырабатывается только на тепловых электростанциях. В них в качестве рабочего тела применяется водяной пар, который возможно получают при кипении воды в адиабатном процессе.
По аналогии с устаревшими поршневыми автомобилями работают и турбинные. Но в них адиабатический процесс отвода тепловой энергии по завершении постепенного расширения газа выполняется исключительно по изобаре. На самолетах с турбовинтовым и газотурбинным двигателями изучаемое явление совершается дважды: при расширении и сжатии.
Чтобы обосновать все основополагающие и применяемые в науке понятия адиабатического процесса, ученые вывели расчетные формулы.
Здесь фигурирует одна основная величина, которая получила название параметр адиабаты. Его значение для двухатомного газа при любых условиях равно 1,4. Для расчета этого показателя адиабаты применяются две характеристики, а именно: изохорная и изобарная теплоемкости физического тела. Отношение их $k=\frac
Чтобы повысить и удержать рабочий потенциал пара, его желательно перегреть. Затем при максимально высоком давлении данный элемент подается на паровую турбину. Здесь также совершается адиабатический процесс расширения идеального пара. Турбина получает необходимое вращение, которое передается на электрогенератор. Тот, в свою очередь, вырабатывает электроэнергию для потребителей. В идеале увеличение эффективности лучше связать с повышением давления и температуры водяного пара. Как видно из вышесказанного, адиабатный процесс в термодинамике является достаточно распространенным в производстве электрической и механической энергий.
Адиабатический процесс и уравнения адиабаты для идеального газа. Пример задачи
Адиабатический переход между двумя состояниями в газах не относится к числу изопроцессов, тем не менее, он играет важную роль не только в различных технологических процессах, но и в природе. В данной статье рассмотрим, что представляет собой этот процесс, а также приведем уравнения адиабаты идеального газа.
Кратко об идеальном газе
Идеальным называется такой газ, в котором нет взаимодействий между его частицами, и их размеры равны нулю. В природе, конечно же, не существует идеальных на сто процентов газов, поскольку все они состоят из имеющих размеры молекул и атомов, которые взаимодействуют друг с другом всегда как минимум с помощью ван-дер-ваальсовых сил. Тем не менее, описанная модель часто выполняется с достаточной для решения практических задач точностью для многих реальных газов.

Главным уравнением идеального газа является закон Клапейрона-Менделеева. Он записывается в следующей форме:
Это уравнение устанавливает прямую пропорциональность между произведением давления P на объем V и количества вещества n на абсолютную температуру T. Величина R — газовая константа, которая играет роль коэффициента пропорциональности.
Что это адиабатический процесс?
Адиабатический процесс — это такой переход между состояниями газовой системы, при котором обмена энергией с внешней средой не происходит. При этом изменяются все три термодинамических характеристики системы (P, V, T), а количество вещества n остается постоянным.
Различают адиабатическое расширение и сжатие. Оба процесса происходят только за счет внутренней энергии системы. Так, в результате расширения давление и особенно температура системы сильно падают. Наоборот, адиабатическое сжатие приводит к положительному скачку температуры и давления.
Чтобы не происходил обмен теплом между окружающей средой и системой, последняя должна обладать теплоизолированными стенками. Кроме того, сокращение длительности протекания процесса значительно уменьшает тепловой поток от и к системе.
Уравнения Пуассона для адиабатического процесса
Первый закон термодинамики записывается в таком виде:
Иными словами, сообщенная системе теплота Q идет на выполнение системой работы A и на повышение ее энергии внутренней ΔU. Чтобы написать уравнение адиабаты, следует положить Q=0, что соответствует определению изучаемого процесса. Получаем:
При изохорном процессе в идеальном газе все тепло идет на повышение внутренней энергии. Этот факт позволяет записать равенство:
Где CV — изохорная теплоемкость. Работа A, в свою очередь, вычисляется так:
Где dV — малое изменение объема.
Помимо уравнения Клапейрона-Менделеева, для идеального газа справедливо следующее равенство:
Где CP — изобарная теплоемкость, которая всегда больше изохорной, так как она учитывает потери газа на расширение.
Анализируя записанные выше равенства и проводя интегрирование по температуре и объему, приходим к следующему уравнению адиабаты:
Здесь γ — это показатель адиабаты. Он равен отношению изобарной теплоемкости к изохорной. Это равенство называется уравнением Пуассона для процесса адиабатического. Применяя закон Клапейрона-Менделеева, можно записать еще два аналогичных выражения, только уже через параметры P-T и P-V:
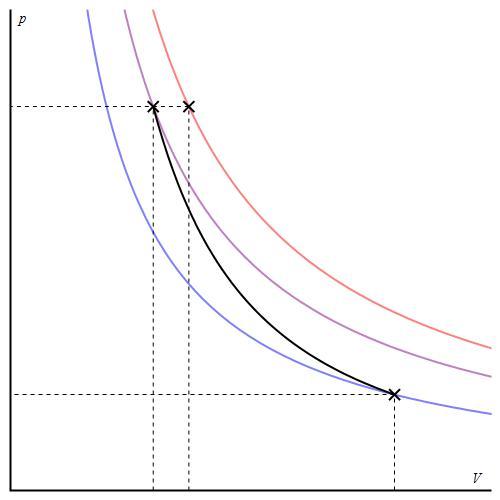
График адиабаты можно привести в различных осях. Ниже он показан в осях P-V.
Цветные линии на графике соответствуют изотермам, черная кривая — это адиабата. Как видно, адиабата ведет себя более резко, чем любая из изотерм. Этот факт просто объяснить: для изотермы давление меняется обратно пропорционально объему, для изобаты же давление изменяется быстрее, поскольку показатель γ>1 для любой газовой системы.
Пример задачи
В природе в горной местности, когда воздушная масса движется вверх по склону, то ее давление падает, она увеличивается в объеме и охлаждается. Этот адиабатический процесс приводит к снижению точки росы и к образованию жидких и твердых осадков.
Предлагается решить следующую задачу: в процессе подъема воздушной массы по склону горы давление упало на 30 % по сравнению с давлением у подножия. Чему стала равна ее температура, если у подножия она составляла 25 oC?
Для решения задачи следует использовать следующее уравнение адиабаты:
Его лучше записать в таком виде:
Если P1 принять за 1 атмосферу, то P2 будет равно 0,7 атмосферы. Для воздуха показатель адиабаты равен 1,4, поскольку его можно считать двухатомным идеальным газом. Значение температуры T1 равно 298,15 К. Подставляя все эти числа в выражение выше, получаем T2 = 269,26 К, что соответствует -3,9 oC.
http://spravochnick.ru/fizika/termodinamika/adiabatnyy_process_v_termodinamike/
http://1ku.ru/obrazovanie/58101-adiabaticheskij-process-i-uravnenija-adiabaty-dlja-idealnogo-gaza-primer-zadachi/