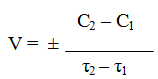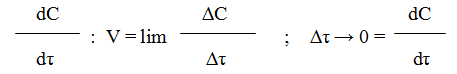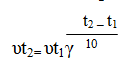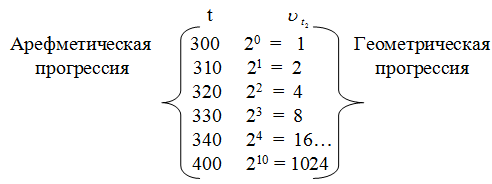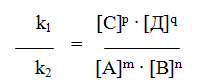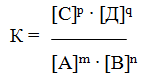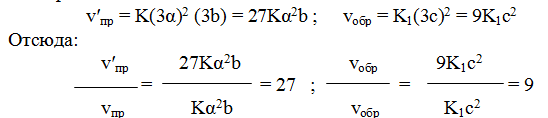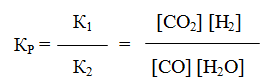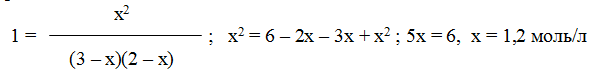Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается .
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором .
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например , при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
Какую зависимость характеризует кинетическое уравнение
MedBioGoogle
Навигация
Основные понятия химической кинетики. Химическая реакция.
Химической реакцией можно считать любое изменение вещества, при котором образуется или разрывается химическая связь между атомами. Химическая реакция характеризуется механизмом ее протекания и глубиной протекания.
Химические реакции, как правило, не происходят путем непосредственного взаимодействия исходных молекул с прямым переходом их в молекулы продуктов реакции. В большинстве случаев реакции протекают в несколько стадий. Например, окисление ионов двухвалентного железа в кислом растворе молекулярным кислородом состоит из ряда стадий:
Fe 2+ + HO2 × ® Fe 3+ + HO2 — Общее стехиометрическое уравнение
H2O2 + Fe 2+ ® Fe 3+ + OH — + OH × 4Fe 2+ + 4H + + O2 ® 4Fe 3+ + 2H2O
Fe 2+ + OH × ® Fe 3+ + OH —
Этот сложный путь оказывается тем не менее неизмеримо более выгодным,. Так как на одном из семи этапов не требуется встречи более чем двух частиц, и ни на одном из этапов не требуется соударение одноименно заряженных частиц. Совокупность стадий, из которых складывается химическая реакция, носит название механизма химической реакции.
Исходные, конечные и промежуточные вещества.
Вещества, вступающие в процесс химического превращения, называются исходными веществами. Вещества, образующиеся в процессе химического превращения и не претерпевающие в ходе этого процесса дальнейших химических изменений, называются продуктами реакции. Вещества, образующиеся в одних стадиях процесса химического превращения и расходующегося в других стадиях этого же процесса, называют промежуточными веществами.
Глубина превращения реакции.
Характеризует степень превращения исходных веществ в конечные продукты реакции. Проведенные измерения привели химиков к убеждению, что, во-первых, все мыслимые реакции в какой-то степени происходят, и во вторых, не существует реакций, идущих полностью до конца. Однако, часто удобнее говорить, что одни реакции совсем не идут, другие идут в ограниченной степени, а третьи потребляют исходные вещества полностью.
Гомогенные и гетерогенные реакции.
Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией.
Химическая реакция, протекающая на границах раздела фаз, называется гетерогенной химической реакцией.
Примером гомогенных реакции может служить любая реакция в растворе. Примером гетерогенной реакции может служить любая из реакций, идущих не поверхности твердого катализатора (гетерогенная каталитическая реакция).
Скорость химической реакции.
Важнейшей количественной характеристикой процесса химического превращения является скорость процесса. Понятие скорости характеризует количество вещества, вступающего в реакцию в единицу времени. Это определение однако, не совсем однозначно, ак как в реакции принимают участие в качестве исходных и промежуточных веществ и в качестве продуктов реакции также несколько веществ. Поэтому строго можно говорить не о скорости химического процесса вообще, а о скорости по некоторому компоненту. Изменение количества этого компонента принято выражать в числе молей N. Таким образом, для гомофазного химического процесса, идущего веществу называется изменение концентрации этого вещества в единицу времени. Пусть концентрация одного из реагирующих веществ 1 момент времени t1 равна С1, а в момент времени t2 равна С2. Тогда средняя скорость реакции ( ` V ) за промежуток времени t2 – t1 равна
Поскольку концентрация вещества (исходного) в процессе реакции убивает, то
C2 C1 и разность C2 – C1 имеет отрицательный знак, т.е. C2 – C1 = — D С. Отсюда
средняя скорость ` V = — ¾¾
Переходя к бесконечно малым изменениям можно отношение — ¾¾ заменить
на — ¾¾ ; В результате производная от концентрации по времени характеризует
dt мгновенную (истинную) скорость химической реакции:
Скорость химической реакции всегда является величиной положительной, отношение же dC/dt может иметь и положительное и отрицательное значение в зависимости от того представляет ли С концентрацию одного из исходных веществ или одного из продуктов реакции. В первом случае dC/dt 0, но так как скорость должна быть положительной, перед производной ставят минус; во втором случае dc/dt > 0 и чтобы скорость реакции имела положительное значение берут производную со знаком плюс. В общем случае кинетическое уравнение имеет вид
V = + ¾¾ . Однако, необходимо учитывать, что измерение по
dt разным веществам скорости не равны, а пропорциональны одна другой. Например, в реакции синтеза аммиака
на каждый исчезающий моль N2 расходуется 3 моля H2 и образуется 2 моля аммиака. Соответствующие скорости реакции соотносятся, как 1: 3: 2.
Скорость реакции имеет размерность [концентр] × [время] -1 . В химической кинетике концентрацию чаще всего выражают в моль/л, а время в секундах . Отсюда скорость химической реакции выражается в моль × л -1 × с -1 .
8.6. Измерение скорости реакции
В химической кинетике широко используется графический метод изображения функциональных зависимостей. Кривая, изображающая зависимость концентрации какого-либо вещества от времени в ходе процесса химического превращения, носит название кинетической кривой. Крутизна кинетической кривой в каждый момент времени характеризует истинную скорость реакции в этот момент времени, т.к. наклон касательной в точке численно равен скорости:V = — dc/dt = tg a
Часто под кинетическими кривыми понимают и другие зависимости изменения какого-либо изменяющегося параметра в ходе химической реакции (изменение рН, электропроводности, показателя преломления, оптической плотности и т.д.). Однако расссчитывать скорость накопления или расходования какого-либо из компонентов реакции, исходя из такой кривой, можно лишь в том случае, если существует и известна однозначная зависимость, связывающая концентрация этого компонента с измеряемым свойством системы.
Порядок реакции и константа скорости реакции
Скорость химической реакции зависит от целого ряда факторов. При заданных внешних условиях (температура, давление, среда в которой проходит процесс скорость является функцией концентрации реагирующих веществ. Зависимость скорости реакции от концентрации реагирующих вещества описывается основным постулатом химической кинетики: скорость реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, имеющихся в данный момент времени, возведенных в некоторые степени. Этот постулат вытекает из физически очевидного предположения о том, что реагируют те молекулы, которые сталкиваются. Известно, что число столкновений зависит от концентрации молекул, поэтому и скорость химической реакции должна определяться теми же факторами. Итак, можно записать для реакции:
А + В ® С + Д можно записать V = k[A] n 1 × B n 1 , где величины n принято называть порядком реакцию по веществу А и В и т.д. Сумму порядков реакции по всем реагирующим веществам называют порядком реакции.
Следует подчеркнуть, что величины n1 и n2 определяются только экспериментальным путем, т.к. для подавляющего большинства реакций порядки реакции по веществу не равнозначны стехиометрическим коэффициентом.
Порядок реакции – величина формальная. Он может быть положительным или отрицательным, целым или дробным, а также нулевым числом. Как было уже указано, порядок реакции определяется опытным путем, и его нельзя предсказать заранее, даже для формально простых реакций. Например, скорость реакции H2 + I2 = 2HI Согласно опытным данным может быть записана следующим образом: V = k[H2][I2], где порядок реакции по водороду и йоду равен единице, а порядок реакции в целом равен 1 + 1 = 2. В этом случае стехиометрическое уравнение правильно изображает элементарный акт реакции.
Однако, в большинстве сложных реакций, протекающих через несколько стадий, когда общее стехиометрическое уравнение не отражает действительного хода реакции показатели степени в уравнении скорости реакции не будут соответствовать стехиометрическим коэффициентам, т.е. закон действия масс для химических реакций выполняется лишь в некоторых частных случаях.
Можно утверждать, что стехиометрическое уравнение реакции устанавливающее пропорции реагентов и продуктов, не определяет механизма протекания этой реакции во времени. Это является причиной, по которой экспериментально найденный порядок не всегда согласуется с уравнением, описывающим реакцию.
Множитель k в уравнении, показывает с какой скоростью идет химический процесс при концентрациях реагирующих веществ, равных
1 моль/л, называют константой скорости химического процесса. Она не зависит от концентрации и характеризует лишь влияние природы реагирующих веществ на скорость их взаимодействия друг, с другом, т.е. константа скорости реакции является мерой реакционной способности молекул.
Размерность констант скорости реакции различного порядка легко получить из выражения для скорости реакции.
Нулевой порядок V = — ¾¾¾ = ko; ko = [c][t] -1
Первый порядок V = — ¾¾¾ = k1c; ko = [t] -1
Второй порядок V = — ¾¾¾ = k2c 2 ; ko = [c -1 ][t] -1
Константы скорости реакций разных порядков имеют разные размерности и, поэтому их сравнение не имеет смысла. Хотя скорость некоторых химических реакций описывается кинетическим уравнением третьего порядка, однако это еще не значит, что они являются тримолекулярными. Все же укажем
Молекулярность реакции определяется числом молекул, одновременно сталкивающихся и приводящим к химическим превращениям. Взаимодействие подобного рода носят название элементарного акта химического превращения, т.е. молекулярность реакции, в отличие от порядка реакции имеет вполне определенный физический смысл. Например, реакция: I2 = 2I – мономолекулярная, т.к. в ее основе лежит распад исходного вещества; реакция H2 + I2 = 2HI – бимолекулярная. Реакция 2NO + H2 = N2O + H2O является примером тримолекулярной реакции. Молекулярность более высокого порядка не встречается, т.к. одновременное столкновение четырех частиц почти невероятно.
В случае сложных реакций, протекающих в несколько стадий, нет смысла говорить о молекулярности реакции в целом, поскольку это понятие имеет отношение применимо только к отдельным стадиям.
Различие между молекулярностью и порядком реакции можно свести к следующему:
1) молекулярность реакции имеет вполне определенный физический смысл, а порядок реакции – величина формальная;
2) порядок реакции может принимать любые значения: целые, дробные и даже отрицательные, численные значения молекулярности ограничены лишь тремя цифрами 1,2,3.
3) Порядок реакции можно использовать для характеристики любых реакций (как сложных, так и простых), понятие “молекулярность” применимо только к элементарным актам химических превращений.
Количественные, соотношения между скоростью реакции и концентрации реагента.
В реакции первого порядка скорость реакции пропорциональна концентрации одного реагента
Для них V = — ¾¾¾ = k c
Для нахождения С в каждый момент времени t это уравнение необходимо проинтегрировать:
— ¾¾¾ = k c ¾¾¾ = k dt или после интегрирования:
ln c = — kt + const. Значение const находим из начального условия, из которых следует, что Со — начальная концентрация в момент времени t = 0. Определим постоянную., как ln Со. Отсюда ln с = — kt + lnCo; ln C — lnCo = — kt; ln C/Co = -kt
или k = 1/t ln ¾¾ ; заменим на десятичные логарифмы, получим k= ¾¾¾ lg ¾ .
Особенность реакции первого порядка заключается в том, что равным промежуткам времени отвечают равные доли Со/С прореагировавшего вещества. Время t, нужное для того, чтобы прореагировала половина Со, называется периодом полупревращения: подставляя в уравнение t1/2 = t и
С = Со/2, получим: t1/2 = ¾¾¾ , т.е. для реакции первого порядка период
K полупревращения t1/2 не зависит от начальной концентрации и служит характеристикой скорости таких реакций.
Реакция второго порядка
Выражение скорости для реакции второго порядка имеет вид: V = -dc/dt= k × c1 × c2 или V = — dc/dt = kc 2 ; Разделяя переменные, получим –dc/c 2 = k dt; После интегрирования получим: 1/c = kt + const; при Co и t = 0 определяем постоянную интегрирования, равную 1/С0. Отсюда 1/С = kt + 1/Co или 1/С – 1/Со = kt;
Период полупревращения для реакции второго порядка не остается постоянным, а обратно пропорционален начальной концентрации:
Уравнение скорости реакции третьего порядка.
Хотя скорость некоторых химических реакций описывается кинетическим уравнением третьего порядка, тем не менее это еще не значит, что они действительно тримолекулярные. Однако оно удобно для вывода кинетического уравнения:
V = — dc/dt = kc 3 ; После интегрирования получим
½ ( ¾¾ × ¾¾¾ ) = kt или ½ ( ¾¾¾ × ¾¾ ) = kt, если а — исходная
С 2 Со 2 ( а-х) 2 а 2
концентрация, (а-х) – количество вещества оставшегося ко времени t. Если реакция протекает по уравнению: 2А + В ® продукты и если [B] не равна [A], то интегрирование выражения для скорости реакции третьего порядка значительно усложняется
Уравнение скорости реакции нулевого порядка.
Если в уравнении скоростми отсутствуют члены, содержащие концентрацию реагирующих веществ, то скорость такой реакции выражается уравнением нулевого порядка.
Реакция нулевого порядка представляет особый интерес в каталитических процессах, когда катализатор, взятый в определенном количестве, может служить фактором, лимитирующим скорость реакции. Такая ситуация встречается в ферментативной кинетике и будет рассмотрена на следующей лекции.
Определение порядка реакции.
Порядок реакции играет существенную роль при изучении и раскрытии механизма реакции. Он в значительной степени зависит от механизма реакции. Порядок реакции определяется опытным путем и его нельзя предсказать заранее, даже для реакции формально похожих.
а) Для определения порядка реакции часто используют способ подстановки. Он заключается в выборе уравнения кинетики реакции (нулевого, первого, второго порядка) при подстановке в которое экспериментальных данных, получается постоянное значение константы скорости реакции.
б) Существует и графический способ определения порядка реакции. Например, для реакции нулевого порядка скорость реакции не зависит от концентрации. Для реакции первого порядка прямолинейной является зависимость ln C от времени. Для реакции второго порядка линейной будет зависимость 1/С от времени.
в) Используется также определение зависимости от концентрации константы полупревращения и т.д.
Теоретические основы химической кинетики.
В основе современной химической кинетики лежат две теории: теория активных соударений и теория активного комплекса.
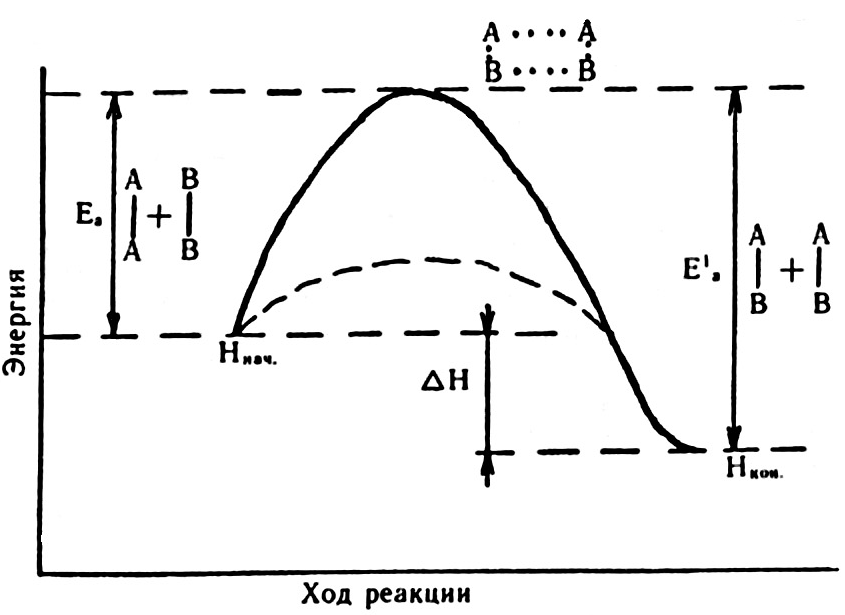
Теория активных соударений была сформулирована С.Аррениусом в 1889 году. В основе этой теории лежит представление о том, что для протекания химической реакции необходимо соударение между молекулами исходных веществ, а число соударений определяется интенсивностью теплового движения молекул, т.е. зависит от температуры. Но не каждое соударение молекул приводит к химическому превращению: к нему приводит лишь активное соударение. Тот минимальный запас энергии, которым должны обладать молекулы исходных веществ для того, чтобы их соударение было активным, называют энергетическим барьером реакции. Наглядное представление об энергетическом барьере реакции дает графическое изображение энергетики химической реакции.
В качестве абсциссы в этих диаграммах используется так называемая координата реакции. Вообще говоря, она является сложной функцией межатомных расстояний. Но для практических целей и простых молекул можно считать, что она характеризует изменение в межатомных расстояниях, которые происходят при сближении исходных молекул, образующих активированный комплекс, и взаимном удалении продуктов реакции при распаде активированного комплекса. По оси ординат откладывается потенциальная энергия всей системы.
То дополнительное количество энергии, которое нужно добавить к средней энергии молекул исходных веществ, чтобы соударение стало активным, называется энергией активации.
Энергия активации ощутимо влияет на значение константы скорости реакции и ее зависимости от температуры: чем больше Еа, тем меньше константа скорости и тем значительнее влияет на нее изменение температуры. Константа скорости реакции связана с энергией активации сложной зависимостью, описанной уравнением Аррениуса: k = A × l -Ea/RT , где А – так называемое число “число соударений” представляет собой число соударений в одну секунду между одной молекулой вещества А и одной молекулой вещества В, заключенных в объеме в 1см 3 .
Однако, наблюдаемые константы скорости реакции, как правило, гораздо меньше, вычисленных по уравнению. Поэтому уравнение для константы скорости реакции видоизменяют следующим образом: k = P × Z × l -Ea/RT , где Z – теоретическое число столкновений, а Р – так называемый фактор вероятности или стерический, учитывает все влияния, вызывающие отклонения от идеального уравнения. Необходимость ориентации может заметно тормозить даже сравнительно простые реакции. Хорошо изученным примером является реакция: Н2 + I2 ® 2НI
Для того, чтобы простое соударение дало две молекулы йодистого водорода, надо, чтобы ориентация молекулы была сходна с той, которая изображена на рис.
Энергия активации этой реакции невелика, но скорость мала. Это связано с довольно жесткими требованиями, предъявляемыми к ориентации реагирующих молекул. Тогда А = РZ, т.е. А характеризует чсло соударений С благоприятной ориентацией и называется предэкспоненциальным множителем.
Используя уравнение Аррениуса, можно определить энергию активации Еа. Для этого уравнение Аррениуса удобно применять в логарифмической форме:
ln k = lnA — Ea/R × 1/T или
Если построить график lg k от 1/Е, то получим прямую отсекающую на оси ординат отрезок, равный lg А и имеющую тангенс угла, равный – Еа/2,303R, т.е. tg a = — Еа/2,303R, откуда Еа = -2,303 R tg a
Из уравнения видно, что константа скорости реакции k является произведением двух сомножителей. Предэкспоненциальный множитель А практически не зависит от температуры, т.к. последняя не влияет на взаимную ориентацию молекул. Экспоненциальный множитель l -Ea/RT , который характеризует долю активных соударений от общего числа двойных соударений, сильно зависит от температуры. Теория двойных соударений внесла в химическую кинетику новые представления об активных соударениях и об энергии активации, но эта теория не рассматривала механизм самого соударения, что является ее недостатком.
Менее строгую зависимость константы скорости реакции от температуры в отличие от уравнения Аррениуса дает правило Вант-Гоффа, которое носит эмпирический характер. В 1884 г. Вант-Гофф установил, что при повышении температуры на 10 о С скорость большинства реакций увеличиатся в 2-4 раза. Математически эта зависимость выражается соотношением:
¾¾¾¾ = ¾¾¾¾ = g , где VT и kT – скорость и константа реакции при
VT kT температуре Т: g = 2 ¸ 4 — температурный коэффициент скорости реакции . В общем случае, если температура изменилась на D Т = Т2 – Т1, то уравнение принимает вид:
Следует отметить, что правило Вант-Гоффа можно использовать лишь в узких интервалах температур. Дело в том, что с повышением температуры g уменьшается и при очень высоких температурах может стать даже меньше единицы. В случае ферментативных реакций даже интервал в 10 о С может быть достаточно большим. Для того, чтобы не ошибиться рекомендуется при использовании g использовать более узкий интервал (2 о , 3 о , 5 о ) и полученные результаты приводить к величине
8.17. Теория активированного (переходного) комплекса (переходного состояния
Эта теория – простейший и исторический первый вариант статистической теории химических реакций. Она разработана Э.Вагнером, М.Поляни, Г.Эйрнингом и М.Эвансом в 30-ых годах двадцатого века.
8.18. Вывод основного уравнения теории переходного состояния.
В основу теории также пополнено представление о столкновении молекул как непременном условии реакции. Но она рассматривает то, что происходит в момент столкновения. Для реакции А+В = С в соответствии с теорией переходного состояния следует: А + В « х * ® С, где х * — переходной комплекс. Что подразумевается под переходным комплексом. После столкновения молекул А и В начинается перераспределение химических связей и образование переходного комплекса и переходной комплекс представляет такое состояние взаимодействующих молекул, когда старые связи еще не полностью разорвались, а новые еще не полностью сформировались. В результате мы имеем состояние промежуточное между А,В и С. Переходное состояние характеризуется непрерывным изменением расстояний между взаимодействующими атомами. В этом существенное отличие переходного комплекса от обычной молекулы, в которой средние расстояния между атомами не зависят от времени. Переходный комплекс также не следует путать с промежуточными веществами. Он является динамической структурой, для образования которой требуется затрата энергии. Энергия, необходимая для перевода реагирующих молекул в состояние переходного комплекса носит название энергии активации. Так как исходные молекулы еще не распались, то энергия перехода в активированное состояние меньше энергии разрыва связей в молекулах исходных веществ: Еа Едиссоциации. Таким образом, формирование переходного комплекса – процесс энергетически более выгодный, чем полный распад, вступающих в реакцию молекул. С другой стороны, превращение активированного комплекса в продукты реакции всегда является экзотермическим процессом.
1) Основной постулат теории переходного состояния состоит в том, что исходные вещества всегда находятся в равновесии с переходным комплексом.
В этом случае k химического равновесия переходного комплекса равна:
k * x.p. = ¾¾¾¾ и концентрация
Затем ПК распадается необратимо с образованием продукта С. (характеристикой (количественной) распада будет частота распада ПК – Р. Из статистической механики известно, что Р зависит только от температуры. Эта зависимость имеет вид: Р = kТ/h, где – постоянная Больцмана; h – постоянная Планка; Т – абсолютная температура. Значит, для данной температуры число Р одинаково для всех переходных состояний, а скорость любой химической реакции определяется лишь концентрации определяется лишь концентрации ПК:
Концентрация ПК связана с концентрацией реагентов и поэтому, подставив их выражения, получим:
К обычной реакции взаимодействия применим закон действия масс:
V = kv[А][B], символ kv употребляется для константы скорости в отличие от константы Больцмана. Приравняем правые части уравнений и получим:
Из уравнения видно, что при данной температуре константа скорости реакции зависит от константы химического равновесия образования ПК и от частоты распада ПК. Уравнение называется основным уравнением теории переходного состояния.
8.19. Термодинамическая форма основного уравнения теории переходного состояния.
Термодинамические данные позволяют связать kx.p. * со стандартной свободной энергией образования переходного комплекса D G ¹ , называемый также свободной энергией активации: D G’ ¹ = -RT ln k * x.p.
откуда k * x.p. = e — D G/RT
Тогда для константы скорости химической реакции можно записать
Из этого уравнения видно, что скорость реакции определяется свободной энергией активации D G ¹ , а не Еа, как это следует из теории активных соударений Аррениуса.
Поскольку D G ¹ = D Н ¹ — Т D S ¹ , то
k * x.p. = e — D S/R — D H/RT
или по теории переходного состояния kv равна:
kV = ¾¾ × × e — D S/R — D H/RT или
kV = ¾¾ × × e — D S/R × e — D H/RT
т.е. мы получили термодинамическую форму основного уравнения теории переходного состояния.
8.20. Сравнение термодинамической формы основного уравнения теории переходного состояния с уравнением Аррениуса.
При сравнении уравнения для ТПС с уравнением Аррениуса видно, что
¾¾ × × e — D S/R соответствует А в уравнении Аррениуса.
Т.е. А = ¾¾ × × e — D S/R
Значит определив опытным путем А, можно рассчитать энтропию активации D S ¹ , которая дает важную информацию о механизме образования активированного комплекса. Например, чем более жестко связывается фермент с субстратом, т.е. образуется большее число связей, тем больше уменьшается D S ¹ . Величина D Н ¹ практически равна энергии активации и при сравнении с выражением получается, что kT ¹
Поскольку Z – теоретическое число столкновений и kT/h практически постоянны, вероятностный фактор Р будет, очевидно, связан с энтропией активации D S ¹ . Если она велика и положительна, то фактор Р велик, и реакция будет быстрой. Конечно, это вывод. Но если D S ¹ отрицательна и мала, то реакция будет медленной, т.е. чем больше возрастание энтропии, тем больше вероятность переходного состояния.
Поскольку kT/h соответствует Z и равно при 298К 6,3 × 10 -12 сек -1 , то это число равно числу активных комплексов, разлагающихся за одну секунду в одном см 3 или количеству соударений в 1 секунду в 1 см 3 .
Таким образом, скорость реакции, согласно теории переходного состояния, зависит от двух факторов.
1. Энергетический фактор — D Н ¹ , энтальпия активации. Чем больше энтальпия активации, тем меньше скорость реакции.
2. Энтропийный фактор — D S ¹ , энтропия активации. Чем больше энтропия активации, тем больше скорость реакции.
Учет энтропийного фактора для кинетики реакций во многих отношениях оказался плодотворным и впервые позволил установить связь константы скорости со строением молекул реагирующих веществ. При этом теория ПС оперирует, в частности, величинами расстояний между атомами в молекулах, взаимной ориентацией молекул. Т.е. параметрами геометрического характера.
Теория активных соударений позволяет при знании энергии активации рассчитать общее число эффективных соударений и отсюда скорость реакции, не объясняя механизма реакции. В отличие от теории активных соударений теория ПК сопоставляет различные возможные комплексы, выявляет большую или меньшую их достижимость и определяет в результате энергетически наиболее выгодный путь реакции.
Для вычисления скоростей взаимодействие двух атомов две теории дают одинаковые результаты. В случае нелинейных многоатомных молекул теория ПК дает значение скоростей отличных от значений, даваемой теорией соударений. Если известна конфигурация реагирующих молекул и активного комплекса, теория ПК позволяет рассчитать предэкспоненциальный множитель. К сожалению, в большинстве случаев строение активированного комплекса и его свойства неизвестны и это затрудняет расчеты.
Таким образом две теории дополняют друг друга. Теория ПК применяется для вычисления абсолютных скоростей электродных процессов, процессов диффузии и т.д. Теория активных соударений хорошо описывает, как правило, реакции в газовой среде.
Химическая кинетика и равновесие. Принцип Ле Шателье
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Химическая кинетика и равновесие
- 6.1. Понятие о скорости химических реакций
- 6.2. Зависимость скорости реакции от концентрации реагентов
- 6.3.Влияние температуры на скорость реакции
- 6.4. Энергия активации
- 6.5. Понятие о катализе и катализаторах
- 6.6. Химическое равновесие. Принцип Ле Шателье
Кинетика — учение о скорости различных процессов, в том числе химических реакций. Критерием принципиальной осуществимости реакций является неравенство ∆Gp.T. 0 298 H2O (u) = – 228,59 кДж/моль, a ∆G 0 298 АlI3(к) = -313,8 кДж/моль и, следовательно, при T = 298 К и р= 1,013.10 5 Па возможны реакции, идущие по уравнениям:
Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платина для первой и вода для второй). Катализатор как бы снимает кинетический «тормоз» и проявляется термодинамическая природа вещества.
6.1. Понятие о скорости химических реакций. Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (в случае гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенной реакции). Скорость реакции обычно характеризуются изменением концентрации какого-либо из исходных или конечных продуктов реакции в единицу времени и чаще всего выражают в моль/л · с.
Различают среднюю скорость химической реакции за данный промежуток времени и истинную скорость реакции в данный момент времени. Если в момент времени концентрация вещества была C1, а для момента она стала C2, то средняя скорость реакции для интервала времени τ2 – τ1 будет равна
Знак минус пишут в том случае, если концентрация вещества во времени уменьшается (исходное вещество), а знак плюс – если концентрация увеличивается (продукт реакции). Скорость реакции всегда положительна. Истинная скорость в данный момент определяется пределом, к которому стремится выражение при ∆τ → 0, т.е. первой производной от концентрации по времени:
Измерить среднюю и истинную скорость химической реакции можно, найдя зависимость изменения концентрации реагирующих веществ в системе от времени.
Об изменении концентрации веществ в системе можно судить или непосредственно, или определяя какое-либо свойство реакционной системы. Это может быть вес осадка, образующегося в ходе реакции, объем реакционной системы, давление, цвет, электропроводность и т.п.
Скорость химических реакций зависит от многих факторов, основные из которых — концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе.
6.2. Зависимость скорости реакции от концентрации реагентов. Чтобы атом и молекулы смогли вступить в реакцию, необходимо их столкновение друг с другом, так как силы химического взаимодействия действуют только на очень малом расстоянии. Чем больше молекул реагирующих веществ в единице объема, т.е. чем больше их концентрация, тем чаще будут происходить столкновения и тем быстрее будут идти химические реакции. Поэтому увеличение концентрации реагирующих веществ ускоряет ход химической реакции. На основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакций от концентрации реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для реакции, протекающей по уравнению А + В = С + Д, этот закон выразится уравнением:
где: СА и СВ – молярные концентрации вещества А и В;
k – коэффициент пропорциональности, называемой константой скорости реакции.
Основной закон химической кинетики часто называют законом действующих масс. Из уравнения (1) нетрудно установить физический смысл константы скорости k; она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1моль/л или когда их произведение равно единице.
Следует иметь в виду, что понятие скорости реакции относится к данной реакции, а не к отдельным реагирующим веществам. Очевидно, что для каждой реакции при постоянной температуре ее константа скорости будет величиной постоянной, и, следовательно, зная k , можно сравнивать скорости химического взаимодействия различных веществ: чем больше k , тем быстрее реагируют данные вещества. Константа скорости реакции зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентрации вещества.
Уравнение (1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Для реакции, записанной в общем виде , кинетическим уравнением будет
где: m и n – коэффициенты в уравнении реакции.
Уравнение (2) является общим алгебраическим выражением закона действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам соответствующих веществ в уравнении реакции.
Основной закон химической кинетики не учитывает концентрации реагирующих веществ в твердом состоянии, ибо их концентрации постоянны и они реагируют лишь на поверхности, которая остается неизменной. Так, например, для реакции горения угля кинетическое уравнение реакции имеет вид:
где: k – константа скорости;
СС – концентрация твердого вещества;
S – площадь поверхности.
Это величины постоянные. Обозначим произведение постоянных величин через k 1 , получим т.е. скорость реакции пропорциональна только концентрации кислорода.
6.3.Влияние температуры на скорость реакции. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением
где: – скорости реакции соответственно при началом (t1) и конечной (t2) температурах;
γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличится скорость реакции с повышением температуры реагирующих веществ на 10 градусов.
Дадим иную формулировку уравнения (1). Примем скорость реакции при начальной температуре (например, при 300 ° С) за 1 и будем выражать с помощью уравнения (1) скорость реакции , определяя ее для разных температур (с интервалом в 10 ° ). Тогда получим:
Из этого легко вывести следующее правило: при повышении температуры в арифметической прогрессии скорость реакции возрастает в геометрической прогрессии.
Температура влияет на скорость реакции, увеличивая константу скорости. Отношение, показывающее, во сколько раз увеличилась константа скорости при увеличении температуры на 10 ° , называется температурным коэффициентом скорости реакции, т.е.
Зависимость скорости реакции от температуры более точно выражается уравнением Аррениуса
6.4. Энергия активации. Быстрое изменение скорости реакции с изменением температуры объясняет теория активации. Почему нагревание вызывает столь значительное ускорение химических превращений? Для ответа на этот вопрос нужно вспомнить, в чем заключается сущность химической реакции.
Химическое превращение происходит тогда, когда возникают условия для перераспределения электронной плотности столкнувшихся частиц. Этот процесс требует затраты времени и энергии. Мгновенных процессов в природе вообще не существует.
Реакционно-способную систему можно охарактеризовать тремя последовательно совершающимися состояниями:
[начальное] → [переходное] → [конечное]
Для реакции взаимодействия газообразных веществ A2 и B2:
можно записать ее состояние
Рис. 22. Изменение энергии реагирующей системы
Переходное состояние системы отвечает образованию так называемого активированного комплекса (A2B2). В этом комплексе происходит перераспределение электронной плотности между атомами: связи A―B начинают образовываться одновременно с разрывом связей A―A и B―B. В активированном комплексе как бы объединены «полуразрушенные» молекулы A2 и B2 и «полуобразовавшиеся» молекулы AB. Активированный комплекс существует очень короткое время (порядка 10 -13 с). Его распад приводит к образованию молекул AB либо молекул A2 и B2. Образование активированного комплекса требует затраты энергии. Вероятность того, что при столкновении двух молекул образуется активированный комплекс и произойдет реакция, зависит от энергии сталкивающихся частиц. Реагируют только те из молекул, энергия которых для этого достаточна. Такие молекулы называют активными. Необходимую для перехода веществ в состояние активированного комплекса энергию называют энергией активации (Eа). Ее определяют опытным путем и обычно выражают в кДж/моль. Так, например, для соединения водорода и йода Eа = 167,4кДж/моль, а для распада йодоводорода Eа = 186,2кДж/моль.
Энергия активации зависит от природы реагирующих веществ и служит характеристикой каждой реакции.
Энергетические изменения в реагирующей системе можно представить схемой, которая изображена на рис. 22.
Здесь ось абсцесс характеризует ход реакции: исходное состояние → переходное состояние → конечное состояние. По оси ординат отложена потенциальная энергия системы. Исходное состояние имеет энергию Hнач., конечное – Hкон. Разность энергий начального и конечного состояний системы равна тепловому эффекту реакции ∆H:
Энергия активированного комплекса выше энергии начального и конечного состояний системы. Таким образом, энергия активации – это своеобразный энергетический барьер, который отделяет исходные вещества от продуктов реакции.
Обратная реакция – превращение АВ в газообразные A2 и B2, естественно, также протекает через образование активированного комплекса A2B2. но величина энергии активации в этом случае иная, чем при синтезе АВ.
Как видно из рис. 22, затраченная на активацию молекул энергия затем, при образовании продуктов реакции, полностью или частично выделяется. Если при распаде активированного комплекса выделяется энергии больше, чем это необходимо для активирования молекул, то реакция экзотермическая, а в противном случае – эндотермическая.
Итак, скорость реакции непосредственно зависит от числа молекул, обладающих энергией, достаточной для образования активированного комплекса, а следовательно, способных к химическому превращению. Чем больше в системе активных молекул, тем скорость реакции больше. Один из путей увеличения числа активных молекул – нагревание.
6.5. Понятие о катализе и катализаторах. Катализом называется изменение скорости химических реакций в присутствии веществ – катализаторов. Катализаторы – это вещества, изменяющие скорость реакции за счет участия в промежуточном химическом взаимодействии с компонентами реакции, но восстанавливающие после каждого цикла промежуточного взаимодействия свой химический состав.
Различают положительный и отрицательный катализ. В случае положительного катализа скорость химической реакции при введении катализатора возрастает, например, получение серной кислоты или окисление аммиака в азотную кислоту с помощью платины. При отрицательном катализе, – наоборот, уменьшается, например, замедление взаимодействия раствора сульфита натрия с кислородом воздуха в присутствии этилового спирта. Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, снижающие скорость реакции, ингибиторами (механизм действия последних отличен от катализаторов).
Химические реакции, протекающие в присутствии катализаторов, называются каталитическими. На большинство химических реакций может быть оказано каталитическое воздействие. Число катализаторов велико. Их каталитическая активность весьма различна. Она определяется изменением скорости реакции, вызываемым катализатором.
Различают два вида катализа – гомогенный (однородный) и гетерогенный (неоднородный) катализ.
При гомогенном катализе реагирующие вещества и катализатор образуют однородную систему – газовую или жидкую. В этом случае между катализатором и реагирующими веществами отсутствует поверхность раздела. Примером может служить каталитическое окисление оксида серы (IV) оксидами азота в камерном способе получения серной кислоты (газовая фаза), а также действие разнообразных ферментов в биологических процессах. Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
При гетерогенном катализе реагирующие вещества и катализаторы образуют систему из разных фаз. В этом случае между катализатором и реагирующими веществами существует поверхность раздела. Обычно катализатор является твердым веществом, а реагирующие вещества – газами или жидкостями. Например, окисление аммиака (газообразная фаза) в присутствии платины (твердая фаза). Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность твердого катализатора будет зависеть и от свойств его поверхности (размера, химического состава, строения и состояния).
Действие положительных катализаторов сводится к уменьшению энергии активации реакции, другими словами, к снижению высоты энергетического барьера (см. рис. 22, пунктирная кривая).
В присутствии катализатора образуется активированный комплекс с более низким уровнем энергии, чем без него, а потому скорость реакции резко возрастает.
Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ. Так, если медленно протекающую реакцию A + B = AB вести в присутствии катализатора K, то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя непрочное промежуточное соединение:
Реакция протекает быстро, так как энергия активации этого процесса мала. Затем промежуточное соединение АК взаимодействует с другим исходным веществом, выделяя катализатор К в свободном состоянии:
Энергия активации этого процесса также мала, а потому реакция протекает с достаточной скоростью. Если теперь оба процесса, протекающие одновременно, суммировать, то получим окончательное уравнение уже быстро протекающей реакции:
Поверхность катализатора неоднородна. На ней имеются так называемые активные центры, на которых, главным образом, и протекают каталитические реакции. Реагирующие вещества адсорбируются на этих центрах, в результате чего увеличивается концентрация их на поверхности катализатора. Это отчасти приводит к ускорению реакции. Но главной причиной возрастания скорости реакции является сильное повышение химической активности адсорбированных молекул. Под действием катализатора у адсорбированных молекул ослабляются связи между атомами и они делаются более реакционноспособными. В этом случае реакция ускоряется благодаря снижению энергии активации (в том числе за счет образования поверхностных промежуточных соединений).
Некоторые вещества снижают или полностью уничтожают активность твердого катализатора. Такие вещества называются каталитическими ядами.
В качестве примера можно привести соединения мышьяка, ртути, свинца, цианиды, к которым особенно чувствительны платиновые катализаторы.
Однако имеются и такие вещества, которые усиливают действие катализаторов данной реакции, хотя сами катализаторами не являются. Эти вещества называются промоторами (например, промотирование платиновых катализаторов добавками железами, алюминия и др.).
Следует особо отметить, что действие катализаторов избирательно, поэтому применяя разные катализаторы, можно получить из одного и того же вещества разные продукты. Для каждой реакции имеется свой наилучший катализатор.
Роль катализаторов в химическом производстве исключительно велика. (например, получение серной кислоты, синтез аммиака, получение из твердого угля жидкого топлива, переработка нефти и природного газа, получение искусственного каучука и т.д.). Большая роль принадлежит биологическим катализаторам – ферментам– особым веществам животного или растительного происхождения, являющихся белками. Они обладают каталитическим действием по отношению к некоторым биохимическим реакциям за счет понижения их очередной инактивации.
6.6. Химическое равновесие. Принцип Ле Шателье. Реакции, которые протекают в одном направлении и идут до конца, называются необратимыми. Их не так много. Большинство реакций являются обратимыми, т.е. они протекают в противоположных направлениях и не идут до конца. Например, реакция J2 + H2 2HJ при 350°С является типичной обратимой реакцией. В этом случае устанавливается подвижное химическое равновесие и скорости прямого процесса и обратного делаются равными.
Химическое равновесие – такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
Химическое равновесие называют динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно.
Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными концентрациями. Обычно их обозначают при помощи квадратных скобок, например, [J2], [H2], [HJ] в отличие от неравновесных, обозначаемых СJ2, Cн2, СнJ
Количественной характеристикой химического равновесия служит величина, называемая константной химического равновесия. Изобразим обратимую реакцию в общем виде:
Согласно закону действующих масс, скорости прямой (V1) и обратной (V2) реакций выражаются уравнениями:
При равновесии скорости прямой и обратной реакций равны друг другу, откуда
Но k1 и k2 для данной реакции при одной и той же температуре являются величинами постоянными, а значит, и их отношение будет величиной постоянной. Обозначим его через К, получим
где: К – константа химического равновесия.
Она зависит от температуры и природы реагирующих веществ, но не зависит от их концентрации. Константа равновесия показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции, если концентрации каждого из реагирующих веществ равна 1 моль/л. В этом физический смысл К. Значения К находят путем расчета или на основании экспериментальных данных. Константа равновесия – важная характеристика реакции. По ее значению можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
На состояние химического равновесия оказывает влияние концентрация реагирующих веществ, температура, а для газообразных веществ – и давление.
При изменении одного из этих параметров равновесие нарушается, и концентрация всех реагирующих веществ будет изменяться до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций.
Подобный переход реакционной системы из одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия. Если при изменении условий увеличивается концентрация конечных веществ, то говорят о смещении равновесия вправо. Если же увеличивается концентрация исходных веществ, то равновесие смещается влево.
Направление смещения химического равновесия при изменениях концентрации реагирующих веществ, температуры и давления (в случае газовых реакций) определяется общим положением, известным под названием принципа подвижного равновесия или принципа Ле Шателье: если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяется концентрация, температура, давление), то оно благоприятствует протеканию одной из двух противоположных реакций, которая ослабляет воздействие. Поясним это правило на примере синтеза аммиака:
Если увеличить концентрации азота или водорода, то это будет благоприятствовать реакции, протекающей с уменьшением концентрации этих веществ, т.е. равновесие сместится вправо. Наоборот, при увеличении концентрации аммиака равновесие сместится влево.
Поскольку прямая реакция протекает с выделением тепла, то повышение температуры будет благоприятствовать реакции с поглощением тепла, т.е. равновесие будет смещаться влево. Наоборот, понижение температуры вызовет смещение равновесия вправо.
Чтобы решить вопрос, как влияет на смещение равновесия изменение давления, надо подсчитать число молей газообразных веществ в левой и правой частях уравнения. В приведенном примере в левой части уравнения содержится 4 моль (4 объема), а в правой – 2 моль (2 объема). Поскольку увеличение давления должно благоприятствовать процессу, ведущему к уменьшению объема, то в данном случае равновесие сместится вправо. Уменьшение давления сместит равновесие влево. Если же в уравнении обратимой реакции число молей в левой части равно числу молей в правой части, то изменение давления не вызывает смещения химического равновесия.
Следует отметить, что все катализаторы одинаково ускоряют как прямую, так и обратную реакции и поэтому на смещение равновесия влияние не оказывают, а только способствуют более быстрому его достижению.
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе
если объем газовой смеси уменьшится в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [SO2] = а,
[О2] =b, [SO3] == с. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объема равны
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а, [О2] = Зb; [SO3] = Зс. При новых концентрациях скорости v’пр прямой и обратной реакций:
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной — только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70° С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции vT2. при 70 0 С больше скорости реакции vT1 при 30° С в 16 раз.
Пример 3. Константа равновесия гомогенной системы
при 850 0 С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СO]исх = 3 моль/л, [H2O]иcx = 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
В условии задачи даны исходные концентрации, тогда как в выражение Кр входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [CO2]p = x моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и H2O расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ (моль/л):
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:
Таким образом, искомые равновесные концентрации: [СO2]р = 1,2 моль/л; [H2]p = 1,2 моль/л; [СO]р= 3-1,2 = 1,8 моль/л; [Н2O]р =2-1,2 =0,8 моль/л.
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РС15?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения РС15 эндотермическая (H > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру: б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РС15, так и уменьшением концентрации РС13 или Сl2.
http://www.sites.google.com/site/1bio1med1/home/immunologia/ekologia/biomembranes-and-cell-architecture/pervoe-nacalo-termodinimiki-/vtoroe-nacalo-termodinamiki-i-ego-primenenie-/trete-nacalo-termodinamiki-rascety-izmenenia-entropii-pri-razlicnyh-processah-/himiceskij-potencial-/himiceskoe-ravnovesie-v-geterogennyh-i-gomogennyh-sistemah-/rastvory-elektrolitov-/osnovnye-ponatia-himiceskoj-kinetiki
http://farmf.ru/lekcii/himicheskaya-kinetika-i-ravnovesie-printsip-le-shatele/