Термическое и калорическое уравнения состояния. Термическое уравнение состояние идеального газа
Второй постулат ТД приводит к существованию функциональных соотношений, называемых уравнения состояния, устанавливающих связь между внешними параметрами, температурой и каким-либо внутренним параметром состояния макросистемы. Т.е. параметры системы не могут принимать произвольное значение. Для любой системы они связаны некоторым функциональным соотношением.
Если этим внутренним параметром является внутренняя энергия 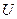
Если внутренним параметром является какая-либо обобщенная сила, то уравнение называется термическим уравнение состояния.
Общее число термических и калорического уравнений состояния системы равно числу ее степеней свободы, т.е. числу независимых параметров, характеризующих состояние системы. Если все эти уравнения состояния известны, то с помощью начал термодинамики можно определить все термодинамические свойства системы.
Вывести сами уравнения состояния на основе начал ТД нельзя. Для каждой конкретной системы они определяются эмпирически, т.е. берутся из опыта, или находятся методами статистической физики. Так что в рамках ТД они считаются заданными при определении системы.
До сих пор не существует удовлетворительной общей теории уравнений состояния, кроме случаев особых простых систем: идеального газа и совершенных кристаллов. Для жидкостей и твердых тел соотношения между параметрами состояния до сих пор получают эмпирически.
Ограничимся рассмотрением простых систем, систем с постоянным числом частиц, состояние которых определяется только одним внешним параметром и температурой.
Термическое уравнение состояния такой системы, записанное в общем виде:

Калорическое уравнение состояния, записанное в общем виде:
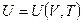
для идеального газа уравнение состояния (термическое) — это уравнение
Менделеева-Клапейрона 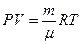
для модели реального газа уравнение состояния — это уравнение Ван-дер-Ваальса
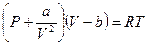
Если известны два параметра, то третий находится из уравнения состояния

Например: 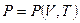
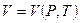
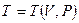
Уравнение состояния изображается в условном пространстве 
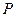
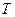
Калорическое и термическое уравнения состояния системы
Уравнение (П.4.1) является универсальным, и, в этой связи, применимым для всех типов макроскопических систем. Однако, даже для простейшего случая термодинамической системы (идеальный газ)
   , , | (П.4.2) |
это уравнение является неразрешимым, поскольку содержит пять переменных 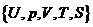
Для изыскания этих соотношений следует обратить внимание на тот факт, что равновесные внутренние параметры системы являются функциями внешних параметров и температуры системы, что приводит к существованию термических и калорических уравнений состояния системы. Эти дополнительные уравнения должны связывать температуру T и внешние параметры ai с каким либо внутренним параметром bk термодинамической системы:
   | (П.4.3) |
Если в качестве внутреннего параметра bk выступает непосредственно внутренняя энергия системы U (т.е.: bk = U), то получается калорическое уравнение состояния системы:
  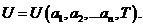 | (П.4.4) |
Своим названием калорическое уравнение состояния обязано тому обстоятельству, что с его помощью можно находить теплофизические характеристики материалов, например, теплоемкость веществ.
Если же внутренним параметром bk является сопряженная внешнему параметру ai обобщенная сила Ai (т.е. bk = Ai), то получается термическое уравнение состояния системы:
   где: i = 1, 2,…n. где: i = 1, 2,…n. | (П.4.5) |
Своим названием термическое уравнение состояния обязано тому обстоятельству, что с его помощью можно находить температуру системы.
Общее число термических и калорических уравнений состояния системы равно числу ее степеней свободы, т.е. числу независимых параметров однозначно характеризующих состояние системы. Согласно постулатам равновесной термодинамики калорическое и каждое из термических уравнений состояния системы не являются независимыми (связаны дифференциальным уравнением в частных производных).
Если калорическое и все термические уравнения состояния системы известны, то далее, с помощью теоретического аппарата термодинамики, можно определить все термодинамические свойства системы. Важно отметить, что вывести (теоретическим путем) упомянутые выше уравнения состояния системы с помощью методов термодинамики не представляется возможным. Эти уравнения устанавливаются либо опытным путем, либо – с помощью теоретического аппарата статистической физики.
Методологические принципы практического использования калорического и термических уравнений состояния удобно проиллюстрировать на примере анализа простейшей термодинамической системы – «идеальный газ», для которой эти уравнения имеют соответственно вид (обратить внимание на то, что система имеет две степени свободы):
 (термическое уравнение). (термическое уравнение). | (П.4.6.а) |
 (калорическое уравнение). (калорическое уравнение). | (П.4.6.б) |
Если принять в качестве обобщенной силы 
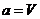
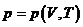 (термическое уравнение). (термическое уравнение). | (П.4.7.а) |
 (калорическое уравнение). (калорическое уравнение). | (П.4.7.б) |
Для идеального газа термическим уравнением состояния является известное уравнение Клайперона-Менделеева (определено эмпирическим путем!):
 (термическое уравнение). (термическое уравнение). | (П.4.8) |
Обратить внимание на то обстоятельство, что наличие выражения (П.4.8) уменьшает число степеней свободы термодинамической системы на единицу.
Используя закон Джоуля о независимости внутренней энергии идеального газа от его объема при постоянной температуре (т.е. исключается из рассмотрения потенциальная энергия взаимодействия атомов газа между собой: 
 , , | (П.4.9) |
где 
Согласно опытным данным, теплоемкость 
 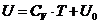 , , | (П.4.10) |
где 
Рассмотренный случай («идеальный газ») является самым простым в практике анализа термодинамических систем. Уже для случая «реальных газов» (не говоря уж о конденсированных средах) трудности нахождения уравнений состояния системы неизмеримо возрастают. Именно это обстоятельство является сдерживающим фактором на пути широкого использования (внедрения) теоретических подходов равновесной термодинамики в производственно-техническую практику, связанную с созданием устройств электронной техники.
Не нашли, что искали? Воспользуйтесь поиском:
Термодинамические параметры состояния
Тема: Основные параметры состояния.
Термические и калорические параметры состояния
К термическим параметрам состояния относятся давление P, удельный объем v,температура Т.
К калорическим параметрам состояния относятся следующие основные термодинамические величины: энтропия S,внутренняя энергия U и энтальпия H = U + PV
Термодинамические параметры состояния
Свойства каждой системы характеризуются рядом величин, которые принято называть термодинамическими параметрами. Рассмотрим некоторые из них, используя при этом известные из курса физики молекулярно-кинетические представления об идеальном газе как о совокупности молекул, которые имеют исчезающе малые размеры, находятся в беспорядочном тепловом движении и взаимодействуют друг с другом лишь при соударениях.
Давление — физическая величина, численно равная отношению нормальной составляющей силы к площади, на которую действует эта сила.
Единицей давления в СИ является Паскаль — давление, вызываемое силой в 1 Н, равномерно распределенной по поверхности площадью 1 м 2 (1Па=1 Н/м 2 ).
В табл. 1.1 приведены соотношения между ранее применявшимися единицами измерения давления и единицами давления в СИ.
| Таблица 1.1 | |||||
| Единица | Па | бар | кгс/см 2 | мм рт.ст. | мм вод.ст. |
| 1 Па | 10 -5 | 1,02·10 -5 | 7,5024·10 -3 | 1,02·10 -1 | |
| 1 бар | 10 5 | 1,02 | 7,5024·10 2 | 1,02·10 4 | |
| 1 кгс/см2 | 9,8067·10 4 | 0,98067 | 10 4 | ||
| 1 мм рт.ст. | 1,33·10 -3 | 1,36·10 -3 | 13,6 | ||
| 1 мм вод.ст. | 9,8067 | 9,8067·10 -5 | 10 -4 | 7,35·10 -2 |
Различают атмосферное, или барометрическое давление Pб, абсолютное давление Ра, манометрическое Рм, или избыточное Ризб давление, разрежение, или вакуум.
Давление, создаваемое атмосферным воздухом, называется барометрическим, или атмосферным.
Абсолютным давлением, называется давление отсчитываемое от нуля (абсолютного вакуума).
Избыточным, или манометрическим, давлением называется давление сверх атмосферного, то есть избыточное давление — это разность между абсолютным и барометрическим давлениями: Pизб = Pa — Pб.
Разрежением, или вакуумом, называется разность между атмосферным давлением и абсолютным давлением той среды, где измеряется давление. Если абсолютное давление газа или пара в сосуде ниже барометрического, то есть Pа
Вакуум показывает, насколько давление газа (пара) меньше давления окружающей среды. Давление атмосферного воздуха измеряется барометрами, избыточное давление — манометрами, а давление разрежения — вакуумметрами.
В термодинамических уравнениях всегда используют значения абсолютного давления ввиду того, что оно является параметром, характеризующим состояние термодинамической системы.
Атмосферное давление — величина переменная, поэтому в технике применяется нормальное атмосферное давление, Рб =0,10132 МПа (760 мм рт. ст.).
Давление обусловлено взаимодействием молекул рабочего тела с поверхностью и численно равно силе, действующей на единицу площади поверхности тела по нормали к последней. В соответствии с молекулярно-кинетической теорией давление газа определяется соотношением

где n — число молекул в единице объема;
т — масса молекулы; с 2 — средняя квадратическая скорость поступательного движения молекул.
В Международной системе единиц (СИ) давление выражается в паскалях (1 Па=1 Н/м 2 ). Поскольку эта единица мала, удобнее использовать 1 кПа = 1000 Па и 1 МПа=10 6 Па.
Давление измеряется при помощи манометров, барометров и вакуумметров.



Приборы для измерения давлений ниже атмосферного называются вакуумметрами; их показания дают значение разрежения (или вакуума):

Следует отметить, что параметром состояния является абсолютное давление. Именно оно входит в термодинамические уравнения.
Температура тела есть мера его нагретости. Температура определяет направление передачи теплоты. Если два тела А и В имеют соответственно температуру Т1 и Т2 и Т1>Т2, то теплота переходит от тела А к телу В. При этом температура тела А уменьшается, а тела В — увеличивается.
С точки зрения молекулярно-кинетической теории температура есть мера интенсивности теплового движения молекул.
В термодинамике рассматривают температуру как среднестатистическую величину, которая характеризует систему, состоящую из очень большого числа молекул (частиц), находящихся в хаотическом (тепловом) движении. Поэтому к единичным молекулам понятие температуры не применимо. При температуре абсолютного нуля тепловое движение молекул отсутствует. Эта предельная минимальная температура называется абсолютным нулем и является началом для отсчета температур. Понятно, что не может быть Т
По шкале Цельсия ( 
В 1724 г. Фаренгейт предложил термометр, в качестве реперных точек которого приняты: +212°F — температура кипения воды при нормальном атмосферном давлении; +32°F — температура таяния льда. Разность температур кипения воды и таяния льда по шкале Фаренгейта равна 212°— 32° = 180 °F, а по шкале Цельсия — 100°C. Следовательно, 1°F соответствует 5/9 °C, а 1°C — 1,8°F.
Шкала Реомюра ( 
Шкала Ранкина ( 

Решением Международного комитета мер и весов приняты две шкалы: термодинамическая температурная шкала, которая принята основной, и Международная практическая температурная шкала (МПТШ-68), выбранная таким образом, чтобы температура, измеренная по этой шкале, была близка к термодинамической. В основу построения термодинамической шкалы положен тот факт, что в циклах Карно, располагающихся между двумя адиабатами, разность температур изотерм считается постоянной, если в механическую работу превращаются одинаковые количества теплоты. Наиболее универсальной шкалой температур является абсолютная термодинамическая шкала температур — шкала Кельвина.
В шкале Кельвина используется единственная экспериментальная реперная точка — тройная точка химически чистой воды (в термодинамическом равновесии находятся три агрегатных состояния; лед, жидкая вода и пар). Этому состоянию соответствует температура 273,15К (0,01°С). Второй постоянной точкой является абсолютный нуль температур (0К). Кельвин — единица измерения температуры по термодинамической температурной шкале, равная 1/273,15 части интервала от абсолютного нуля температуры до температуры тройной точки воды.
Практическим осуществлением термодинамической шкалы температур является Международная практическая температурная шкала. В этой шкале используется одиннадцать реперных точек. В табл. 1.2 приведены значения основных реперных точек.
| Таблица 1.2 | ||
| Равновесное состояние | МПШТ-68 | |
| T68 | t68 | |
| Точка кипения кислорода | 90,188 К | -182,962 0 C |
| Тройная точка воды | 273,16 К | +0,01 0 C |
| Точка кипения воды | 373,15 К | +100,0 0 C |
| Точка плавления цинка | 692,73 К | +419,58 0 C |
| Точка плавления серебра | 1235,08 К | +961,93 0 C |
| Точка плавления золота | 1337,58 К | +1064,43 0 C |
| Температуры кипения и плавления даны при давлении 101325 Па |
Температурой называется физическая величина, характеризующая степень нагретости тела. Понятие о температуре вытекает из следующего утверждения: если две системы находятся в тепловом контакте, то в случае неравенства их температур они будут обмениваться теплотой друг с другом, если же их температуры равны, то теплообмена не будет.
С точки зрения молекулярно-кинетических представлений температура есть мера интенсивности теплового движения молекул. Ее численное значение связано с величиной средней кинетической энергии молекул вещества:

где k — постоянная Больцмана, равная 1,380662•10ˉ 23 Дж/К. Температура T, определенная таким образом, называется абсолютной.
В системе СИ единицей температуры является кельвин (К); на практике широко применяется градус Цельсия (°С). Соотношение между абсолютной Т и стоградусной I температурами имеет вид

В промышленных и лабораторных условиях температуру измеряют с помощью жидкостных термометров, пирометров, термопар и других приборов.
Удельный объем вещества ν — это объем, занимаемый единицей массы данного вещества.
Плотность вещества ρ— величина, обратная удельному объему и определяющая количество вещества, заключенное в единице объема.
Единица плотности в СИ — кг/м 3 , в системе СГС — г/см 3 . Плотность и удельный объем зависят от температуры и давления, то есть от термодинамического состояния вещества. Обычно в справочниках приводятся их значения при нормальных физических условиях. За нормальные физические условия принимают давление, равное 101,325 кПа (760 мм рт. ст.), и температуру, равную 0 °С.
Количество вещества. Единицей количества вещества в СИ является моль. Кроме моля применяют кратные и дольные части от моля (кмоль, Ммоль и др.). Количество вещества — это физическая величина, определяемая числом структурных элементов (атомов, молекул, ионов, электронов). Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг.
Молярной массой вещества называют отношение массы вещества к его количеству:
 |
где μ — молярная масса. Если 

Удельный объем v — это объем единицы массы вещества. Если однородное тело массой М занимает объем v, то по определению
В системе СИ единица удельного объема 1 м 3 /кг. Между удельным объемом вещества и его плотность существует очевидное соотношение:
Для сравнения величин, характеризующих системы в одинаковых состояниях, вводится понятие «нормальные физические условия»:
p=760 мм рт.ст.= 101,325 кПа; T=273,15 K.
В разных отраслях техники и разных странах вводят свои, несколько отличные от приведенных «нормальные условия», например, «технические» ( p= 735,6 мм рт.ст.= 98 кПа , t=15˚C) или нормальные условия для оценки производительности компрессоров (p=101,325 кПа, t=20˚С ) и т. д.
Если все термодинамические параметры постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным.
Если между различными точками в системе существуют разности температур, давлений и других параметров, то она является неравновесной. В такой системе под действием градиентов параметров возникают потоки теплоты, вещества и другие, стремящиеся вернуть ее в состояние равновесия. Опыт показывает, что изолированная система с течением времени всегда приходит в состояние равновесия и никогда самопроизвольно выйти из него не может. В классической термодинамике рассматриваются только равновесные системы.
Уравнение состояния
Для равновесной термодинамической системы существует функциональная связь между параметрами состояния, которая называется уравнением состояния. Опыт показывает, что удельный объем, температура и давление простейших систем, которыми являются газы, пары или жидкости, связаны термическим уравнением состояния вида 
Уравнению состояния можно придать другую форму: 
Эти уравнения показывают, что из трех основных параметров, определяющих состояние системы, независимыми являются два любых.
Для решения задач методами термодинамики совершенно необходимо знать уравнение состояния. Однако оно не может быть получено в рамках термодинамики и должно быть найдено либо экспериментально, либо методами статистической физики. Конкретный вид уравнения состояния зависит от индивидуальных свойств вещества.
Уравнение состояния идеальных газов
Из уравнений (1.1) и (1.2) следует, что 
Рассмотрим 1 кг газа. Учитывая, что в нем содержится N молекул и, следовательно, 
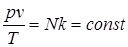
Постоянную величину Nk, отнесенную к 1 кг газа, обозначают буквой R и называют газовой постоянной. Поэтому


Полученное соотношение представляет собой уравнение Клапейрона.
Умножив (1.3) на М, получим уравнение состояния для произвольной массы газа М:

Уравнению Клапейрона можно придать универсальную форму, если отнести газовую постоянную к 1 кмолю газа, т. е. к количеству газа, масса которого в килограммах численно равна молекулярной массе μ. Положив в (1.4) М=μ и V=V μ, получим для одного моля уравнение Клапейрона — Менделеева:
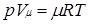
Здесь 

В соответствии с законом Авогадро (1811г.) объем 1 кмоля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22,4136 м 3 , поэтому
Газовая постоянная 1 кг газа составляет 
Уравнение состояния реальных газов
В реальных газах вотличие от идеальных существенны силы межмолекулярных взаимодействий (силы притяжения, когда молекулы находятся на значительном расстоянии, и силы отталкивания при достаточном сближении их друг с другом) и нельзя пренебречь собственным объемом молекул.
Наличие межмолекулярных сил отталкивания приводит к тому, что молекулы могут сближаться между собой только до некоторого минимального расстояния. Поэтому можно считать, что свободный для движения молекул объем будет равен 
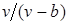

Силы притяжения действуют в том же направлении, что и внешнее давление, и приводят к возникновению молекулярного (или внутреннего) давления. Сила молекулярного притяжения каких-либо двух малых частей газа пропорциональна произведению числа молекул в каждой из этих частей, т. е. квадрату плотности, поэтому молекулярное давление обратно пропорционально квадрату удельного объема газа: рмол = а/v 2 , где а — коэффициент пропорциональности, зависящий от природы газа.
Отсюда получаем уравнение Ван-дер-Ваальса (1873 г.):
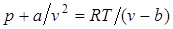



При больших удельных объемах и сравнительно невысоких давлениях реального газа уравнение Ван-дер-Ваальса практически вырождается в уравнение состояния идеального газа Клапейрона, ибо величина a/v 2
(по сравнению с p) и b (по сравнению с v) становятся пренебрежимо малыми.
Уравнение Ван-дер-Ваальса с качественной стороны достаточно хорошо описывает свойства реального газа, но результаты численных расчетов не всегда согласуются с экспериментальными данными. В ряде случаев эти отклонения объясняются склонностью молекул реального газа к ассоциации в отдельные группы, состоящие из двух, трех и более молекул. Ассоциация происходит вследствие несимметричности внешнего электрического поля молекул. Образовавшиеся комплексы ведут себя как самостоятельные нестабильные частицы. При столкновениях они распадаются, затем вновь объединяются уже с другими молекулами и т. д. По мере повышения температуры концентрация комплексов с большим числом молекул быстро уменьшается, а доля одиночных молекул растет. Большую склонность к ассоциации проявляют полярные молекулы водяного пара.
Термодинамический процесс
Изменение состояния термодинамической системы во времени называется термодинамическим процессом. Так, при перемещении поршня в цилиндре объём, а с ним давление и температура находящегося внутри газа будут изменяться, будет совершаться процесс расширения или сжатия газа.
Как уже отмечалось, система, выведенная из состояния равновесия, и предоставленная при постоянных параметрах окружающей среды самой себе, через некоторое время вновь придет в равновесное состояние, соответствующее этим параметрам. Такое самопроизвольное (без внешнего воздействия) возвращение системы в состояние равновесия
называется релаксацией, а промежуток времени, в течение которого система возвращается в состояние равновесия, называется временем релаксации. Для разных процессов он различно: если для установления равновесного давления в газе требуется всегда, то для выравнивания температуры в объеме того же газа нужны десяти; минут, а в объеме нагреваемого твердой тела — иногда несколько часов.
Термодинамический процесс называется равновесным, если все параметры системы при его протекании меняются достаточно медленно по сравнению с соответствующим процессом релаксации. В этом случае система фактически все время находится в состоянии равновесия с окружающей средой, чем и определяется название процесса.
Чтобы процесс был равновесным, скорость изменения параметров системы 
где А — параметр, наиболее быстро изменяющийся в рассматриваемом процессе; срел — скорость изменения этого параметра в релаксационном процессе; τрел — время релаксации.
Рассмотрим, например, процесс сжатия газа в цилиндре. Если время смещения поршня от одного положения до другого существенно превышает время релаксации, то в процессе перемещения поршня давление и температура успеют выровняться по всему объему цилиндра.
Это выравнивание обеспечивается непрерывным столкновением молекул, в результате чего подводимая от поршня к газу энергия достаточно быстро и равномерно распределяется между ними. Если последующие смещения поршня будут происходить аналогичным образом, то состояние системы в каждый момент времени будет практически равновесным. Таким образом, равновесный процесс состоит из непрерывного ряда последовательных состояний равновесия, поэтому в каждой его точке состояние термодинамической системы можно описать уравнением состояния данного рабочего тела. Именно поэтому классическая термодинамика в своих исследованиях оперирует только равновесными процессами. Они являются удобной идеализацией реальных процессов, позволяющей во многих случаях существенно упростить решение задачи. Такая идеализация вполне обоснована, так как условие (1.8) выполняется на практике достаточно часто. Поскольку механические возмущения распространяются в газах со скоростью звука, процесс сжатия газа и цилиндре будет равновесным, если скорость перемещения поршня много меньше скорости звука.
Процессы, не удовлетворяющие условию 
Законы идеальных газов
Закон Бойля-Мариота
Бойль в 1662 году и Мариот в 1676 году обнаружили, что при 

Закон Гей-Люссака
Гей-Люссак в 1802 году опытным путём установил, что при 
Закон Авогадро
В 1811 году Авогадро выдвинул гипотезу: одинаковые объёмы различных газов при одинаковых физических условиях содержат одинаковые количества молекул. Эта гипотеза, став после её доказательства законом, приводит к одному важному следствию, согласно которому при одинаковых физических условиях для любых газов произведение молекулярной массы газа на его удельный объём есть величина постоянная, т. е. 
Напомним, что молекулярной массой называется количество вещества в граммах, численно равное его молекулярной массе. Например, молекулярная масса углерода равна 12 граммам, а кислорода — 32 граммам.
Произведение 
Отметим, что нормальным физическим условиям соответствуют 760 мм рт. ст. и 0 0 С, а нормальным техническим условиям — 735 мм рт. ст. и 10 0 С.
Уравнение состояния
Сопоставление законов Бойля-Мариота и Гей-Люссака приводят к обобщённому закону Бойля-Гей-Люссака:
 , , |
где R— характеристическая постоянная идеального газа (при нормальных физических условиях 


Это уравнение, полученное Клапейроном в 1834 году, называется уравнением состояния идеальных газов или уравнением Клапейрона.
http://vikidalka.ru/1-145289.html
http://lektsii.org/16-78807.html





