Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Карбонат аммония
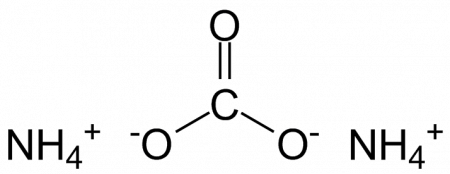
Карбонат аммония, углекислый аммоний, (NH4)2CO3 — аммониевая соль угольной кислоты. СодержаниеСвойстваБесцветные кристаллы соединения хорошо растворимы в воде. Карбонат аммония очень неустойчив как на воздухе, так и в растворе, так как уже при комнатной температуре выделяет аммиак, превращаясь в гидрокарбонат аммония NH4HCO3 . При температуре 60 °C быстро распадается на NH3 , CO2 и H2O . (NH4)2CO3 + H2O ⇄ NH4HCO3 + NH4OH ПрименениеНа процессе разложения, связанном с выделением газов, основано применение карбоната аммония вместо дрожжей в хлебопечении и кондитерской промышленности (пищевая добавка E503). Получают карбонат аммония взаимодействием газообразных NH3 , CO2 и H2O при быстром охлаждении продуктов реакции. Технический продукт содержит наряду с (NH4)2CO3 соединение гидрокарбоната аммония с карбаминатом аммония NH4HCO3 ⋅ NH4COONH2 . Карбонат аммония применяется для получения сульфата аммония из гипса по реакции При этом карбонат аммония можно вводить в виде раствора (жидкостный процесс конверсии), вместо карбоната аммония можно вводить газообразные NH3 и CO2 (газовый процесс конверсии), а также можно вводить газообразные NH3 и CO2 дополнительно к раствору (NH 4)2CO3 в количестве 10—15 % стехиометрического количества в расчёте на CaSO4 (газожидкостный процесс конверсии). В последнем случае при растворении газов выделяется дополнительная теплота, необходимая для протекания реакции. Карбонат аммония может рассматриваться как источник карбонат-ионов и в перспективе может применяться, например, для осаждения солей магния для отделения его от солей калия. При добыче калия из морской воды соли калия выделяются вместе с солями магния и не могут быть очищены от него перекристаллизацией. При добавлении карбоната аммония магний выпадает в осадок в виде карбоната, в растворе остаются в основном хлорид калия и хлорид аммония, которые впоследствии могут быть разделены (рекристаллизацией или возгонкой), либо не разделяться, а использоваться как азотно-калийное удобрение. Также карбонат аммония применяется:
Карбонат аммония: свойства, структура, применение и рискиКарбонат аммония: свойства, структура, применение и риски — Наука Содержание:В карбонат аммония представляет собой неорганическую азотную соль, в частности аммиачную, химическая формула которой (NH4)2CO3. Изготовлен синтетическими методами, среди которых выделяется использование сублимации смеси сульфата аммония и карбоната кальция: (NH4)2ЮЗ4(s) + CaCO3(s) => (NH4)2CO3(s) + CaSO4(s). Обычно соли карбоната аммония и кальция нагревают в сосуде для получения карбоната аммония. Промышленный метод получения тонны этой соли состоит в пропускании диоксида углерода через абсорбционную колонну, содержащую раствор аммиака в воде, с последующей дистилляцией. Пары, содержащие аммоний, диоксид углерода и воду, конденсируются с образованием кристаллов карбоната аммония: 2NH3(г) + H2О (л) + СО2(г) → (NH4)2CO3(s). Угольная кислота, H2CO3, после того, как углекислый газ растворяется в воде, и именно эта кислота отдает свои два протона, H + , до двух молекул аммиака. Физические и химические свойстваЭто белое, кристаллическое и бесцветное твердое вещество с сильным запахом аммиака и привкусом. Он плавится при 58ºC, разлагаясь на аммиак, воду и углекислый газ: в точности предыдущее химическое уравнение, но в противоположном направлении. Однако это разложение происходит в два этапа: сначала выделяется молекула NH.3, производя бикарбонат аммония (NH4HCO3); и, во-вторых, если нагревание продолжается, карбонат становится непропорциональным, выделяя еще больше газообразного аммиака. Это твердое вещество, хорошо растворимое в воде и менее растворимое в спиртах. Он образует водородные связи с водой, и когда 5 граммов растворяется в 100 граммах воды, образуется щелочной раствор с pH около 8,6. Его высокое сродство к воде делает его гигроскопичным твердым веществом (впитывает влагу), поэтому его трудно найти в безводной форме. Фактически, его моногидратная форма (NH4)2CO3ЧАС2O), является наиболее распространенным из всех и объясняет, как соль переносит газообразный аммиак, вызывающий запах. На воздухе он разлагается с образованием бикарбоната аммония и карбоната аммония (NH4NH2CO2). Химическая структураНа верхнем изображении показана химическая структура карбоната аммония. В середине — анион CO3 2– , плоский треугольник с черным центром и красными сферами; а с двух сторон катионы аммония NH4 + с четырехгранной геометрией. Геометрия иона аммония объясняется sp-гибридизацией. 3 атома азота, расположив атомы водорода (белые сферы) вокруг него в форме тетраэдра. Между тремя ионами взаимодействия устанавливаются водородными связями (H3N-H- O-CO2 2– ). Благодаря своей геометрии одиночный анион CO3 2– может образовывать до трех водородных связей; катионы NH4 + они могут быть не в состоянии образовать соответствующие четыре водородные связи из-за электростатического отталкивания между их положительными зарядами. Результатом всех этих взаимодействий является кристаллизация орторомбической системы. Почему он такой гигроскопичный и растворимый в воде? Ответ находится в том же абзаце выше: водородные связи. Эти взаимодействия ответственны за быстрое поглощение воды из безводной соли с образованием (NH4)2CO3ЧАС2ИЛИ). Это приводит к изменению пространственного расположения ионов и, следовательно, кристаллической структуры. Структурные курьезыТак же просто, как (NH4)2CO3, он настолько чувствителен к бесконечности преобразований, что его структура остается загадкой для истинного состава твердого тела. Эта структура также меняется в зависимости от давления, которое влияет на кристаллы. Некоторые авторы обнаружили, что ионы расположены в виде компланарных цепочек с водородными связями (то есть цепочки с последовательностью NH4 + -CO3 2– -…), в которых, вероятно, молекулы воды служат связующими звеньями с другими цепями. Кроме того, что касается этих кристаллов, выходящих за пределы земного неба, в космосе или в межзвездных условиях? Каков их состав с точки зрения устойчивости карбонатных разновидностей? Существуют исследования, подтверждающие большую стабильность этих кристаллов, захваченных планетными ледяными массами и кометами. Это позволяет им действовать как запасы углерода, азота и водорода, которые, получая солнечное излучение, могут быть преобразованы в органический материал, такой как аминокислоты. Другими словами, эти замороженные аммиачные блоки могут быть носителями «колеса, запускающего механизмы жизни» в космосе. По этим причинам его интерес к области астробиологии и биохимии растет. ПриложенияОн используется как разрыхлитель, так как при нагревании выделяет углекислый газ и газы аммония. Карбонат аммония, если хотите, является предшественником современных разрыхлителей и может использоваться для выпечки печенья и лепешек. Однако не рекомендуется для выпечки тортов. Из-за толщины лепешек газы аммония задерживаются внутри и имеют неприятный вкус. Он используется как отхаркивающее средство, то есть облегчает кашель, снимая отек бронхов. Обладает фунгицидным действием, поэтому используется в сельском хозяйстве. Он также является регулятором кислотности, присутствующей в пище, и используется в органическом синтезе мочевины в условиях высокого давления и гидантоинов. РискиКарбонат аммония очень токсичен. При контакте вызывает у человека острое раздражение ротовой полости. Также при проглатывании вызывает раздражение желудка. Аналогичное действие наблюдается в глазах, подвергшихся воздействию карбоната аммония. Вдыхание газов, образующихся при разложении соли, может вызвать раздражение носа, горла и легких, вызывая кашель и респираторную недостаточность. Острое воздействие карбоната аммония на голодных собак в дозе 40 мг / кг массы тела вызывает рвоту и диарею. Более высокие дозы карбоната аммония (200 мг / кг массы тела) часто приводят к летальному исходу. Причиной смерти указывается повреждение сердца. При нагревании до очень высоких температур в воздухе, обогащенном кислородом, он выделяет токсичные газы NO.2. Ссылки
Значение символа медицины Карбокация: образование, характеристики, типы, стабильность источники: http://chem.ru/karbonat-ammonija.html http://ru1.warbletoncouncil.org/carbonato-amonio-16225 | |||||||||||||||||||||||||||||||||||||