Напишите плис уравнение диссоциации карбоната кальция?
Химия | 10 — 11 классы
Напишите плис уравнение диссоциации карбоната кальция.
Напишите плис уравнение диссоциации карбоната кальция : не диссоциирует, осадок.
Не диссоциирует, т.
К. выпадает в осадок.
CaCl2 + K2CO3 = CaCO3(выпадает в осадок) + 2KCl
Ca(заряд иона 2 + ) + 2Cl(заряд иона — ) + 2K(заряд иона + ) + CO3(заряд иона2 — ) = CaCO3 + 2K(заряд иона + ) + 2Cl(заряд иона — )
Ca(зарядиона2 + ) + CO3(заряд иона2 — ) = CaCO3.
Напишите уравнения электролитической диссоциации хлорида магния, сульфата калия, гидроксида кальция, нитрата алюминия, досфорной кислоты?
Напишите уравнения электролитической диссоциации хлорида магния, сульфата калия, гидроксида кальция, нитрата алюминия, досфорной кислоты.
Напииши уравнение реакции диссоциации следующих электролитов а) азотной и серной кислот ; б)гидроксидов калия и кальция ; в) солей хлорида магния, карбоната натрия и нитратов алюмия?
Напииши уравнение реакции диссоциации следующих электролитов а) азотной и серной кислот ; б)гидроксидов калия и кальция ; в) солей хлорида магния, карбоната натрия и нитратов алюмия.
Напишите ионное уравнение , пожалуиста?
Напишите ионное уравнение , пожалуиста!
В)карбонат кальция и соляная кислота.
ХИМИЯ ?
Зубные пасты часто содержат карбонат кальция, но не природный.
Предложите химический способ получения карбоната кальция, напишите уравнение реакции.
Напишите уравнения реакций и поставьте коэффициенты карбонат натрия + сульфат кальция?
Напишите уравнения реакций и поставьте коэффициенты карбонат натрия + сульфат кальция.
ПОМОГИТЕ, МНЕ ОЧЕНЬ НААААДООООнапишите уравнения реакции, с помощью которых можно осуществить превращения : карбонат кальция — оксид кальция — карбид кальция — ацетилен — бензол — нитробензол?
ПОМОГИТЕ, МНЕ ОЧЕНЬ НААААДОООО
напишите уравнения реакции, с помощью которых можно осуществить превращения : карбонат кальция — оксид кальция — карбид кальция — ацетилен — бензол — нитробензол.
Здравствуйте, напишите, пожалуйста, молекулярное и ионное уравнения : азотная кислота(HNO) + карбонат кальция (Ca)?
Здравствуйте, напишите, пожалуйста, молекулярное и ионное уравнения : азотная кислота(HNO) + карбонат кальция (Ca).
Решити плис ионное уравнение карбоната бария + серная кислота?
Решити плис ионное уравнение карбоната бария + серная кислота.
Из приведённого перечня веществ выпишите электролиты напишите уравнение их диссоциации : хлорида калия , сульфат железа (2), гидроксид натрия , карбонат кальция , азотной кислота , гидросульфат калия ?
Из приведённого перечня веществ выпишите электролиты напишите уравнение их диссоциации : хлорида калия , сульфат железа (2), гидроксид натрия , карбонат кальция , азотной кислота , гидросульфат калия .
Напишите уравнения реакций взаимодействия нитрата кальция с карбонатом натрия в молекулярном и ионном виде?
Напишите уравнения реакций взаимодействия нитрата кальция с карбонатом натрия в молекулярном и ионном виде.
Перед вами страница с вопросом Напишите плис уравнение диссоциации карбоната кальция?, который относится к категории Химия. Уровень сложности соответствует учебной программе для учащихся 10 — 11 классов. Здесь вы найдете не только правильный ответ, но и сможете ознакомиться с вариантами пользователей, а также обсудить тему и выбрать подходящую версию. Если среди найденных ответов не окажется варианта, полностью раскрывающего тему, воспользуйтесь «умным поиском», который откроет все похожие ответы, или создайте собственный вопрос, нажав кнопку в верхней части страницы.
1) СH3 — CH2 — CH2 — CH = CH2(пентен — 1) 2)СH3 — CH = CH — CH2 — CH3(пентен — 2) 3)СH3 — CH2 — C = CH2(2 — метилбутен — 1) I CH3 4) СH3 — CH = C — CH3(2 — метилбутен — 2) I CH3 5)СH3 — CH — CH = CH2(3 — метилбутен — 1) I CH3 6)Во вложении(циклопента..
BaCl₂ + AgNO₃ → Ba(NO₃)₂ + AgCl↓ Pb(NO₃)₂ + K₂S →KNO₃ + PbS↓ 3Ca(NO₃)₂ + 2H₃PO₄ →6HNO₃ + Ca₃(PO₄)₂↓ Ba(NO₃)₂ + Na₂SO₄ →2NaNO₃ + BaSO₄↓ Реакция протекает до конца, если 1. Образуется осадок 2. Выделяется газ 3. Образуется H₂O Стрелками указаны осад..
Я уже сегодня решал похожее задание S + O2 = SO2Найдем кол — во в — ва серы1)n = m / Mn(S) = 8г / 32г / моль = 0. 25 моль2)Vs = Vso2, значит, теперь просто подставим все в форумулу : m = n * MmSO2 = 0. 25моль * 64г / моль = 16 гОтвет : m(SO2) = 16г..
Mr(K2MnO4) = Ar(K) * 2 + Ar(Mn) + Ar(O) * 4 = 39 * 2 + 55 + 16 * 4 = 197 Mr — относительная молекулярная масса Ar — относительная атомная масса w — массовая доля w(K) = 39 * 2 / 197 = 0. 40 = 40% w(Mn) = 55 / 197 = 0. 28 = 28% w(O2) = 64 / 197 = 0.
По ряду химических и физических свойств, специфичных исключительно для железа. Самая простая, известная всем качественная химическая реакция с высокой степенью достоверности указывающая на принадлежность металла к железу — это его ржавление. Это пр..
По ряду химических и физических свойств, специфичных исключительно для железа. Самая простая, известная всем качественная химическая реакция с высокой степенью достоверности указывающая на принадлежность металла к железу — это его ржавление. Это пр..
Третья реакция невозможна, т. К. степени окисленияAl разные, а должны быть одинаковые.
1) 4Аl + 6О2 = 2Аl2О3 2) 2Аl2О3 + 6HCl = 2AlCl3 + 3H2O 3) AlCl3 + 3NaOH = Al(OH)3 + 3NaCl 4) 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O.
Na₂CO₃ + H₂SO₄ = Na₂SO₄ + CO₂ + H₂O V(CO₂) / V₀ = m(Na₂CO₃) / M(Na₂CO₃) V(CO₂) = V₀m(Na₂CO₃) / M(Na₂CO₃) w = V'(CO₂)M(Na₂CO₃) /
Карбонат кальция: способы получения и химические свойства
Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
Способ получения
1. Карбонат кальция можно получить путем взаимодействия хлорида кальция и карбоната кальция , образуется карбонат кальция и хлорид натрия:
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Качественная реакция
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
Химические свойства
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
2. Карбонат кальция вступает в реакцию со многими сложными веществами :
2.1. Карбонат кальция реагирует с оксидами :
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
2.2. Карбонат кальция реагирует с кислотами :
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
2.2.2. Карбонат кальция реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната кальция с плавиковой кислотой приводит к образованию фторида кальция, воды и углекислого газа:
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
Термического разложения карбонатного сырья
Технологические параметры обжига карбонатного сырья определяются на основании термодинамики и кинетики диссоциации СaСО3, т. е. реакции, лежащей в основе процесса.
2.3.1. Термодинамика диссоциации СаСО3.
Процесс диссоциации карбоната кальция протекает с поглощением теплоты:
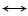
Изменение энтальпии системы DH или теплового эффекта реакции при постоянном давлении Qр в зависимости от температуры, согласно закону Кирхгофа, соответствует уравнению
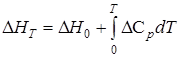
где DСр — разность теплоемкостей конечных и начальных продуктов реакции.
Изменение энтальпии системы DH, ккал/моль, при температуре T будет следующим:
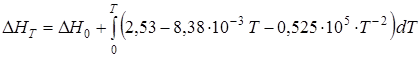
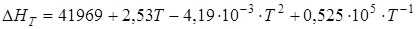
DН1173 = –39,216 (-163,9 кДж) при t = 900°С, DН1473 = –36,67
(-153,5 кДж) при t = 1200°С. В среднем тепловой эффект в зоне обжига, лежащей в диапазоне 900-1200°С, принимается равным -37,94 ккал (- 158,7кДж).
Согласно правилу фаз, в системе СаСО3 ® СаО + СО2 при трех фазах и двух компонентах в состоянии равновесия имеется только одна степень свободы.
В качестве независимого параметра обычно принимают температуру. Тогда, учитывая, что общее давление совпадает с давлением СО2, получаем:

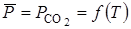
Ввиду того, что диссоциация СаСО3 является процессом эндотермическим, повышение температуры в соответствии с принципом Ле-Шателье сдвигает равновесие реакции вправо, в сторону увеличения 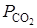
Вид функциональной зависимости 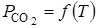
Константа равновесия равна
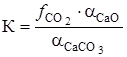
где 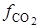
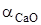
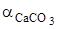
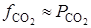
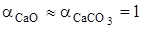
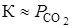
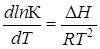
получим искомую функцию:
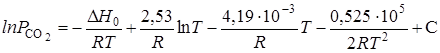
где С — константа интегрирования.
Зависимость 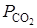
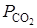
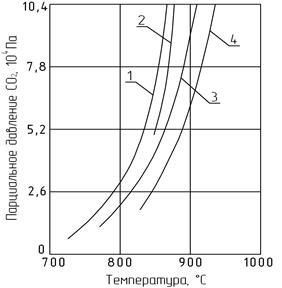
| Парциальное давление СО2, 10 5 Па | 13,0 10,4 7,8 5,2 2,6 |
 | |
| 900 1100 1300 Температура, °С |
Рис. 2.3. Зависимость парциального давления СО2 от температуры
Энергия Гельмгольца (изохорно-изотермический потенциал, «свободная энергия») твердых тел представляет собой сумму «объемной свободной энергии» 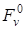
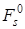
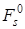
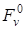
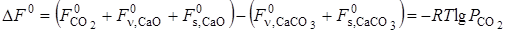
Из этого уравнения следует, что несмотря на постоянство температуры, величина 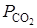
Поскольку образование новых фаз в объеме всегда проходит через стадии зарождения и первоначального роста частиц, в начальный период разложения СаСО3 в системе присутствует высокодисперсный СаО. Обладая повышенной «свободной энергией», мелкие кристаллы СаО будут стремиться к рекристаллизации (образованию крупных кристаллов за счет срастания мелких), в результате чего запас «свободной энергии» уменьшится.
Если полученный СаО крупнокристаллический, то величиной 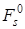
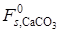
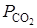
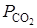
Таким образом, в зависимости от соотношения размеров кристаллов СаО и СаСО3 может получиться не одна функциональная зависимость 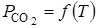
Рис. 2.4. Зависимость парциального давления СО2 над различными
по размерам кристаллами исландского шпата от температуры:
1 — 20-50 мкм; 2 — 80-140 мкм; 3 — 135-300 мкм;
4 — призма с основанием 2´5 мм, высотой 20 мм
Аналогичные данные о влиянии степени дисперсности были получены для некоторых природных карбонатов кальция, из которых следует, что температура их разложения лежит в пределах 892-921°С. Мела разлагаются при 892-895°С, известняки около 900°С, природный кальцит при 911°С, а мрамор при 921°С. Для синтетических карбонатов кальция, в том числе химически осажденных, разница в температурах диссоциации также соблюдается. Так, тонкодисперсные образцы СаСО3 разлагаются в интервале 882-895°С, а крупнокристаллические при более высокой температуре – 911-921°С.
Примеси, присутствующие в природном карбонатном сырье в том или ином количестве, оказывают влияние на величину 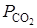
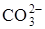
При протекании топохических процессов помимо распада аниона весьма существенную роль играет стадия разрушения кристаллической решетки.
Согласно кинетической теории процесса зарождения новой фазы, в любой системе, находящейся в состоянии теплового равновесия, в различных ее точках происходят отклонения различных параметров от наиболее вероятных значений.
Начиная с некоторой величины, называемой критической, отклонения становятся устойчивыми и не исчезают со временем, а продолжают расти, в результате чего образуются центры кристаллизации новой фазы.
Наиболее благоприятные условия для распада создаются там, где имеются наибольшие искажения решетки и связь между частицами сильно ослаблена, а запас свободной энергии достаточно высок. Такие места являются активными центрами, где начинается и осуществляется распад анионов.
По мере развития процесса распада 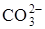
Десорбция СО2 происходит относительно легко и быстро. Большая концентрация О 2 — в поверхностном слое активных участков приводит к возникновению кристаллических зародышей. Такая фаза будет тонкодисперсной, а следовательно, она будет обладать большим запасом свободной энергии. Последнее обстоятельство делает ее метастабильной.
Чем меньше число дефектных мест у исходных кристаллов СaСО3, тем меньше число возникающих зародышей новой фазы. Следовательно, чем крупнее кристаллы у исходного СаСО3 и чем правильнее они огранены, тем медленнее совершается переход активных центров исходной фазы в крупнокристаллические зародыши СаО. Температура начала заметного разложения такого известняка на 6-7°С выше.
С момента образования кристаллических зародышей процесс развивается на границе раздела фаз СаО-СаСО3. Образующийся оксид кальция оказывает деформирующее действие на анион 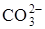
Размер конечных кристаллов СаО будет зависеть от количества образующихся зародышей в единицу времени. Если это число велико, то для роста кристаллов, как правило, не хватает «строительного материала», и поэтому кристаллы СаО будут маленькими, и наоборот.
Кроме того, помимо вышеуказанного факта на конечный размер кристаллов влияет соотношение скоростей образования зародышей и роста кристаллов. Если скорость роста кристаллов выше скорости зарождения зародышей, то продукт будет крупнокристаллическим, в противном случае картина будет обратной.
Однако наиболее действенным параметром, влияющим на размер кристаллов СаО, является температура. Так, при температуре 800°С и выдержке 10 ч размеры кристаллов составляют 0,3 мкм, при 900°С и той же выдержке они увеличиваются до 0,5-0,7 мкм, а после 10 ч прокаливания — до 6-13 мкм.
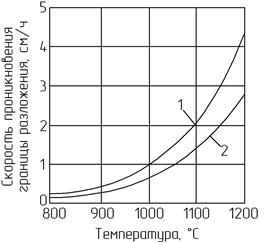
В зависимости от плотности карбонатного сырья скорость термической диссоциации будет разной (рис. 2.5).
Рис. 2.5. Зависимость средней скорости проникновения
границы разложения для мела (1) и известняка (2) от температуры
Из рисунка видно, что фронт декарбонизации у меловых гранул продвигается быстрее по сравнению с известняком.
По достижении температуры диссоциации и в ходе последующей прокалки образующиеся кристаллы СаО подвергаются спеканию, сопровождающемуся повышением предела прочности при сжатии. Так, если при 100-110°С комовый мел имеет прочность в пределах 340-650 Н/см 2 , то при 700°С эта величина достигает значения 1500 Н/см 2 .
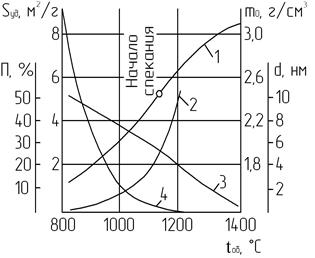
Механизм процесса спекания заключается в следующем. Малые кристаллические зерна СаО под влиянием сил молекулярного сцепления срастаются друг с другом в компактное кристаллическое тело. Образовавшееся таким образом тело еще сохраняет поликристаллическую структуру. Дальнейшее прокаливание (при более высокой температуре) вызывает рекристаллизацию — рост кристаллов. При спекании, наряду с образованием поликристаллических зерен, идет процесс «заживления» кристаллов, имеющих искажения в первичной структуре кристаллической решетки. С повышением температуры «дефектные», «несовершенные», неравновесные кристаллы превращаются в нормальные. Процесс «заживления» кристаллов сопровождается понижением активности вещества. Наличие дефектов в кристаллической решетке выявляется по пониженной плотности, повышенным теплотам гидратации, снижению резкости рефлексов на рентгенограмме и другим свойствам (рис. 2.6).
Рис. 2.6. Зависимость свойств извести от температуры обжига:
1 – объемная масса m0; 2 – размер кристаллов d;
3 – пористость П; 4 – удельная поверхность Sуд
Ход кривых на данном рисунке наглядно свидетельствует о наличии существенной зависимости свойств извести от процессов спекания. Следует отметить, бездефектный монокристалл СаО, выращенный из расплава в воде, может вообще не подвергнуться гидратации.
В заключение следует отметить, что все вышеуказанное относится к процессу термического разложения СаСО3, т. е. не содержащего примесей. Но поскольку природное карбонатное сырье всегда содержит то или иное количество порой самых разнообразных примесей, то их влияние на процесс декарбонизации в ряде случаев становится весьма значительным.
Дата добавления: 2015-06-17 ; просмотров: 3969 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://chemege.ru/karbonat-kalciya/
http://helpiks.org/3-87457.html