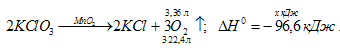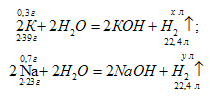Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e23797b3e1d759b • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Карбонат калия: способы получения и химические свойства
Карбонат калия K2CO3 — соль щелочного металла калия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается. Очень хорошо растворяется в воде.
Относительная молекулярная масса Mr = 138,20; относительная плотность для тв. и ж. состояния d = 2,428; tпл = 891º C;
Способ получения
1. Карбонат калия можно получить путем взаимодействия при комнатной температуре пероксида калия и влажного углекислого газа. В результате реакции образуется карбонат калия и кислород:
2. В результате взаимодействия пероксида калия и угарного газа при 50º С образуется карбонат калия и кислород:
3. При взаимодействии концентрированного гидроксида калия и углекислого газа образуется карбонат калия и вода:
4. Взаимодействуя с углеродом (графитом) при 30º С надпероксид калия карбонат калия и углекислый газ:
5. Разлагаясь при температуре 100 — 400 ºС гидрокарбонат калия образует карбонат калия, углекислый газ и воду:
6. В результате реакции между гидрокарбонатом калия и гидроксидом калия образуется карбонат калия и вода:
Качественная реакция
Качественная реакция на карбонат калия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат калия образует хлорид калия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат калия образует углекислый газ и воду, а также сульфат калия:
Химические свойства
1. Карбонат калия может реагировать с простыми веществами :
С хлором, бромом и йодом концентрированный и горячий раствор карбоната калия реагирует с образованием хлорида, бромида или йодида калия, хлората, бромата или йодата калия и углекислого газа:
2. Карбонат калия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат калия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната калия:
2.2. Карбонат калия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида калия и осадка карбоната кальция:
2.3. Карбонат калия способен реагировать с кислотами :
2.3.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат калия образует хлорид калия, углекислый газ и воду:
2.3.2. В результате реакции между насыщенным карбонатом калия и концентрированной и холодной хлорной кислотой образуется осадок хлорат калия, вода и газ углекислый газ:
2.3.3. Взаимодействуя с разбавленной фосфорной кислотой концентрированный раствор карбоната калия образует фосфат калия, воду и углекислый газ:
2.3.4. Карбонат калия взаимодействует с плавиковой кислотой . В результате реакции образуется фторид калия, вода и углекислый газ, если кислота разбавленная:
а если кислота концентрированная, то образуется гидрофторид калия, вода и углекислый газ:
2.5. Концентрированный раствор карбоната калия взаимодействует с оксидом серы . При этом образуются карбонат калия и углекислый газ:
Химические свойства карбоната натрия
Задача 978.
Написать уравнения реакций получения из карбоната натрия: а) силиката натрия; б) ацетата натрия; в) нитрата натрия; г) гидросульфата натрия; д) сульфита натрия.
Решение:
Уравнения реакций получения:
а) получение силиката натрия
б) получение ацетата натрия
в) получение нитрата натрия
г) получение гидросульфата натрия
д) получение сульфита натрия
Задача 979.
При разложении КС1О3 получили 3,36 л кислорода (условия нормальные). Какое количество теплоты при этом выделилось?
Решение:
ΔН 0 (KCl) = -439,5 кДж/моль; ΔН 0 (KClO3) = -391,2 кДж/моль
ΔН 0 х.р. = 2 (KCl) — 2 (KClO3) = 2(-439,5) – 2(-391,2) = -96,6 кДж.
Рассчитаем количество теплоты, выделившееся при реакции из пропорции:
(3 . 22,4) : -96,6 = 3,36 : х; х = 3,36(-96,6)/ (3 . 22,4) = -4,83 кДЖж.
Ответ: -4,83 кДж.
Задача 980.
Какой объем водорода, измеренного при 25 °С и давлении 755 мм рт. ст. (100,7 кПа), выделится при взаимодействии с водой 1 г сплава, состоящего из 30% (масс.) калия и 70% (масс.) натрия?
Решение:
Находим массу кальция и калия:
m(Nа) = 1 . 0,7 = 0,7 г;
m(K) = 1 . 0,3 = 0,3 г
Рассчитаем объёмы водорода, выделившегося при взаимодействии калия и натрия с водой:
V(а) (2 . 39) : 22,4 = 0,3 : х; х = (22,4 . 0,3)/ (2 . 39) = 0,086 л;
V(б) 2 . 23) : 22,4 = 0,7 : х; х = (22,4 . 0,7)/ (2 . 23) = 0,34 л;
V(Н2) = V(a) + V(б) = 0,086 + 0,34 = 0,426 л или 426 мл.
Приведем объём водорода к нормальным условиям, используя объединенный закон Гей-Люссака и Бойля — Мариотта:
где V – объём газа, измеренный при давлении р и температуре Т по Кельвину; V0 – объём, измеренный при нормальных условиях.
Произведём пересчёт объёма водорода, взятого при данных условиях, на объём при нормальных условиях:
http://chemege.ru/karbonat-kaliya/
http://buzani.ru/zadachi/khimiya-glinka/1321-karbonat-natriya-zadachi-978-980