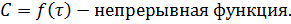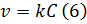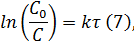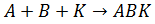Энергия активации, уравнение Аррениуса. Катализ
Принципиальную возможность протекания реакции предсказывает химическая термодинамика (при условии (DG 0 0 = –237 кДж/моль)
Данная реакция должна принципиально осуществляется при стандартных условиях, но в действительности она не протекает вследствие наличия энергетического барьера, которым является энергия активации Еа.
Энергия активации является энергетическим барьером для начала реакции, который необходимо преодолеть реагентам, чтобы превратиться в конечный продукт реакции.
Зависимость скорости реакции от энергии активации и температуры описывается уравнением Аррениуса:
В логарифмической форме: lnКv= –(Еа/RT) + lnA,
где Кn-константа скорости реакции—, А — предэкспоненциальный множитель, R – универсальная газовая постоянная, Т — температура.
Для двух температур:
где К2, К1 – константы скорости при Т2,Т1, соответственно.
Одним из наиболее распространенных в химической практике методов ускорения химических реакций (в частности достижения явления химического равновесия) является катализ. В присутствии катализаторов изменяется путь, по которому проходит суммарная реакция, а потому изменяется ее скорость.
Катализаторы — это вещества, изменяющие скорость реакции за счет участия в промежуточном химическом взаимодействии с компонентами реакции, но восстанавливающие после каждого цикла промежуточного взаимодействия свой химический состав. Увеличение скорости катализируемой реакции связано с меньшей энергией Гиббса активации нового пути реакции.
Особенностью катализаторов является отсутствие их влияния на термодинамику реакции, т.е. происходит влияние на ΔН 0 , ΔG 0 реакции. Катализаторы ускоряют наступление химического равновесия, ускоряя одновременно скорость и прямой и обратной реакции, оставляя неизменной константу равновесия (Кр). Имеются некоторые общие закономерности каталитических процессов, позволяющих предсказывать направление реакции. В настоящее время общепризнано, что катализаторы понижают полную энергию активации процесса.
Механизм катализа объясняется, исходя из теории промежуточных соединений (основатели теории П. Сабатье, и Н. Зелинский). Допустим, между веществами А и В возможно взаимодействие с образованием соединения АВ (DG
Но в силу высокой энергии Гиббса активации эта реакция протекает с очень малой, практически равной нулю скоростью. Пусть, найдено такое третье вещество К (катализатор), которое легко вступает во взаимодействие с А (в силу другой природы реагирующих веществ, а следовательно, другой, меньшей, энергии Гиббса активации), образуя соединение АК (см. рис. 14):
Соединение АК легко взаимодействует с веществом В (опять-таки в силу иной природы веществ и малой энергии активации), образуя вещества АВ и К;
В + АК ® В. АК ® АВ + К
Согласно теории, реакция разложения активированного комплекса является лимитирующей стадией, что приводит к понижению энергии активации процесса. Суммируя два последних уравнения, получим
т.е. в результате реакции катализатор остался без изменения.
На рис. 13 показана энергетическая диаграмма хода реакции в отсутствие (кривая 1) и в присутствии (кривая 2) катализатора. Очевидно, в присутствии катализатора энергия Гиббса активации реакции снижается, т.е. ΔGакт.
Следовательно, обычно применяют катализаторы с развитой поверхностью или катализаторы, нанесенные на подложки с большой площадью поверхности (пористые угли, силикаты и др.). Механизм данных реакций очень сложен и зависит от природы реакции. Такие реакции включают стадии адсорбции и десорбции.
Рисунок 13. Энергетическая схема хода реакции в отсутствие и в присутствии катализатора
Предполагают, что реакции идут не на всей поверхности катализатора, а на активных центрах, т.е. участках, на которых обеспечиваются оптимальные условия реакции. Число активных центров определяется составом поверхностного слоя, способом приготовления катализатора, обработкой его поверхности. Обычно применяют тонкоизмельченные порошки. Подбор катализаторов для тех или иных реакций – дело очень сложное, т.к. необходимы активные, стабильные, а иногда селективные катализаторы, устойчивые к каталитическим ядам. К наиболее распространенным промышленным катализаторам относятся d-металлы и их оксиды. Применение катализаторов позволяет решать многие проблемы, в том числе и экологические (очистка сточных вод и промстоков). Гетерогенно-каталитическими являются процессы синтеза аммиака (катализатор железо), окисления SО2 до SО3 (катализатор платина или оксид ванадия) и т.д.
Энергия активации. Уравнение Аррениуса. Теория активных соударений. Катализаторы и их влияние на скорость протекания реакции.
Теоретическая часть
Кинетика – это раздел химии, который занимается изучением закономерностей протекания химических реакций во времени.
Рисунок 1. Гомогенная кинетика и гетерогенная кинетика.
Кинетика имеет два подраздела: гомогенна кинетика и гетерогенная кинетика. Выше приведена схема (рис. 1), объясняющая разницу между ними.
Реакция, изучаемая в данной работе, является гомогенной и, следовательно, рассматриваться будет с точки зрения гомогенной кинетики.
В химической кинетике определяющей величиной является скорость химической реакции. Математически она определяется как отношение изменения концентрации ко времени:
где 



Скорость реакции зависит от:
1) Природы реагирующих веществ;
4) наличия катализаторов (ускоряют реакцию);
5) наличия ингибиторов (замедляют реакцию).
Также можно ввести понятие кинетического уравнение скорости:
Для реакции вида 
где 


Порядок реакции может отличаться от её молекулярности — числа молекул, участвующих в элементарном акте химического превращения.
Константа скорости k – это скорость реакции при единичных концентрациях, она зависит от:
1) Температуры T;
2) Наличия катализаторов/ингибиторов;
3) Природы участвующих в реакции веществ.
Реакции делятся на реакции первого и второго порядка.
К реакциям первого порядка относятся реакции разложения и радиоактивного распада. Общий вид реакций первого порядка:
где T – температура, V – объём.
Для реакций первого порядка можно записать кинетическое уравнение скорости:
И сопоставить его с уравнением (2):
где 
Можно определить, чему равно отношение 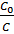
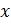
где 
Общий вид реакций второго порядка:
Для таких реакций кинетическое уравнение будет иметь вид, представленный в уравнении (3). Если концентрации исходных веществ равны, можно записать:
где 
Далее можно вывести формулу зависимости скорости реакции от количества прореагировавших веществ:
Таким образом, зная начальное количество реагирующих веществ и определив прореагировавшее количество в известный момент времени, можно определить константу скорости реакции, на чём и основана методика данного эксперимента.
Энергия активации. Уравнение Аррениуса. Теория активных соударений. Катализаторы и их влияние на скорость протекания реакции.
Как было сказано выше, константа скорости зависит от температуры, наличия катализаторов или ингибиторов и природы реагирующих веществ.
Зависимость константы скорости от температуры определяется уравнением Аррениуса, которое в дифференциальной форме имеет вид:
где 



В данной работе исследуется изменение константы скорости при наличии катализатора, а температура постоянна.
Катализаторами называют вещества, способные ускорять химическую реакцию, при этом сами катализаторы в химической реакции не расходуются. Установлено, что катализаторы изменяют механизм химической реакции. При этом возникают другие, новые переходные состояния, характеризуемые меньшей высотой энергетического барьера. Таким образом, под действием катализатора снижается энергия активации процесса (рис. 2,3).
Для того, чтобы произошла реакция, частицам необходимо преодолеть отталкивание электронных оболочек молекул и разорвать или ослабить связи между атомами. Для этого необходимо затратить определённую энергию.
Избыточная энергия (по сравнению со средней энергией при данной температуре), которой должны обладать молекулы для протекания реакции, называется энергией активации.
Молекулы, обладающие такой энергией, называются активными молекулами.
Все молекулы в веществе находятся в состоянии непрерывного хаотического движения, в результате чего происходят столкновения между молекулами и обмен энергией.
Скорость химической реакции будет зависеть от доли активных молекул.
В ходе реакции молекулы вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Именно для его образования необходима энергия активации (рис. 2, 3).
Переходное состояние системы (активированный комплекс) — называется состояние системы реагирующих веществ, соответствующее максимальной энергии на пути реакции.


Катализаторы направляют реакцию по другому пути, вследствие чего происходит изменение энергии активации.
Все реакции можно поделить на простые и сложные. Простые реакции протекают в одну стадию, а сложные – в несколько. Скорость сложной реакции определяется по самой медленной (лимитирующей) стадии.
Реакции с катализаторами – всегда сложные.
Можно записать влияние катализатора на путь протекания реакции второго порядка:
1. стадия
2. стадия
Катализатор подбирается таким образом, чтобы он образовывал с исходными веществами переходный комплекс ABK, а лимитирующей стадией для реакции второго порядка была стадия 2.
Эквивалент.
Эквивалент – реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных реакциях, одному электрону в окислительно-восстановительных реакциях или единице заряда в обменных реакциях между солями.
Эксперимент и методика.
Будет проведено две серии экспериментов, которые будут проходить в одних и тех же условиях и отличаться наличием или отсутствием катализатора (Cu2SO4) в составе реакционной смеси. Будут вычислены константы скорости для каждого случая и изменение энергии активации. В данном эксперименте будет исследоваться реакция окисления йодида натрия персульфатом натрия, протекающей в водном растворе по механизму реакции второго порядка.
Количество вещества будет определяться в моль-эквивалентах. Количество моль-эквивалентов иодида аммония и персульфата натрия будет браться одинаковым.
Это количество будет известно заранее.
Так же в раствор будет добавлен тиосульфат натрия, который будет реагировать с получающимся в ходе реакции (I) йодом с образованием иодида аммония:
Таким образом, количество участвующего в реакции (I) иодида аммония будет восстанавливаться до тех пор, пока в растворе не будет полностью израсходован запас тиосульфат натрия, количество которого будет так же определено заранее.
Этот момент можно определить, введя в раствор несколько капель крахмала. В процессе реакции (II) йод постоянно расходуется, однако, когда запас тиосульфата натрия будет израсходован, выделяющийся йод начнёт реагировать с крахмалом, придавая раствору синею окраску. Его количество в этот момент, и прореагировавшее количество одного из исходных веществ, будет равно начальной концентрации добавленного в раствор тиосульфата натрия. Этот момент будет зафиксирован на секундомере.
Таким образом, станут известны три искомые величины, необходимые для определения константы скорости: начальное количество исходных веществ, количество исходных веществ к определённому моменту времени, и само время.
По этим данным будет построен график, значение углового коэффициента которого и будет экспериментально определённым значением константы скорости исследуемой реакции.
Определённая таким образом константа скорости будет относиться только к заданной величине объёма реакционной смеси. Умножив эту константу на объём, находят константу скорости, не зависящую от объёма:
В эксперименте будут использоваться пять колб с засечками, по которым можно определить объём смешанной в них реакционной смеси, мерная колба, мерный стакан, пипетка, секундомер и сосуды с реагентами.
Используемые реагенты находятся в растворах, их нормальные концентрации нанесены на сосуды, в которых они хранятся.
Для расчёта количества эквивалентов реагентов, присутствующих в используемом объёме растворов, используются следующие формулы:
где V – объём данного реагента, измеренный мерной колбой, 
Расчёт изменения энергии активации:
Решение уравнения Аррениуса (15):
Для эксперимента важно, чтобы общий объём реакционной смеси был постоянен и составлял 150 мл.
Таблица с расчётом объёмов растворов реагентов, необходимых для проведения эксперимента приведена ниже.
Катализ энергия активации уравнение аррениуса
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
2.1 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
2.1.9 Влияние температуры на константу скорости реакции
Константа скорости реакции есть функция от температуры; повышение температуры, как правило, увеличивает константу скорости. Первая попытка учесть влияние температуры была сделана Я. Г. Вант-Гоффом, который сформулировал следующее эмпирическое правило:
При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.
Величина, показывающая, во сколько раз увеличивается константа скорости при повышении температуры на 10 градусов, есть температурный коэффициент константы скорости реакции γ . Математически правило Вант-Гоффа можно записать следующим образом:
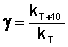
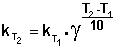
Однако правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции γ сам является функцией от температуры; при очень высоких и очень низких температурах γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры).
2.1.10 Уравнение Аррениуса
Очевидно, что взаимодействие частиц осуществляется при их столкновениях; однако число столкновений молекул очень велико и, если бы каждое столкновение приводило к химическому взаимодействию частиц, все реакции протекали бы практически мгновенно. С. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации.
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Рассмотрим путь некоторой элементарной реакции
Поскольку химическое взаимодействие частиц связано с разрывом старых химических связей и образованием новых, считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения, называемого активированным комплексом:
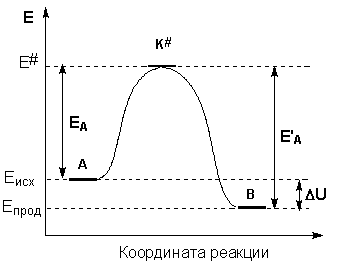
Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных ядер при сближении частиц и, во-вторых, необходимостью построения определенной пространственной конфигурации атомов в активированном комплексе и перераспределения электронной плотности. Таким образом, по пути из начального состояния в конечное система должна преодолеть своего рода энергетический барьер. Энергия активации реакции приближённо равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Очевидно, что если прямая реакция является экзотермической, то энергия активации обратной реакции Е’А выше, нежели энергия активации прямой реакции EA. Энергии активации прямой и обратной реакции связаны друг с другом через изменение внутренней энергии в ходе реакции. Вышесказанное можно проиллюстрировать с помощью энергетической диаграммы химической реакции (рис. 2.5).
Рис. 2.5 Энергетическая диаграмма химической реакции.
Eисх – средняя энергия частиц исходных веществ,
Eпрод – средняя энергия частиц продуктов реакции
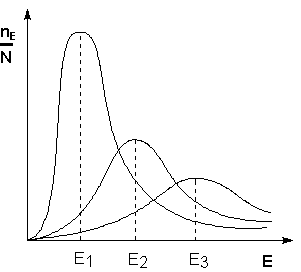
Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции (рис.2.6):
Рис. 2.6 Распределение частиц по энергии
Здесь nЕ/N – доля частиц, обладающих энергией E;
Ei — средняя энергия частиц при температуре Ti (T1 уравнения Аррениуса . Согласно уравнению изобары Вант-Гоффа,
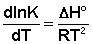
Поскольку константа равновесия есть отношение констант скоростей прямой и обратной реакции, можно переписать выражение (II.31) следующим образом:
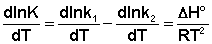
Представив изменение энтальпии реакции ΔHº в виде разности двух величин E1 и E2, получаем:
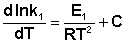
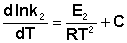
Здесь С – некоторая константа. Постулировав, что С = 0, получаем уравнение Аррениуса, где EA – энергия активации :
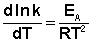
После неопределенного интегрирования выражения (II.35) получим уравнение Аррениуса в интегральной форме:
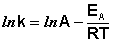
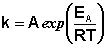
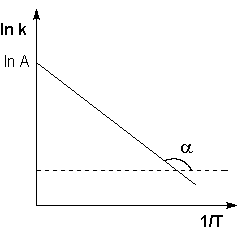
Рис. 2.7 Зависимость логарифма константы скорости химической
реакции от обратной температуры.
Здесь A – постоянная интегрирования. Из уравнения (II.37) нетрудно показать физический смысл предэкспоненциального множителя A, который равен константе скорости реакции при температуре, стремящейся к бесконечности. Как видно из выражения (II.36), логарифм константы скорости линейно зависит от обратной температуры (рис.2.7); величину энергии активации EA и логарифм предэкспоненциального множителя A можно определить графически (тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат).
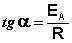
Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
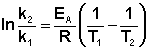
Copyright © С. И. Левченков, 1996 — 2005.
http://poisk-ru.ru/s19418t14.html
http://physchem.chimfak.sfedu.ru/Source/PCC/Kinetics_4.htm