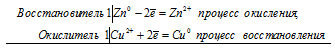Процессы коррозии различных металлов. Интенсивность коррозии
Решение задач по химии на коррозию металлов
Задание 296
Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
Решение:
Если цинковую или медную пластинки опустить в раствор сульфата меди, то в обоих случаях будет наблюдаться выпадение осадка меди. Происходит вытеснение меди цинком и железом, потому что стандартные электродные потенциалы цинка (-0,763 В) и железа (-0,44 В) значительно электроотрицательнее, чем потенциал меди (+0,34 В). Поэтому цинк и железо будут окисляться, а ионы меди Cu 2+ — восстанавливаться до металлической меди:
а) Электрохимические процессы при реакции цинка и сульфата меди
Zn 0 + Сu 2+ = Zn 2+ + Cu 0
б) Электрохимические процессы при реакции железа и сульфата меди
Fe 0 + Сu 2+ = Fe 2+ + Cu 0
Если соединить цинковую и железную пластинки, опущенные в раствор сульфата меди (II) проводником, то будет наблюдаться растворение цинковой пластинки и осаждение меди на железной пластинке. Объясняется это тем, что цинк имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому цинк будет окисляться. На железной пластинке будут восстанавливаться ионы меди, так как стандартный электродный потенциал меди имеет большее численное значение, чем потенциал железа.
Анодный процесс: Zn 0 -2 
Катодный процесс: Cu 2+ + 2 
Задание 297
Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
Решение:
Стандартные электродные потенциалы железа и цинка равны соответственно -0,44 В и -0,763 В. Потенциал, отвечающий электродному процесс:
2Н + + 2 
В нейтральной среде, равен приблизительно -0,41 В. Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислять только те металлы, потенциал которых меньше, чем -0,41 В, — это могут быть железо и цинк. Однако, эти металлы в нейтральных растворах, содержащих растворённый кислород, образуют защитную оксидную плёнку, препятствующую дальнейшему разрушению металла. Поэтому железо и цинк не могут быть окислены ионами водорода в нейтральных средах. Атмосферная коррозия – коррозия во влажном воздухе при комнатной температуре. Поверхность металла, находящегося во влажном воздухе, бывает покрыта плёнкой воды, содержащей различные газы, и в первую очередь – кислород. Скорость атмосферной коррозии зависит от рН среды. При понижении рН среды концентрация ионов водорода Н+ возрастает, что приводит к увеличению скорости коррозии металла, увеличивается восстановительный процесс на аноде:
2Н + + 2 
При повышении рН раствора уменьшается концентрация ионов водорода Н + и, соответственно, увеличивается концентрация ионов ОН-, что, согласно принципу Ле Шателье, смещает равновесие в системах: 2Н + + 2 

Электрохимические процессы, протекающие при контакте железа и цинка при контакте с водой с поглощением кислорода (атмосферная коррозия):
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Задание 298
В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Если цинковую пластинку опустить в раствор электролита, содержащего растворенный кислород, то будет наблюдаться коррозия цинка, характеризующаяся окислением его до ионов Zn 2+ :
Zn 0 -2 
Чрез некоторое время скорость реакции заметно замедляется, потому что чистый цинк окисляется кислородом, растворённым в воде, с образованием оксидной плёнки, которая, покрывая пластинку тонким слоем, пассивирует её. При этом протекает реакция:
Zn + 1/2 O2 = Zn 0
б) Если в раствор электролита опустить цинковую пластинку частично покрытую медью, процесс коррозии будет происходить значительно интенсивнее, так как образуется гальваническая пара Zn — Cu. Цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (0,34 В), поэтому цинк является анодом, а медь – катодом.
Анодный процесс: Zn 0 -2 
Катодный процесс: в кислой среде: 2Н + + 2 

В нейтральной среде или в щелочной ионы цинка Zn 2+ с гидроксид-ионами ОН- образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2. В кислой среде ионы цинка Zn 2+ с ионами кислотного остатка будут образовывать соль и при этом выделяется газообразный водород. Происходит интенсивное разрушение цинковой пластинки частично покрытой медью.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df6b47d5fc11ed2 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Особенности анодного процесса в различных электролитах цинкования
Для получения качественных цинковых покрытий необходимо соблюдение всех рекомендаций, указанных в технологических инструкциях и регламентах предприятия — от входного контроля деталей, поступающих на гальваническую обработку, до складирования готовой продукции. Естественно, что несоблюдение требований к проведению анодного процесса, который является неотъемлемой частью всей технологии, может оказать решающее влияние на качество получаемых покрытий. Как и в других гальванических технологиях, анодные процессы при цинковании деталей из различных типов электролитов имеют свои особенности, которые следует учитывать при проектировании основного технологического и вспомогательного оборудования, а также при эксплуатации электролитов.
Рассмотрим некоторые особенности анодных процессов трех наиболее распространенных в промышленности типов электролитов цинкования — цианидного, щелочного цинкатного и слабокислого, типичные составы которых приведены в табл.1. В общем случае основные требования к работе растворимых анодов, можно сформулировать следующим образом. Аноды должны:
- работать в устойчивом растворимом состоянии, без образования на поверхности солевых и других пассивирующих пленок;
- обеспечивать в период эксплуатации и простоя электролита концентрацию в нем ионов металла в оптимальном интервале;
- равномерно растворяться по поверхности, сводя к минимуму выкрашивание (шламования) металла;
- за счет геометрических размеров, конфигурации и расположения относительно покрываемых деталей способствовать наиболее равномерному по толщине распределению осаждаемого металла на поверхности деталей.
Для поддержания постоянной концентрации ионов цинка в электролите необходимо, чтобы скорость поступления в электролит ионов металла за счет растворения анодов компенсировала скорость его расхода на осаждение покрытия и на унос электролита с деталями и на технологической оснастке (подвесках, барабанах, колоколах).
| Компонент, г/л | Электролит №1 | Электролит №2 | Электролит №3 |
| Цинк хлористый | — | — | 60-100 |
| Аммоний хлористый | — | — | 200-220 |
| Борная кислота | — | — | 10-20 |
| Оксид цинка | 25-30 | 10-12 | — |
| Едкий натр | 60-90 | 100-120 | — |
| Цианистый натрий (общ.) | 30-50 | — | — |
| Температура, °С | 18-30 | 18-30 | 18-30 |
| pH | — | — | 4,5-5,5 |
| Катодная плотность тока, А/дм 2 | 0,5-3,5 | 0,5-3 | 0,5-1,5 |
Составы электролитов приведены без специальных блескообразующих и других добавок.
Особенность эксплуатации цинковых анодов связана с низкой термодинамической устойчивостью металлического цинка в коррозионно-активных средах, к которым относятся все электролиты цинкования. Вследствие этого цинк растворяется (корродирует) при погружении в электролит даже в отсутствие анодного тока. Поскольку этот процесс протекает самопроизвольно, уменьшить его скорость в условиях действующего производства практически невозможно. Скорость саморастворения цинка не зависит от величины анодной плотности тока, но зависит от рН, температуры электролита, а также от природы и концентрации веществ, входящих в состав раствора. Это свойство металлического цинка приводит к постепенному накоплению ионов цинка в растворе, что является нежелательным.
Скорость электрохимического (под воздействием тока) растворения зависит от анодной плотности тока, рН, температуры и состава электролита. Очевидно, что чем ближе величины катодного (ВТк) и анодного (ВТа) выходов по току, тем легче будет обеспечивать поддержание необходимой концентрации ионов цинка в электролите.
Наиболее простыми, с этой точки зрения, в эксплуатации являются слабокислые электролиты цинкования на основе хлористых солей калия или аммония, в которых применяются только растворимые цинковые аноды. В этих электролитах ВТа практически равен 100%, в то время как ВТк составляет 92-95%. Баланс по концентрации ионов металла достигается за счет уноса электролита и последующего добав-ления в электролит воды. На производстве не представляет больших трудностей определение необходимого соотношения катодной и анодной поверхностей для стабильной работы электролита. В этом случае электролиты в процессе эксплуатации в основном не корректируют солями цинка. Величина рН электролитов близка к нейтральной (4,5-6,0) и, несмотря на высокую концентрацию коррозионно-активных ионов хлора, скорость саморастворения цинковых анодов весьма низка.
В щелочных цианидных электролитах ВТа близок к 100%. При этом ВТк в рабочем интервале плотностей тока составляет 60-80%. В этих электролитах также происходит саморастворение цинковых анодов, хотя и не с такой высокой скоростью, которая должна была бы соответствовать высокой щелочности (рН> 13) раствора. Во многих случаях поддержание оптимальной концентрации цинка достигается за счет уноса электролита с деталями (при большой производственной программе). Тем не менее, при эксплуатации цианидных электролитов следует тщательно контролировать концентрацию ионов цинка и вынимать аноды во время простоя ванны. Прежде всего, это относится к электролитам с низкой концентрацией ионов цинка.
Наиболее заметная разница в скоростях расхода и поступления ионов цинка наблюдается в бесцианидных щелочных цинкатных электролитах. Если цинковые аноды работают в устойчивом растворимом состоянии, то ВТа практически равен 100%. Кроме того, в растворах, содержащих высокую концентрацию свободной щелочи, происходит интенсивное саморастворение цинка (анодов). Учитывая, что ВТк, как правило, составляет 50-70%, очевидно, что удержать концентрацию ионов цинка в сравнительно узком диапазоне (например, 6-10 г/л) без применения специальных технических решений, очень трудно. Поэтому, в процессе эксплуатации цинкатных электролитов в них постоянно повышается концентрация цинка. Следует отметить, что иногда в автоматических линиях с высокой производительностью при обработке сложнопрофилированных деталей на подвесках или мелких деталей насыпью в барабанах, достигается стабилизация содержания цинка за счет большого уноса раствора и последующего добавления в ванну воды.
Перечисленные выше особенности анодного поведения цинковых анодов в различных электролитах цинкования определяют специфику организации и контроля анодного процесса, а также вероятные проблемы, возникающие при эксплуатации.
Одной из наиболее часто встречающихся проблем при работе с растворимыми анодами является солевая пассивация их поверхности. При растворении анода концентрация ионов металла в слое электролита непосредственно у поверхности анода, практически всегда выше, чем в объеме электролита. Образующиеся ионы цинка (в общем случае Zn→Zn 2+ + 2e — ) должны отводиться (диффундировать) от поверхности электрода вглубь раствора. Если по какой-либо причине, в процессе электролиза реализуется завышенная анодная плотность тока, скорость образования ионов цинка может быть значительно выше скорости их диффузии от анода вглубь раствора. В том случае в прианодном слое раствора происходит повышение концентрации ионов металла и через некоторое время достигается предельная растворимость солей цинка. Некоторая часть образующихся мелкодисперсных твердые частиц соединений (солей) цинка адсорбируется на поверхности анода. В результате через некоторое время на поверхности анода образуется плотная солевая пленка, которая затрудняет ионизацию цинка, т.е. активная в начале электролиза поверхность цинкового анода переходит в пассивное (нерастворимое) состояние.
Для слабокислых электролитов такое явление встречается сравнительно редко. Это связано с тем, что растворимость хлористых или сернокислых солей цинка очень высока. Кроме того, в этих электролитах цинк, как правило, находится в виде простых (гидратированных) ионов, подвижность которых, а, следовательно, и скорость диффузии (отвода) от поверхности анода высока.
В щелочных цианидных и цинкатных электролитах возможность образования солевых пассивных пленок значительно выше. Во-первых, это связано с тем, что образующиеся ионы цинка сначала образуют растворимый устойчивый комплекс, например или и только затем, отводятся в глубь раствора. Во-вторых, растворимость комплексных солей цинка типа или значительно ниже, чем простых солей. Кроме того, подвижность больших по размеру комплексных анионов также мала. Все это и обусловливает высокую вероятность образования нерастворимых солевых пленок на поверхности цинковых анодов в этих электролитах.
Растворимость комплексных солей металла зависит не только от концентраций иона металла и комплексообразующего реагента (лиганда), но и от соотношения их концентраций в растворе. Другими словами, комплексные соли могут существовать в растворимом состоянии только при наличии определенного избытка комплексообразующего реагента.
В цианидных электролитах нормальная работа цинковых анодов зависит от концентрации OH — и в несколько меньшей степени от концентрации CN — . Поэтому, при недостаточной концентрации этих комплексообразующих компонентов на поверхности цинкового анода быстро образуется плотная солевая пленка, состоящая, в основном, из нерастворимых гидроксидных соединений цинка.
В щелочных цинкатных электролитах для нормального протекания как катодного, так и анодного процессов, соотношение концентрации ZnO/NaOH рекомендуется поддерживать в интервале от 1:8 до 1:12 (оптимально 1:10). При недостаточной концентрации щелочи часть образующихся ионов цинка в прианодном слое электролита образует нерастворимые формы гидроксидных соединений, которые образуют на поверхности анода плотную пассивную пленку.
Таким образом, в комплексных щелочных электролитах цинкования необходимо тщательно поддерживать не только определенную концентрацию каждого компонента, но и их соотношение в растворе. Например, если концентрация NaOH в цинкатном электролите находится в оптимальном интервале, а концентрация ионов цинка в процессе эксплуатации возросла, то изменилось соотношение их концентраций. В результате в прианодном слое электролита начинает не хватать ионов ОН — для растворения образующегося цинкатного комплекса, и поверхность анода постепенно покрывается пассивной пленкой.
Причиной образования солевых пассивационных пленок на цинковых анодах может также являться слишком высокая анодная плотность тока. В этом случае скорость образования ионов цинка может быть настолько высока, что, несмотря на оптимальные концентрации комплексообразующих веществ и металла в объеме щелочных электролитах или высокую растворимость солей в слабокислых электролитах, в прианодном слое электролита будут образовываться нерастворимые соединения, пассивирующие поверхность анода.
Другой причиной солевой пассивации цинковых анодов является накопление карбонатов в щелочных электролитах, поступающих из воздуха. При концентрации карбонатов 60-80 г/л (которые, кстати, при такой концентрации ухудшают качество цинковых покрытий) возможна кристаллизация карбонатных соединений натрия и цинка различного состава на поверхности анода.
Необходимо отметить, что солевая пассивация даже небольшой части поверхности анодов весьма опасна для нормального проведения технологического процесса и получения качественных цинковых покрытий. В этом случае происходит уменьшение активной поверхности (на которой происходит нормальное растворение металла). Поскольку сила тока на ванне в процессе эксплуатации не изменяется, уменьшение активно растворяющейся поверхности анода приводит к увеличению анодной плотности тока. Скорость растворения металла начинает превышать скорость отвода ионов вглубь раствора, и создаются дополнительные условия для образования нерастворимых соединений металла и пассивации поверхности.
Пассивация растворимых анодов приводит не только к уменьшению скорости поступления ионов цинка в электролит и нарушению его оптимальной концентрации. Поскольку солевая пленка не является проводником, на ваннах (особенно барабанного и колокольного типов), начинает возрастать напряжение. При этом из-за высокого сопротивления часть электроэнергии расходуется на образование тепловой энергии и электролиты начинают разогреваться. Повышение температуры большинства электролитов цинкования более 30-35 °С приводит к ухудшению качества (блеска) покрытий и снижению рассеивающей способность электролитов по металлу.
Другой проблемой является то, что образующиеся мелкодисперсные нерастворимые соединения не только адсорбируются на поверхности анода, но и находясь в объеме электролита, могут включаться в состав цинкового покрытия на деталях. Мелкодисперсные частицы очень долго не осаждаются на дно. При этом ухудшаются не только декоративные, но и основные функциональные свойства цинковых покрытий — защита стали от коррозии. В частности на поверхности неметаллических включений не образуется пассивная пленка в хроматных или фосфатных растворах, увеличивается ее пористость, снижается коррозионная стойкость и защитный эффект.
Завышенная анодная плотность тока приводит не только к солевой пассивации анодов. Известно, что анодное растворение металлов происходит неравномерно по поверхности. Наиболее интенсивно растворение происходит по границам зерен металла. На равномерность растворения оказывают влияние также химический состав анодов (примеси других металлов) и микрогеометрия (шероховатость) поверхности анода и другие факторы. Неравномерная скорость растворения приводит к тому, что отдельные небольшого размера кусочки металла, не успев раствориться, выпадают из структуры металла. Это называется выкрашиванием или шламлением анодов. Крупные частицы достаточно быстро оседают на дно ванны, а очень мелкие могут длительное время находиться во взвешенном состоянии в растворе и включаться в состав катодного покрытия. Часто это проявляется в том, что поверхность цинкового покрытия становится шероховатой, хотя и блестящей. Выкрашивание анодов приводит к увеличению непроизводительных потерь цветного металла.
Конечно, для предотвращения попадания твердых частиц в электролит, можно применять анодные чехлы из химически стойкой (желательно полипропиленовой) ткани. Естественно, что через некоторое время чехлы забиваются шламом и их необходимо периодически чистить или менять. В противном случае будет повышаться электрическое сопротивление и возрастать напряжение на гальванической ванне. В этой связи следует подчеркнуть особую роль фильтрующих установок, которые постоянно или периодически очищают электролиты от неизбежно накапливающихся механических примесей. Кроме того, при непрерывной фильтрации (2-3 объема в час) происходит перемешивание электролита. Перемешивание, благоприятно влияя на катодный процесс, способствует также ускорению отвода образующихся ионов цинка от поверхности анодов, снижая вероятность образования нерастворимых соединений.
Важным технологическим показателем является соотношение катодной и анодной поверхностей в гальванической ванне. В случае применения только растворимых анодов, их рабочая поверхность определяется, прежде всего, допустимой величиной анодной плотности тока, при которой цинк работает в устойчивом растворимом состоянии. Рассчитывая требуемую силу тока для осаждения качественных цинковых покрытий, следует иметь в виду, что сторона анодной пластины, обращенной к стенке ванны, работает как растворимый анод не более, чем на 30% от этой поверхности.
Как правило, для всех электролитов цинкования рекомендуется соотношение между покрываемой поверхностью и поверхностью растворимых анодов (Sк:Sа) в диапазоне от 1:1 до 1:1,5.
В тоже время, наиболее стабильная работа цинковых анодов в слабокислых и щелочных электролитах соответствует 1-1,5 А/дм 2 . Если расчетная величина поверхности анодов большая и их нельзя разместить в гальванической ванне, применяются насыпные аноды в виде нарубленных по форме кубиков цинковых пластинок или, что предпочтительнее — в виде шариков. Они насыпаются в гофрированные корзинки из титана и размещаются на анодных штангах. Размеры и количество титановых корзин определяются геометрическими размерами ванны, типом и размером гальванического оборудования (подвески, барабаны и др.), конфигурацией деталей. Часто насыпные аноды применяют в ваннах барабанного и колокольного типов, в которых площадь обрабатываемой поверхности деталей большая.
Особый случай организации анодного процесса имеет место для щелочных цинкатных электролитов. Поскольку в этих электролитах трудно обеспечить постоянную концентрацию цинка в процессе эксплуатации электролитов, для поддержания баланса необходимо применять или только нерастворимые аноды, или заменять часть цинковых анодов на нерастворимые. Наиболее приемлемым материалом для этих целей является низкоуглеродистая сталь (например, Ст3) или никель. Иногда на стальные пластины гальваническим способом наносят никелевое покрытие толщиной 15-20 мкм. Это связано с тем, что углеродистая сталь и никель хорошо пассивируются в щелочных средах и не растворяются даже при использовании их в качестве анода. Не рекомендуется применение высоколегированных хромоникелевых сталей, так как в процессе эксплуатации происходит растворение хрома и загрязнение электролита. Очистка от ионов Cr(VI) электролитов цинкования очень затруднена. При электролизе на нерастворимых анодах протекает реакция выделения кислорода:
Нерастворимые аноды в щелочных электролитах цинкования могут применяться в различных вариантах. Возможно применение только нерастворимых анодов. В этом случае необходимо очень часто производить корректировку электролита по цинку. Для корректировки, как правило, отбирают некоторый объем электролита и растворяют в нем расчетное количество окиси цинка (ZnO). Можно, если позволяет расход других компонентов, растворять ZnO в растворе NaOH в отдельной емкости и, затем, вводить в электролит. Однако эти способы не всегда удобны, так как требуют точного расчета количества ZnO, которое может быть растворено в электролите без образования нерастворимых соединений.
Часто порошок оксида цинка засыпается непосредственно в ванну цинкования. Следует иметь ввиду, что при таком способе корректировки, часть порошка не растворяется и присутствует в электролите виде взвешенных частиц. После таких корректировок требуется фильтрация раствора, но даже и в этом случае качество покрытий, как правило, ухудшается, а электролит необходимо прорабатывать под током для восстановления его свойств.
Достаточно распространенным вариантом использования нерастворимых анодов являются их периодическое завешивание (вместо растворимых анодов). По прошествии некоторого времени, при понижении концентрации ионов цинка до необходимого значения, производится обратная замена. Возможно и одновременное использование растворимых и нерастворимых анодов. Соотношение поверхности катода и анодов остается от 1:1 до 1:1,5. Отношение площади поверхности растворимых и нерастворимых анодов подбирается для каждого производства в зависимости от условий эксплуатации электролитов и на основании данных систематического химического анализа, определяющего скорость поступления и расхода цинка в электролите.
В цианидных электролитов цинкования применять нерастворимые аноды рекомендуется только в случаях крайней необходимости, когда другие меры не позволяют предотвратить накопление цинка в электролите. Это связано с тем, что на нерастворимых анодах происходит разрушение (окисление) одного из главных компонентов электролита — цианид-иона. Поэтому, при работе с нерастворимыми анодами следует чаще контролировать и корректировать электролита содержание NaCN в электролите. Применение нерастворимых анодов целесообразно при селективной очистке электролитов от металлов-примесей проработкой на низких плотностях тока.
При электроосаждении цинка из щелочного цинкатного электролита на нерастворимых анодах происходит интенсивное выделение газообразного кислорода. Учитывая, что на катоде выделяется водород (ВТZn
60-80%), в рабочей зоне гальванической ванны над раствором образуется большое количество аэрозолей, содержащих высокую концентрацию щелочи. В этом случае для обеспечения нормальных условий труда необходимо увеличить скорость отсасывания воздуха через бортовую вентиляцию. Необходимо также проверить соответствие производительности фильтрующих элементов, очищающих кислотнощелочные воздушные выбросы, увеличившемуся выносу загрязнителей в атмосферу.
В настоящее время для щелочных цинкатных электролитов чаще предлагается применять только нерастворимые аноды, а для корректировки по цинку использовать специальные установки — генераторы цинка, находящиеся вне ванны цинкования.
http://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/284.html
http://www.galvanicrus.ru/for_engineers/zn_anode_1.php