Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de78e95bd6f6b50 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Используя метод электронного баланса, составьте уравнение реакции HCl + KClO3 → Cl2 + KCl + H2O Определите окислитель и восстановитель
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,292
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,160
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Задача № 3. Используя метод электронно-ионного баланса составьте полные уравнения следующих окислительно-восстановительных реакций:
Читайте также:
|
Используя метод электронно-ионного баланса составьте полные уравнения следующих окислительно-восстановительных реакций:
1) KClO3 + HCl 


1. В уравнении (1) KClO3 – окислитель, восстанавливается до Cl2;
Cl – – восстановитель, окисляется до Cl2.
2. Записываем схему реакции: KClO3 + HCl 
3. Составляем уравнения процессов окисления и восстановления с учетом характера среды:




2Cl – – 2 
 |
2ClO 
Внимание!В левой части уравнения процесса окисления взято два хлорид-иона, т.к. продуктом окисления является двухатомная молекула Cl2. Все коэффициенты в полученном молекулярно-ионном уравнении кратны 2, поэтому запишем уравнение в следующем виде:
ClO 
4. Переносим коэффициенты в молекулярное уравнение реакции:
5. В уравнении (2) H2O – окислитель, восстанавливается до H2;
Si – восстановитель, окисляется в щелочной среде до SiO 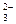
Si + NaOH + H2O 
6. Составляем уравнения процессов окисления и восстановления:






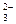
4H2O + Si + 6OH 

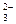
приводим подобные члены:
H2O + Si + 2OH 
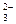
7. Переносим коэффициенты в молекулярное уравнение реакции:
8. В уравнении (3) MnO 


9. Записываем схему реакции: KNO2 + KMnO4 + H2O 
10. 

MnO 


NO 


 |
2MnO 
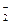

11. Переносим коэффициенты в молекулярное уравнение реакции:
Упражнения и задачи для самостоятельного решения.
1. Разделите вещества H2SO4, NH3, HCl, KMnO4, FeSO4, Na, H2, HNO2, HClO4, H2O2, F2 на 3 группы: а) вещества, проявляющие только окислительные свойства; б) вещества, проявляющие только восстановительные свойства; в) вещества, проявляющие как окислительные, так и восстановительные свойства.
2. Укажите, какие из перечисленных веществ могут проявлять только окислительные свойства (свойства катионов не учитывать): K2Cr2O7, H2O2, KМnO4, HCl(конц.), HNO3(разб.), Cl2, SO2, HBr.
3. Определите степень окисления атома хрома в следующих молекулах и ионах: Cr2O3; K2Cr2O7; KCr(SO4)2; CrO 
4. Расположите вещества в порядке возрастания их окислительных свойств: K2MnO4, MnO2, KMnO4, Mn2O3, MnCl2, Mn.
5. Какую роль в окислительно-восстановительных реакциях могут выполнять а) H2SO4 и H2S (за счет атомов серы); б) K2Cr2O7, Cr и CrCl3 (за счет атомов хрома)? Ответ поясните.
6. Какую роль в окислительно-восстановительных реакциях могут выполнять следующие ионы: Cl 
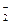
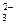
7. Расположите ионы в порядке уменьшения их восстановительных свойств: F – , At – , Cl – , I – , Br – .

1. Подберите коэффициенты в уравнениях окислительно-восстановительных реакций методом электронного баланса. Определите тип окислительно-восстановительных реакций:
NH3 + O2 

H2S + O2 

2. Составьте уравнение окислительно-восстановительной реакции. Укажите окислитель и восстановитель, процессы окисления и восстановления: NaCrO2 + Br2 + NaOH 
3. Расставьте коэффициенты в уравнениях окислительно-восстановительных реакций ионно-электронным методом, укажите окислитель и восстановитель, процессы окисления и восстановления: Al + HNO3 


4. Окисление сероводорода водным раствором дихромата калия протекает в кислой среде по схеме:
5. Какой объем сероводорода (н.у.) прореагирует с 250 мл 0,25М раствора дихромата калия? Какая масса серы при этом образуется?
6. Технический сульфит натрия массой 10 г растворили в воде и добавили 40 г раствора с массовой долей перманганата калия 7,9%. Реакция протекает в присутствии серной кислоты. Определите массовую долю сульфита натрия в техническом образце. (Ответ: 63%)
7. Какая масса оксида марганца (IV) и какой объем раствора соляной кислоты с массовой долей HCl 24% (пл.=1,12 г/мл) были израсходованы для получения хлора, если при действии его на раствор иодида калия образовалось 25,4 г йода? (Ответ: 8,7 г; 54,3 мл)
8. При растворении в соляной кислоте смеси железа и магния массой
10,4 г выделилось 6,72 л водорода (н.у.). Найдите массу каждого металла в смеси. (Ответ: 5,6 г Fe; 4,8 г Mg)
9. На 10,4 г смеси алюминия и оксида алюминия подействовали раствором гидроксида натрия. Выделившийся газ сожгли и получили 7,2 г воды. Определить массовые доли компонентов в смеси.
Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Студалл.Орг (0.015 сек.)
http://www.soloby.ru/992528/%D0%B8%D1%81%D0%BF%D0%BE%D0%BB%D1%8C%D0%B7%D1%83%D1%8F-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B8%D1%82%D0%B5-%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C-%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D1%8C
http://studall.org/all-56422.html
