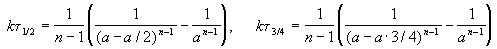Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается .
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором .
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например , при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
Кинетическим уравнением реакции является математическое выражение
1. Основные понятия и постулаты химической кинетики
Химическая кинетика — раздел физической химии, изучающий скорости химических реакций. Основные задачи химической кинетики: 1) расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача); 2) определение механизмов реакций по кинетическим кривым (обратная задача).
Скорость химической реакции описывает изменение концентраций реагирующих веществ в единицу времени. Для реакции
aA + bB + . 
скорость реакции определяется следующим образом:
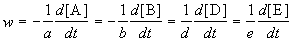
где квадратные скобки обозначают концентрацию вещества (обычно измеряется в моль/л), t — время; a, b, d, e — стехиометрические коэффициенты в уравнении реакции.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики — законом действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в некоторые степени:
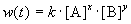
где k — константа скорости (не зависящая от концентрации); x, y — некоторые числа, которые называют порядком реакции по веществам A и B, соответственно. Эти числа в общем случае никак не связаны с коэффициентами a и b в уравнении реакции. Сумма показателей степеней x + y называется общим порядком реакции. Порядок реакции может быть положительным или отрицательным, целым или дробным.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. Элементарные реакции бывают только трех типов: мономолекулярные (A 


ПРИМЕРЫ
Пример 1-1. Скорость образования NO в реакции 2NOBr(г) 
Решение. По определению, скорость реакции равна:
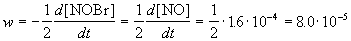
Из этого же определения следует, что скорость расходования NOBr равна скорости образования NO с обратным знаком:
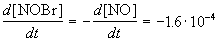
Пример 1-2. В реакции 2-го порядка A + B 
Решение. По закону действующих масс, в любой момент времени скорость реакции равна:
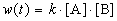
К моменту времени, когда [A] = 1.5 моль/л, прореагировало по 0.5 моль/л веществ A и B, поэтому [B] = 3 – 0.5 = 2.5 моль/л. Константа скорости равна:
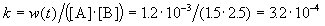
К моменту времени, когда [B] = 1.5 моль/л, прореагировало по 1.5 моль/л веществ A и B, поэтому [A] = 2 – 1.5 = 0.5 моль/л. Скорость реакции равна:
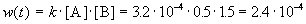
ЗАДАЧИ
1-1. Как выражается скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3 через концентрации азота и водорода? (ответ)
1-2. Как изменится скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3, если уравнение реакции записать в виде N2 + 3H2 = 2NH3? (ответ)
1-3. Чему равен порядок элементарных реакций: а) Сl + H2 = HCl + H; б) 2NO + Cl2 = 2NOCl? (ответ)
1-4. Какие из перечисленных величин могут принимать а) отрицательные; б) дробные значения: скорость реакции, порядок реакции, молекулярность реакции, константа скорости, стехиометрический коэффициент? (ответ)
1-5. Зависит ли скорость реакции от концентрации продуктов реакции? (ответ)
1-6. Во сколько раз увеличится скорость газофазной элементарной реакции A = 2D при увеличении давления в 3 раза?(ответ)
1-7. Определите порядок реакции, если константа скорости имеет размерность л 2 /(моль 2 . с). (ответ)
1-8. Константа скорости газовой реакции 2-го порядка при 25 о С равна 10 3 л/(моль . с). Чему равна эта константа, если кинетическое уравнение выражено через давление в атмосферах?(ответ)
1-9. Для газофазной реакции n-го порядка nA 
1-10. Константы скорости прямой и обратной реакции равны 2.2 и 3.8 л/(моль . с). По какому из перечисленных ниже механизмов могут протекать эти реакции: а) A + B = D; б) A + B = 2D; в) A = B + D; г) 2A = B.(ответ)
1-11. Реакция разложения 2HI 
1-12. Скорость реакции 2-го порядка A + B 
1-13. В реакции 2-го порядка A + B 
1-14. В реакции 2-го порядка A + B 
1-15. Скорость газофазной реакции описывается уравнением w = k . [A] 2 . [B]. При каком соотношении между концентрациями А и В начальная скорость реакции будет максимальна при фиксированном суммарном давлении? (ответ)
2. Кинетика простых реакций
В данном разделе мы составим на основе закона действующих масс и решим кинетические уравнения для необратимых реакций целого порядка.
Реакции 0-го порядка. Скорость этих реакций не зависит от концентрации:
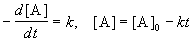
где [A] — концентрация исходного вещества. Нулевой порядок встречается в гетерогенных и фотохимических реакциях.
Реакции 1-го порядка. В реакциях типа A 
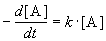
При решении кинетических уравнений часто используют следующие обозначения: начальная концентрация [A]0 = a, текущая концентрация [A] = a — x(t), где x(t) — концентрация прореагировавшего вещества A. В этих обозначениях кинетическое уравнение для реакции 1-го порядка и его решение имеют вид:
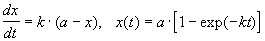
Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции:
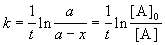
Время, за которое распадается половина вещества A, называют периодом полураспада t 1/2. Он определяется уравнением x(t 1/2) = a/2 и равен
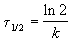
Реакции 2-го порядка. В реакциях типа A + B 
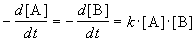
При решении этого уравнения различают два случая.
1) одинаковые начальные концентрации веществ A и B: a = b. Кинетическое уравнение имеет вид:
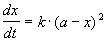
Решение этого уравнения записывают в различных формах:
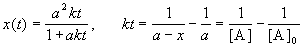
Период полураспада веществ A и B одинаков и равен:
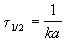
2) Начальные концентрации веществ A и B различны: a 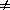
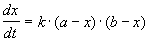
Решение этого уравнения можно записать следующим образом:
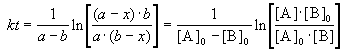
Периоды полураспада веществ A и B различны: 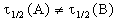
Реакции n-го порядка nA 
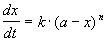
Решение кинетического уравнения:
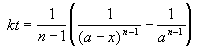
Период полураспада вещества A обратно пропорционален (n-1)-й степени начальной концентрации:
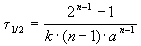
Пример 2-1. Период полураспада радиоактивного изотопа 14 C — 5730 лет. При археологических раскопках было найдено дерево, содержание 14 C в котором составляет 72% от нормального. Каков возраст дерева?
Решение. Радиоактивный распад — реакция 1-го порядка. Константа скорости равна:
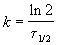
Время жизни дерева можно найти из решения кинетического уравнения с учетом того, что [A] = 0.72 . [A]0:
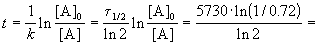
Пример 2-2. Установлено, что реакция 2-го порядка (один реагент) завершается на 75% за 92 мин при исходной концентрации реагента 0.24 М. Какое время потребуется, чтобы при тех же условиях концентрация реагента достигла 0.16 М?
Решение. Запишем два раза решение кинетического уравнения для реакции 2-го порядка с одним реагентом:
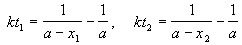
где, по условию, a = 0.24 M, t1 = 92 мин, x1 = 0.75 . 0.24 = 0.18 M, x2 = 0.24 — 0.16 = 0.08 M. Поделим одно уравнение на другое:
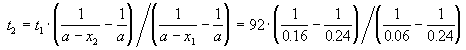
Пример 2-3. Для элементарной реакции nA 
и поделим одно выражение на другое. Постоянные величины k и a из обоих выражений сократятся, и мы получим:
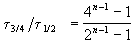
Этот результат можно обобщить, доказав, что отношение времен, за которые степень превращения составит a и b , зависит только от порядка реакции:
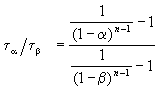
ЗАДАЧИ
2-1. Пользуясь решением кинетического уравнения, докажите, что для реакций 1-го порядка время t x, за которое степень превращения исходного вещества достигает x, не зависит от начальной концентрации. (ответ)
2-2. Реакция первого порядка протекает на 30% за 7 мин. Через какое время реакция завершится на 99%? (ответ)
2-3. Период полураспада радиоактивного изотопа 137 Cs, который попал в атмосферу в результате Чернобыльской аварии, — 29.7 лет. Через какое время количество этого изотопа составит менее 1% от исходного? (ответ)
2-4. Период полураспада радиоактивного изотопа 90 Sr, который попадает в атмосферу при ядерных испытаниях, — 28.1 лет. Предположим, что организм новорожденного ребенка поглотил 1.00 мг этого изотопа. Сколько стронция останется в организме через а) 18 лет, б) 70 лет, если считать, что он не выводится из организма?(ответ)
2-5. Константа скорости для реакции первого порядка SO2Cl2 = SO2 + Cl2 равна 2.2 . 10 -5 с -1 при 320 о С. Какой процент SO2Cl2 разложится при выдерживании его в течение 2 ч при этой температуре?(ответ)
2-6. Константа скорости реакции 1-го порядка
2N2O5(г) 
при 25 о С равна 3.38 . 10 -5 с -1 . Чему равен период полураспада N2O5? Чему будет равно давление в системе через а) 10 с, б) 10 мин, если начальное давление было равно 500 мм рт. ст. (ответ)
2-7. Реакцию первого порядка проводят с различными количествами исходного вещества. Пересекутся ли в одной точке на оси абсцисс касательные к начальным участкам кинетических кривых? Ответ поясните.(ответ)
2-8. Реакция первого порядка A 
2-9. Реакция второго порядка 2A 
2-10. Вещество A смешали с веществами B и C в равных концентрациях 1 моль/л. Через 1000 с осталось 50% вещества А. Сколько вещества А останется через 2000 с, если реакция имеет: а) нулевой, б) первый, в) второй, в) третий общий порядок?(ответ)
2-11. Какая из реакций — первого, второго или третьего порядка — закончится быстрее, если начальные концентрации веществ равны 1 моль/л и все константы скорости, выраженные через моль/л и с, равны 1? (ответ)
CH3CH2NO2 + OH — 
имеет второй порядок и константу скорости k = 39.1 л/(моль . мин) при 0 о С. Был приготовлен раствор, содержащий 0.004 М нитроэтана и 0.005 М NaOH. Через какое время прореагирует 90% нитроэтана? (ответ)
2-13. Константа скорости рекомбинации ионов H + и ФГ — (фенилглиоксинат) в молекулу НФГ при 298 К равна k = 10 11.59 л/(моль . с). Рассчитайте время, в течение которого реакция прошла на 99.999%, если исходные концентрации обоих ионов равны 0.001 моль/л. (ответ)
2-14. Скорость окисления бутанола-1 хлорноватистой кислотой не зависит от концентрации спирта и пропорциональна [HClO] 2 . За какое время реакция окисления при 298 К пройдет на 90%, если исходный раствор содержал 0.1 моль/л HClO и 1 моль/л спирта? Константа скорости реакции равна k = 24 л/(моль . мин). (ответ)
2-15. При определенной температуре 0.01 М раствор этилацетата омыляется 0.002 М раствором NaOH на 10% за 23 мин. Через сколько минут он будет омылен до такой же степени 0.005 М раствором KOH? Считайте, что данная реакция имеет второй порядок, а щелочи диссоциированы полностью.(ответ)
2-16. Реакция второго порядка A + B 
*2-17. Скорость автокаталитической реакции A 
*2-18. Автокаталитическая реакция A 
*2-19. Автокаталитическая реакция A 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
ФИЗИЧЕСКАЯ ХИМИЯ Химическая кинетика и катализ.
Химическая кинетика и катализ
Химическая кинетика – это учение о химическом процессе, его механизме и закономерностях протекания во времени. Химическая кинетика позволяет предсказывать скорость химических процессов. Создание математической теории химического процесса является в настоящее время необходимым условием для проектирования химических реакторов.
Содержание химической кинетики составляют два основных раздела:
а) формально математическое описание скорости реакции без учета механизма самой реакции ( математическое выражение процесса в целом), так называемая формальная (феноменологическая) кинетика;
б) учение о механизме химического взаимодействия на основе молекулярных данных о свойствах частиц – теории кинетики (молекулярная кинетика).
Скорость процесса химического взаимодействия зависит от условий, в которых протекает реакция. В соответствии с тем, в какой фазе протекает реакция, различают кинетику газовых реакций, кинетику реакций в растворах и кинетику реакций в твердой фазе.
В системах, в которых протекает последовательно несколько процессов, скорость всего процесса в целом определяется наиболее медленной, так называемой определяющей (лимитирующей) стадией. Если лимитирующей стадией является сам акт химического взаимодействия и процесс подвода и отвода компонентов реакции не влияет на ее скорость, то говорят, что реакция протекает в кинетической области. Здесь величина скорости реакции определяется кинетическим законам собственно химической стадии процесса. Могут встречаться реакции, в которых определяющей стадией является подвод реагирующего вещества, а не сам акт химического взаимодействия. В этом случае процесс протекает в диффузионной области, и скорость всего процесса определяется законами диффузии. Кроме того, бывают случаи, когда скорости реакции и диффузии соизмеримы. Скорость всего процесса тогда является сложной функцией кинетических и диффузионных явлений, и процесс протекает в переходной области.
Кинетическая классификация реакций
1. По числу частиц, участвующих в реакции:
2. По природе частиц, участвующих в элементарном акте реакции:
· реакции, в которой участвуют молекулы, называются молекулярными;
· реакции с участием свободных радикалов или атомов называются цепными;
· реакции с участием ионов называются ионными.
3. По числу фаз, участвующих в реакции:
· Гомогенными называются реакции, протекающие в однородной среде (например, в смеси реагирующих газов или в растворе);
· Гетерогенными называются реакции, протекающие в неоднородной среде, на поверхности соприкосновения взаимодействующих веществ, находящихся в разных фазах (например, твердой и жидкой, газообразной и жидкой и т.п.).
4. По степени сложности:
В зависимости от механизма реакции могут быть подразделены на простые и сложные. К простым реакциям относятся реакции, протекающие в одном направлении и включающие один химический этап. Формально они классифицируются по порядку (когда стехиометрический и кинетический порядки совпадают) и могут быть нулевого, первого, второго, третьего порядков. В «чистом виде» простые реакции почти не встречаются. В подавляющем большинстве случаев это стадии сложных химических процессов.
Сложные реакции – это многостадийные химические процессы. В кинетике существует положение о независимом протекании отдельных стадий сложной реакции: значение константы скорости отдельной стадии не зависит от наличия в системе других стадий.
Сложные реакции подразделяются следующим образом:
— обратимые реакции: А + В 
В случае параллельных реакций скорость всего процесса будет определяться скоростью наиболее быстрой его стадии.
Если в последовательных реакциях скорость одной из химических стадий значительно меньше скоростей других, то скорость всего процесса будет определяться скоростью самой медленной стадии.
1.1. Понятие о скорости химической реакции
Для гомогенной химической реакции, протекающей при постоянном объеме, скоростью процесса по некоторому веществу называется изменение концентрации этого вещества в единицу времени. Если реакция описывается стехиометрическим уравнением:
Скоростью реакции называется величина:



В кинетике принимают, что w > 0, поэтому знак «минус» в формуле (1.2) стоит потому, что сама производная отрицательна. Кроме того, скорость данной реакции имеет одинаковое значение независимо от того, через изменение концентрации какого из реагентов она выражена.
Скорость реакции зависит от природы веществ, их концентрации, температуры, наличия катализаторов и других факторов. Установление по экспериментальным данным вида уравнения зависимости скорости реакции от концентрации (кинетического уравнения) составляет одну из задач феноменологической кинетики. Для простых или элементарных реакций (односторонних, одностадийных химических процессов), а также для элементарных стадий сложных реакций эта зависимость устанавливается законом действующих масс, сформулированным норвежскими учеными Гульдбергом и Вааге (1864-1867): скорость реакции пропорциональна произведению концентраций реагентов (исходных), возведенных в степени, равным абсолютным значениям стехиометрических коэффициентов.
Если реакция (1.1) является элементарной, то основное кинетическое уравнение ее скорости (математическое выражение закона действующих масс) запишется в виде:
В некоторых случаях для сложных реакций справедливо выражение типа:
которое различается с (1.3) тем, что 
Показатель степени при концентрации CАi в кинетическом уравнении скорости реакции называют порядком реакции по веществу Аi. Различают порядки стехиометрические 









Общим или суммарным порядком реакции n называется сумма показателей степеней концентраций в основном кинетическом уравнении скорости реакции.
В кинетическом уравнении скорости реакции коэффициент пропорциональности k, не зависящий от концентрации, называется константой скорости или удельной скоростью, то есть скоростью, отнесенной к единице концентрации. Ее величина изменяется в широких пределах в зависимости от рода реакции и быстро растет с повышением температуры.
Формально простые кинетические уравнения типа (1.3) обычно представляют собой интерполяционные формулы сложных химических реакций. Одной из причин получения дробных порядков может быть тот факт, что реакция идет по нескольким путям при получении одного и того же продукта.
Важная характеристика реакции – ее молекулярность.
Для простой реакции молекулярность – это число частиц, принимающих участие в элементарном акте химического взаимодействия. В данном случае порядок и молекулярность совпадают. Простые реакции могут быть мономолекулярными, бимолекулярными, тримолекулярными. Участие в элементарном акте более трех частиц маловероятно.
В сложных реакциях конечный продукт образуется в результате протекания нескольких стадий. В этих случаях под молекулярностью понимают число частиц, испытывающих химическое превращение в соответствии со стехиометрическими уравнением реакции. Здесь порядок и молекулярность могут не совпадать.
Кинетика реакций первого порядка
В общем виде можно записать:
Пусть в исходный момент времени имеется а моль исходного вещества А. К моменту времени t прореагировало х моль вещества и осталось а – х моль вещества А.
Основное кинетическое уравнение скорости реакции первого порядка будет иметь вид:
Разделим переменные и проинтегрируем:
Получаем уравнение для расчета константы скорости:
k = 
Размерность константы скорости первого порядка [время -1 ].
Константу скорости можно найти также графически:

На рисунке показаны зависимости х=f(t) и (а–х)=f(t). В точке пересечения а–х=х, значит х=а/2, т.е. к моменту времени t1/2 прореагирует половина взятого вещества, t1/2 называется временем или периодом полупревращения.
Период полупревращения реакций первого порядка:
Кинетика реакций второго порядка
Стехиометрическое уравнение реакции можно записать в общем виде
Если а и b – начальные мольные концентрации реагирующих веществ А и В, а х – число моль в 1 л, которое прореагировало за время t, то основное кинетическое уравнение скорости реакции второго порядка можно представить:
Интегрирование приводит к уравнению константы скорости (а
k = 
В простейшем случае концентрации веществ А и В одинаковы и а = b.
При этих условиях основное кинетическое уравнение скорости реакции второго порядка имеет вид:
Интегрирование дает уравнение константы скорости (а = b):
k = 
Для определения значения k можно также использовать графический метод:
В случае а = b строится график в координатах 1/(а – х) = f(t), константа скорости равна: k = tg a .

Значение k для реакции второго порядка зависит от единиц, в которых выражена концентрация. Если выразить концентрацию в моль/л, а время в с, тогда константа скорости реакции второго порядка имеет размерность
Период полупревращения реакций второго порядка:
Кинетика реакций третьего порядка
Для реакции 3-го порядка вида А + В + С ® продукты
можно написать следующее основное кинетическое уравнение:
В частном случае, когда a=b=c, основное кинетическое уравнение скорости реакции третьего порядка имеет вид:
В результате интегрирования получим уравнение константы скорости:
k = 
Для графического нахождения константы скорости строят зависимость:
Размерность константы скорости таких реакций [л 2 . моль -2 . с -1 ].
Период полупревращения реакций третьего порядка:
Кинетика реакций нулевого порядка
Существуют реакции, скорость которых не меняется с изменением концентрации одного или нескольких реагирующих веществ, поскольку она определяется не концентрацией, а некоторым другим ограничивающим фактором, например, количеством поглощенного света при фотохимических реакциях или количеством катализатора в каталитических реакциях. Тогда основное кинетическое уравнение скорости реакции имеет вид:
Константа скорости реакции нулевого порядка:
1.3. Методы определения порядка реакции
Все методы определения порядка реакции можно разделить на интегральные и дифференциальные.
1) Метод подстановки.
Заключается в том, что подстановка экспериментальных данных в уравнения нулевого, первого, второго, третьего порядков должна в одном из случаев дать постоянное значение константы скорости.
2) Графический метод.
График, построенный по опытным данным для концентраций рассматриваемого исходного вещества в разные моменты времени протекания реакции, будет выражаться прямой линией в разных координатах в зависимости от порядка данной реакции по веществу:
3) По периоду полупревращения.
Получают экспериментальные данные по τ½ при разных начальных концентрациях а, затем их анализируют.
Реагирующие вещества берут в одинаковых концентрациях. Определяют скорость реакции при двух концентрациях в различные промежутки времени:


 |
 |
2) По периоду полупревращения.
Для двух различных начальных концентраций а1 и а2 период полупревращения различен, т.к. он обратно пропорционален начальной концентрации в степени (n – 1).
Таким образом, определив по экспериментальным кривым «концентрация – время» период полупревращения для двух различных начальных концентраций:




можно вычислить порядок реакции:

2.1. Влияние температуры на скорость реакции
Обычно при повышении температуры скорость химической реакции увеличивается. Из этого общего правила известны лишь несколько исключений (например, реакция третьего порядка: 2 NO + O2 ® 2 NO2).
Влияние температуры на скорость химической реакции количественно может быть охарактеризовано в узком интервале температур величиной температурного коэффициента скорости реакции.
Температурным коэффициентом скорости реакции называется отношение констант скоростей реакции при двух температурах, отличающихся на 10 0 :
g =
g = 
Для подавляющего большинства реакций температурный коэффициент больше 1, причем величина его может изменяться в широких пределах. У многих реакций в растворах, при комнатной температуре, а также у ряда реакций в газовой фазе, протекающих при более высоких температурах, согласно эмпирическому правилу Вант-Гоффа, повышение температуры на 10 0 вызывает возрастание скорости реакции в 2 
Объяснение больших величин температурного коэффициента дано теорией активных соударений Аррениуса.
Большие величины температурного коэффициента скорости реакции, а также несоответствие между числом столкновений реагирующих молекул и скоростью реакции позволили Аррениусу сформулировать его теорию активных соударений (ТАС)
Согласно Аррениусу, всякая реакция протекает через промежуточную стадию, связанную с образованием активных молекул:
Нормальные молекулы 
Уравнение (2.2) является теоретическим обоснованием эмпирического правила Вант-Гоффа и объясняет большие величины температурного коэффициента.

где k – экспериментально определяемая константа скорости реакции;
k0 – предэкспоненциальный множитель.
Еа – тепловой эффект перехода нормальных молекул в активные, так называемая энергия активации.
Энергия активации – это та энергия, которую должны накопить нормальные молекулы, чтобы иметь возможность прореагировать.
Количественным критерием возрастания скорости реакции (константы скорости) с повышением температуры является величина энергии активации, поэтому множитель е -Еа/ RT в уравнении (2.2) называют фактором активации.
В дифференциальной форме уравнение (2.2) имеет вид:

Зависимости (2.2, 2.3) представляют собой уравнения Вант-Гоффа –Арениуса. Они показывают зависимость константы скорости реакции от температуры. Из формул видно, что логарифм экспериментально определяемой константы скорости является линейной функцией обратной температуры при условии, что энергия активации не зависит от температуры:
ln k = – 
где ln k0 – постоянная интегрирования.
Уравнение (2.4) можно использовать для графических расчетов энергии активации по экспериментальным данным. Для этого необходимо определить константы скорости при нескольких температурах и отложить на графике ln k в функции обратной температуры.
Взяв определенный интеграл от уравнения (2.3), получим получим интегральную форму уравнения Аррениуса:

Уравнение (2.5) можно использовать для аналитических расчетов энергии активации по экспериментальным данным:

На рисунке представлено Максвелл-Больцмановское распределение молекул по энергиям. Молекулы, для которых Е 
На рисунке показано изменение энергии реагирующей системы. Здесь области: I – исходные молекулы, II – активные молекулы, III – продукты реакции, Еа – энергия активации, DН – тепловой эффект реакции. Избыточная по сравнению со средним значением энергия необходима для разрыва или ослабления связей в молекулах реагирующих веществ. Таким образом, под энергией активации понимают минимальное значение суммарной энергии сталкивающихся молекул, которая обеспечивает вступление их в реакцию между собой.
Активирование осуществляется путем соударения молекул. Протекание реакции, возможность ее осуществления обусловлены столкновением активных частиц. Столкновения как неактивных, так и активных частиц, как правило, являются бинарными вследствие малой вероятности тройных соударений. Теория активных столкновений основана на двух предпосылках:
1) наличие в системе активных молекул, возникающих за счет столкновения неактивных по законам статистического распределения энергии;
2) осуществление реакции возможно только в результате столкновения активных молекул.
Под активными молекулами понимают частицы, обладающие избыточным запасом энергии, достаточным для преодоления энергетического барьера реакции.
Из рисунка следует, что скорость реакции, пропорциональная числу активных молекул, зависит от энергии активации. Уровень «активные молекулы» определяет тот наименьший запас энергии, которым должны обладать молекулы, чтобы их столкновения могли привести к химическому взаимодействию. Разность между данным и исходным уровнем представляет собой энергию активации прямой реакции Еа. Таким образом, по пути от исходного состояния в конечное система должна перейти через своего рода энергетический барьер. Только активные молекулы, обладающие в момент столкновения необходимым избытком энергии, могут преодолевать этот барьер и вступить в химическое взаимодействие.
В ряде случаев наблюдаемая скорость реакции гораздо меньше вычисляемой по уравнению (2.4). Для таких реакций в уравнение вводится поправочных множитель, который находится опытным путем.
где р – поправочный множитель, называемый фактором вероятности или стерическим (пространственным) фактором. Этот фактор должен учесть такие особенности во взаимодействии молекул, как, например, ориентацию молекул в момент столкновения, распад активных молекул до столкновения, «неудачные удары» и т.д.
1. Теория активных соударений рассматривает только результат соударения, но не его сам акт;
2. Теория Аррениуса дает возможность вычислить энергию активации реакции в целом, но не объясняет ее связи с механизмом реакции и строением молекул, не объясняет физического смысла предэкпоненциального множителя;
Теория активного комплекса (ТАК) представляет собой дальнейшее развитие теории активных соударений. Она детально изучает сам акт соударения, рассматривает его энергетику. Используя квантово-статистические методы, ТАК изучает энергетический процесс соударения, рассматривает физику активных соударений и химического превращения. Согласно этой теории, активные соударения, приводящие реакции, являются сложным процессом постепенного перераспределения связей в молекуле, который начинается еще до столкновения молекул и заканчивается только после того, как молекулы как молекулы разойдутся на расстояния, превышающие дальность действия их силовых полей. Теория активного комплекса основана на том, что элементарный акт взаимодействия молекул состоит в постепенной перестройке химических связей. В любом элементарном акте взаимодействия первой стадией является сближение молекул, приводящее к образованию активных групп или активного комплекса, который может либо вновь распадаться либо дать продукты реакции.
Например, реакцию между молекулярным водородом и йодом с образованием йодистого водорода схематически можно изобразить следующим образом:





Приближение молекулы водорода к молекуле йода приводит к постепенному ослаблению связи между атомами в этих молекулах. В момент наибольшего сближения молекул связи между всеми атомами становятся равноценными и все атомы принадлежат одному (переходному) состоянию или состоянию активного комплекса. Активный комплекс не является молекулой или промежуточным соединением, потому что реагирующие молекулы в переходном состоянии обладают максимальной энергией. Здесь не может быть равновесного состояния. Реакцию (2.6) нужно рассматривать как одностадийную реакцию. Время жизни комплекса ничтожно мало
(
Рассмотрим процесс взаимодействия молекулы АВ с молекулой С. Это взаимодействие происходит с обязательной промежуточной стадией – образованием активированного комплекса А – – В – – С по схеме:
Образование активного комплекса связано с ослаблением связей в молекулах реагирующих веществ, т.е. первоначально с затратой работы и соответственным увеличением потенциальной энергии системы. Таким образом, в процессе реакции происходит сначала рост, а затем падение потенциальной энергии системы. Исходное АВ + С и конечное А + ВС состояние системы разделены энергетическим барьером.
В ходе реакции расстояния между атомами в реагирующих молекулах изменяются, а в переходном состоянии они между всеми атомами становятся соизмеримыми. На рис.1 показано изменение потенциальной энергии показано изменение потенциальной энергии системы атомов АВС вдоль координаты пути реакции х: АВ + С – исходное состояние системы, А + ВС – конечное состояние.
Рисунок 1 Рисунок 2
Координата реакции х является величиной, характеризующей перемещение системы по ходу реакции, вдоль пути, наиболее выгодного энергетически. Эта величина всегда должна возрастать по ходу процесса. Таким образом, в ходе элементарного акта химического превращения система преодолевает энергетический процесс. Долины Р1 и Р2 разделяют энергетический барьер Р. Разность между потенциальной энергией Р1 исходных веществ и потенциальной энергией активного комплекса в перевалочной точке Р равна энергии активации. На рис. 2 показано изменение потенциальной энергии при перемещении вдоль координаты реакции Р1РР2. Здесь вместо пространственного изображения применена топографическая схема с использованием линий, показывающих эквипотенциальные поверхности.
Термодинамическое обоснование теории активного комплекса
Статистическая термодинамика дает наиболее общее уравнение теории активного комплекса:
kск = 

где h – постоянная Планка, 6,62 . 10 -34 Дж . с;
k – постоянная Больцмана, 1,38 . 10 -23 Дж/К;
К * – константа равновесия между активными комплексом и исходными веществами;
æ – трансмиссионный коэффициент или коэффициент прохождения. Он учитывает долю активных комплексов, скатывающихся с перевала Р в долину Р2 и превращается в конечные продукты). Для большинства реакций æ близок к 1.
Из 2 закона термодинамики: 


Для равновесия между активным комплексом и исходными веществами:


Подставляем в (2.7):
kск = æ

Из уравнения (2.8) можно вычислить kск, зная 


Чтобы выяснить физический смысл 
ln kск = ln æ 
Дифференцируем по Т:
Из теории Аррениуса:
Из уравнения изобары Вант-Гоффа:
Значит, 
Для большинства реакции Еа >>RT (Ea 

Теория активного комплекса позволяет вычислить стерический фактор р. Приравнивая правые части уравнений (2.8) и уравнение Аррениуса, считая, что ΔH * 
р = æ
Кинетика гетерогенных реакций.
Гетерогенными называются реакции, протекающие на поверхности раздела фаз. Такие реакции могут протекать в двух областях: диффузионной и кинетической.
В кинетической области kреак > kдиф и скорость всего процесса определяется диффузионными зависимостями.
Отличительные особенности диффузионной области:
1) малые величины энергии активации – Едиф.обл. 10 ккал;
2) влияние перемешивания на скорость реакции.
Рассмотрим процесс диффузии.
Диффузией называется самопроизвольное перемещение вещества, приводящее к равномерному распределению концентраций в объеме.
Диффузия может осуществляться только в тех случаях, когда в различных точках пространства концентрация веществ различна. Движущей силой диффузии является градиент концентрации. Это изменение концентрации на отрезке пути dx – 
Обозначим dm –количество вещества, проходящее при диффузии через площадь S, за время dt.
Тогда 

D – коэффициент диффузии [м 2 /с]
Коэффициент диффузии представляет собой количество вещества, проходящего в единицу времени через единицу площади, при градиенте концентрации равном единице.
D = f(температуры, природы вещества).

Рассмотрим диффузионную кинетику реакции при стационарном состоянии диффузионного потока. Возьмем некоторый объем, в котором происходит диффузия.
Стационарное состояние диффузионного потока характеризуется тем, что в элемент объема dx в единицу времени входит такое же количество вещества, какое выходит из этого объема.
Скорость диффузии при этих условиях будет равна:
1) Рассмотрим случай, когда реакция протекает в диффузионной области.
Пусть С1 – концентрация вещества в объеме раствора;
С2 – концентрация вещества у поверхности твердой фазы.
Тогда :
Обозначим 
2) Рассмотрим кинетические зависимости в тех случаях, когда скорость диффузии и скорость химической реакции соизмеримы.
Примем S = 1м 2 , тогда

δ – толщина диффузионного слоя.
Для химической реакции возьмем наиболее простой случай (n =1). В реакцию вступают только те вещества, компоненты которых находятся в поверхностном слое.
при установившемся процессе

Обозначим 
Тогда: 
Можно также записать: 
где 

3. К а т а л и з
3.1. Основные понятия катализа
Катализом называют явление увеличения скорости реакции, происходящее под действием некоторых веществ (катализаторов), которые, участвуя в процессе, остаются химически неизменными.
Имеются также вещества, которые наоборот уменьшают скорость реакции – ингибиторы. А явление называется ингибированием или отрицательным катализом.
Общий механизм каталитического действия состоит в том, что реагирующее вещество и катализатор образуют промежуточное соединение, которое реагирует с другим исходным веществом с образованием продуктов реакции и регенерации молекул катализатора.
Схема процесса: А + В = (АВ) * → С + D
Природа промежуточных соединений в катализе разнообразна. Чаще всего они представляют собой лабильные молекулы или радикалы, существующее лишь очень короткое время.
Если рассматривать катализ с энергетической точки зрения, то можно заметить, что катализатор ведет реакцию по иному пути, чем тот, который отвечает реакции без катализатора. Поэтому энергия активации каталитической реакции значительно ниже энергии активации реакции без катализатора. Т.к. энергия активации входит в показатель степени в уравнении для константы скорости, то даже сравнительно небольшое снижение энергии активации сильно увеличивает скорость химического превращения.









3.2. Свойства катализаторов
В промышленности используются различные катализаторы, но все они обладают рядом общих свойств, которые присущи и самому явлению катализа в целом:
1. Катализаторы ускоряют течение только тех реакций, которые термодинамически возможны, т. е (ΔG + и ОН — .
5. при одновременном параллельном действии нескольких катализаторов или при параллельном образовании нескольких промежуточных соединений за счет одного катализатора общая скорость процесса равна сумме скоростей разложения отдельных промежуточных соединений.
Механизм гетерогенного катализа
На практике наиболее часто встречаются 2 типа гетерогенного катализа: а) катализатор находится в твердой фазе, а реагирующие вещества – в жидкой; б) катализатор находится в твердой фазе, а реагирующие вещества – в газообразной.
Пусть в отсутствии катализатора протекает реакция.
А + В = (АВ) * → продукты
Предположим, что активные состояния (АВ) * для каталитической и некаталитической реакции аналогичны.
Весь гетерогенно-каталитический процесс можно разделить на следующие стадии:
1) адсорбция исходных веществ на поверхности катализатора —
Этот процесс активированный и экзотермический, т.е. состояние АВК будет обладать меньшей потенциальной энергией по сравнению с (А+В+К)
2) перевод адсорбированного состояния в активное —
Этот процесс требует затраты определенной энергии Ек, которая является истинной энергией активации гетерогенно-каталитической реакции.
3) реакция в адсорбированном состоянии с образованием адсорбированных конечных продуктов —
(АВК) * → (продукты) К
4) десорбция продуктов реакции с регенерацией катализатора
(продукты) К→ продукты + К
График процесса имеет вид:









Как видно из рисунка ΔЕк есть энтальпия адсорбции активного комплекса на катализаторе.
Теории гетерогенного катализа
В настоящее время предложено несколько приближенных теорий, в которых проблема гетерогенного катализа рассматривается на основе различных упрощающих предположений. Согласно современным взглядам, реагирующие вещества образуют с катализатором поверхностные промежуточные соединения. Различия между теориями заключается, в основном, во взглядах на природу поверхностных соединений и на природу активных мест поверхности катализатора. Все теории обычно признают существование активных центров на поверхности катализатора. Изучение адсорбции показало, что поверхность адсорбента неоднородна и различные ее участки обладают разным адсорбционным потенциалом.
Рассмотрим 2 теории гетерогенного катализа:
· Мультиплетная теория Баландина.
В этой теории предполагается, что в образовании поверхностного соединения участвуют группы активных атомов поверхности – мультиплеты, обладающими определенными геометрическими и энергетическими свойствами. В мультиплетной теории рассматриваются принципы геометрического и энергетического соответствия.
Согласно принципу геометрического соответствия, твердое тело может быть гетерогенным катализатором данной реакции, если расположение активных мест на его поверхности находится в геометрическом соответствии с расположением атомов в молекулах реагирующих веществ. Расстояние между атомами в мультиплете должно соответствовать расстоянию между атомами в реагирующих молекулах.
Принцип энергетического соответствия утверждает, что должно быть также определенное соответствие между энергиями связей атомов в молекулах реагирующих веществ и в мультиплетном комплексе, для того чтобы данное твердое тело могло быть катализатором данной реакции.
· Теория активных ансамблей Кобозева.
Предполагается, что активными центрами служат атомы, беспорядочно расположенные на поверхности кристаллического тела. Поверхность твердого кристаллического тела при этом выполняет функцию как бы инертной подкладки. Для каждого данного процесса активным центром является ансамбль из определенного числа атомов нанесенного катализатора. Теория применима в тех случаях, когда на поверхность носителя – твердого тела нанесено очень небольшое число атомов металла, обычно меньше 0,01 от всей поверхности.
Рассмотрим строение поверхности адсорбционного катализатора, когда на нее нанесено небольшое количество металла. Согласно современным взглядам, твердое кристаллическое тело состоит из большого числа микроскопических участков – блоков или областей миграции. Эти участки разделены геометрическими и энергетическими барьерами. При нанесении на твердое тело атомов металла в каждую такую область миграции попадает несколько атомов металла. Область миграции вместе с попавшими в нее атомами металла называется ансамблем. В разных областях миграции может находиться разное число атомов металла, но каталитической активностью обладают только ансамбли с определенным числом атомов металла в внутри области миграции. Такие ансамбли называются активными.
http://www.chem.msu.su/rus/teaching/eremin/1-2.html
http://kursak.net/fizicheskaya-ximiya-ximicheskaya-kinetika-i-kataliz/