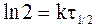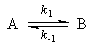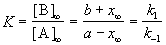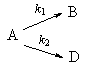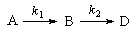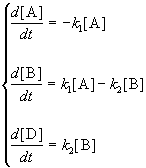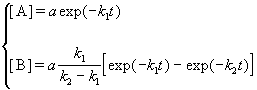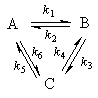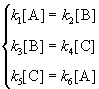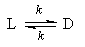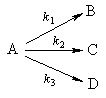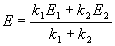Необратимая реакция первого порядка
Необратимая реакция первого порядка описывается уравнением, вытекающим из уравнения (9 — 7),
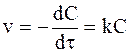
Уравнение (9 — 8) дополняется граничным условием:
в начальный момент времени (t = 0) концентрация вещества равна С0.
Разделив переменные и проинтегрировав уравнение (9 — 8), получим:
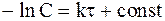
Подстановка граничных условий в уравнение (9 — 9) дает:
а кинетическое уравнение для необратимой реакции первого порядка в интегральной форме принимает окончательный вид:

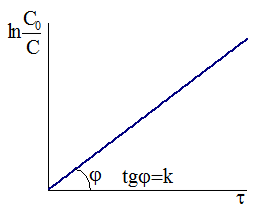 Рис. 9 — 1.Зависимость концентрации от времени для необратимой реакции первого порядка. Рис. 9 — 1.Зависимость концентрации от времени для необратимой реакции первого порядка. |
Таким образом, для необратимой реакции первого порядка существует прямая пропорциональность между логарифмом отношения исходной концентрации к действующей концентрации и временем протекания реакции (Рис. 9 ‑ 1).
Часто в качестве характеристики интенсивности протекания химической реакции вместо константы скорости используют время полупревращениявещества t1/2, то есть время, за которое концентрация вещества уменьшается вдвое (C = 1/2C0).
Радиоактивные превращения описываются таким же кинетическим уравнением, что и химические реакции первого порядка. Для них традиционно вместо времени полупревращения используют понятие время полураспада, которое также обозначается t1/2.
Подставляя данные, определяющие время полупревращения в уравнение (9 — 10), получим:
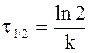
С учетом выражения (9 — 11) кинетическому уравнению реакции первого порядка можно придать следующую форму:
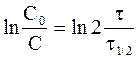
Кроме времени полупревращения, реакция может быть охарактеризована временем превращения вещества на X %, которое обозначим tХ%. В этом случае действующая концентрация должна быть равной:
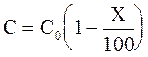
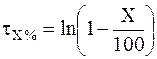
Если задачей кинетического исследования реакции ставится нахождение зависимости концентрации вещества от времени протекания реакции, то кинетическому уравнению придают следующий вид:
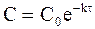
Уравнение (9 — 14) описывает кинетическую кривую, показанную на рис. 9 ‑ 2.
Для необратимой реакции, при которой не образуются промежуточные вещества, концентрация продукта реакции CB определяется из условия:
Поэтому кинетика накопления продукта реакции описывается кинетическим уравнением:
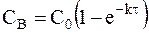
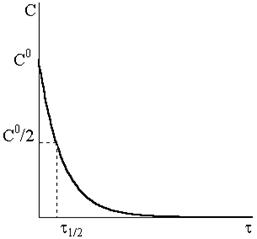 Рис. 9 — 2.Кинетическая кривая реакции первого порядка. Рис. 9 — 2.Кинетическая кривая реакции первого порядка. |
Кинетическая кривая расходования исходного вещества и кривая накопления продуктов реакции пересекаются в точке, отвечающей времени полупревращения.
Еще одной характеристикой необратимой реакции первого порядка служит среднее время жизни молекулы 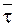
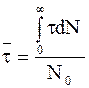
где t — время жизни молекул, число которых соответствует интервалу от N до N + dN, N0 — общее число молекул, принимающих участие в реакции.
В соответствии с уравнением (9 — 8) число молекул с заданным временем жизни t можно определить, используя равенство
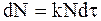
а из уравнения (9 — 14) следует:
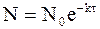
Уравнение для расчета среднего времени жизни молекулы принимает следующий вид:
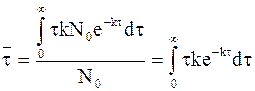
Уравнение (9 — 18) интегрируется по частям, для чего можно обозначить u = t, 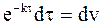
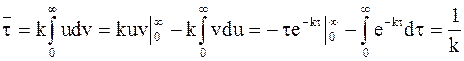
Ниже приводится соотношение между характеристиками необратимой реакции первого порядка:
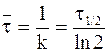
Дата добавления: 2015-07-22 ; просмотров: 1418 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Кинетическое уравнение для необратимой реакции первого порядка
Из уравнений (4) и (5) видно, что критериями первого порядка реакции по реагенту А является линейная зависимость ln [ A ] – t или ln 
В тоже время по тангенсам углов наклона линейных зависимостей можно определить константы скорости.
Другой тест правильности выбранного первого порядка является постоянство константы скорости реакции, вытекающее из уравнения (5)
Размерность константы скорости первого порядка dim < k >= [1/ c ], [1/мин] или соответственно с -1 , мин -1
Третий тест основан на концентрационной зависимости времени полупревращения. Условие полупревращения [ A ] = 0,5[ A ]0 , тогда в соответствии с уравнением (5)
Можно видеть, что критерием первого порядка реакции является независимость времени полупревращения t ½ от начальной концентрации реагента [ A ]0.
Примерами подобных реакций первого порядка являются реакции изомеризации, а также реакции разложения некоторых сложных молекул в газовой фазе.
и в жидкой фазе, например, гидролиз трет-бутилбромида.
Для реакции A + B → C + D можно записать уравнение скорости
Обозначим [ A ]0 и [ B ]0 – начальными концентрациями реагентов А и В, а Х – количество прореагировавших А и В, тогда уравнение (1) приобретет вид
Разделяя переменные, имеем
Проинтегрируем левую часть этого уравнения методом неопределенных коэффициентов, для чего представим дробь
в виде суммы дробей
Решая совместно эти уравнения, имеем

Подставляя значения α и β в уравнение (3) и (4) и интегрируя полученные уравнения в соответствующих пределах
Из уравнения (5) видно, что критерием правильности выбранного второго порядка реакции является линейность зависимости

По тангенсу угла наклона этой зависимости можно определить константу скорости реакции. Другим критерием правильности выбранного второго порядка является постоянство значений k , вычисленных в соответствии с уравнением (5):
во всем диапазоне пар значений τ – х.
Размерность константы скорости второго порядка

Если вещества А и В взяты в равных количествах или реакция идет с участием одного вещества, например
то при постоянстве объема удобно использовать в качестве переменной концентрацию одного из исходных веществ
тогда кинетическое уравнение будет иметь вид
Интегрируя это уравнение в соответствующих пределах
приходим к выражению
Из уравнений (7) и (8) следует, что критериями правильности выбранного второго порядка являются линейный характер зависимости 1/[ A ] от t и постоянство значения k , вычисленных для различных пар значений [ A ] – t по формуле
Третий критерий правильности второго порядка основан на определении времени полупревращения t ½ . Так как [ A ] = 0.5[ A ]0, то в соответствии с уравнением (7)

Можно видеть, что критерием второго порядка является обратно пропорциональная зависимость между t ½ и начальной концентрацией реагента. В соответствии с выражениями (7) и (8) константы скорости второго порядка можно определить по тангенсу угла наклона зависимостей 

Имеется множество реакций протекающих по кинетике второго порядка:
и простой случай, соответствующий равенству исходных и текущих концентраций реагентов
Разделяя переменные и интегрируя
Из уравнения (3) видно, что критериями правильности выбранного третьего порядка является линейность зависимостей 

для всех пар значений t и [ A ] и обратно пропорциональная зависимость между временем полупревращения и квадратом начальной концентрации реагента
В соответствии с уравнением (3) константа скорости третьего порядка может быть определена по тангенсу угла наклона зависимости 

Интегрирование уравнения (1)
приводит к выражениям
Из уравнений (2) и (3) следует, что критериями нулевого порядка по реагенту А являются линейный характер зависимости [ A ] от t , постоянство k , вычисленного по формуле

Из уравнений (2) и (3) следует, что константа скорости нулевого порядка может быть определена по тангенсу угла наклона зависимостей [ A ]0 – [ A ] или [ A ] от времени
Сложные реакции представляют собой совокупность простых реакций. К сложным реакциям относятся обратимые реакции.
При кинетическом анализе сложных реакций руководствуются принципом независимости простых реакций, согласно которому каждая простая реакция, входящая в сложную ведет себя кинетически так, как если бы она была единственная.
в начальный момент времени концентрация реагента A составляет [ A ]0, а [ B ] = 0, то уравнение этой реакции запишется как
Выражая r через концентрацию [A] имеем


где X – количество молей вещества A в единице объеме, которое прореагировало к моменту τ и соответственно количество молей вещества B в единице объеме, которое образовалось к этому моменту. Преобразуя правую часть уравнения (2)

В условиях равновесия
При τ ® ¥ X стремится к своему равновесному значению X ® X ¥ . Тогда
где
Тогда кинетическое уравнение (3) примет вид
Интегрируя это уравнение в соответствующих пределах
и
В соответствии с выражениями (6) и (7) кинетические зависимости для A и B будут иметь следующий вид
Пользуясь интегральной формой кинетического уравнения (5) и соотношением 
Так, в соответствии с (5)
так как 
Подставляя последнее выражение в уравнение (8), имеем
Подставляя выражение (10) в уравнение (8), имеем
Рассмотрим систему параллельных реакций первого порядка
В соответствии с ранее принятыми обозначениями суммарная скорость расходования реагента A выразится уравнением
По форме уравнение (1) подобно кинетическому уравнению необратимой реакции первого порядка, поэтому его интегральная форма имеет вид.
Разрешая уравнение (2) относительно [ A ] имеем
Для определения констант k 1 и k 2 рассмотрим уравнения конкурирующих параллельных реакций.
Поделив почленно, левые и правые части уравнений (5) и (6), имеем уравнение 
Разделяя, левые и правые части уравнений (5) и (1), (6) и (7), приходим к очевидным равенствам

интегрирование которых дает уравнения:

Подставляя в последние уравнения выражение (4) приходим к равенствам
Уравнения (2) и (8) являются основой для определения абсолютных значений констант скорости конкурирующих реакций k 1 и k 2 . На первом этапе можно определить сумму констант скоростей k 1 + k 2 , пользуясь уравнением (2). Затем на основе линейных зависимостей между XB и X , а также XC и X определяют брутто константы 

Нетрудно показать, что для трех параллельных реакций первого порядка


Этот случай более сложен по сравнению с предыдущим. Рассмотрим систему параллельных реакций
Уравнение скорости расхода A в этой системе реакций с учетом его количества, прореагировавшего к моменту времени t (Х) имеет вид:
или с учетом преобразований
обозначая 
Разделяя переменные, приходим к выражению
Интегрируем левую часть уравнения (3) методом неопределенных коэффициентов, для чего представим левую её часть в виде суммы дробей.

так как 

Тогда 
Откуда 

С учетом (4) возвращаемся к уравнению (3)
Интегрирование уравнения (5) приводит к выражению
Откуда
или
Возвращаясь к соотношению 
Рассмотрим систему двух последовательных реакций первого порядка
В силу принципа независимости скорости расходования реагента A выражается уравнением скорости необратимой реакции первого порядка
Решение которого дается в виде


Уравнение скорости изменения концентрации промежуточных продуктов
Разделим почленно левые и правые части уравнений (3) и (1)
Уравнение (4) имеет признаки однородного уравнения первого порядка. Для его решения вводим обозначение
Подставляя последнее выражение в уравнение (4), имеем:
Разделяем переменные и интегрируем
и
тогда
и
или
Так как 
В тоже время в соответствии с уравнением (2)
Тогда уравнение (5) можно преобразовать в форму
Выведенные зависимости показывают, что в случае необратимых последовательных реакций уравнение для первого промежуточного продукта связано с характеристиками лишь первых двух стадий, оставаясь одинаковым при любом числе и характеристиках последующих стадий. При этом независимо от начальной концентрации реагента A , значение второй характеристики материального баланса 
Используя уравнение (5) можно найти 
Из анализа уравнения (6) следует, что при XA = 0 и XA = 1 

откуда
и значение максимума
Из выражений (8) и (9) видно, что положение и величина максимума промежуточного продукта в необратимых реакциях первого порядка зависит только от соотношения констант скоростей первых двух стадий. При этом, чем больше величина 

Уравнение образования продукта C :
Максимальная скорость 
Легко видеть, что это условие соответствует одновременно условию максимума концентрации B , определяемого уравнениями(8) и (9). Качественно проанализированные зависимости могут быть представлены графически.
Неэлементарные реакции состоят из ряда элементарных стадий, составляющих их механизм. Кинетика таких реакций определяется последовательностью элементарных стадий, их характером (обратимые, необратимые), природой реагентов, интермедиатов и продуктов реакции. При кинетическом анализе неэлементарных реакций возникает задача определения концентраций интермедиатов, играющих ключевую роль в образовании продуктов или расходовании реагентов. В качестве инструмента такого определения используется принцип квазистационарных концентраций Боденштейна – Семенова. Согласно этому принципу скорость изменения концентраций нестабильных интермедиатов пренебрежимо мала по сравнению со скоростью изменения концентраций реагентов и продуктов реакции и её можно считать равной нулю. Применение принципа стационарных концентраций к неэлементарным реакциям, протекающим по сложному механизму, позволяет исключить из кинетического описания процессов неизвестные концентрации интермедиатов и получить одно или некоторый минимум дифференциальных уравнений скорости, выраженных через подлежащие измерению концентрации реагентов и продуктов реакции.
Рассмотрим пример неэлементарной реакции, описываемой стехиометрией
и протекающей через образование интермедиата Q
Скорость реакции можно приравнять к скорости образования продукта B
В соответствии с принципом квазистационарных концентраций
откуда
Подставляя последнее выражение в уравнение (1) приходим к уравнению скорости реакции
Если экспериментально возможно непосредственно измерить скорость реакции, то обработку кинетических данных можно провести, преобразуя уравнение (3) как:
Последнее уравнение приводится к виду
Обрабатывая зависимость (4) в координатах 

Кинетическое уравнение для необратимой реакции первого порядка
При изучении кинетики сложных реакций, включающих несколько элементарных стадий, используют принцип независимости химических реакций:
Если в системе протекает несколько простых реакций, то каждая из них подчиняется основному постулату химической кинетики независимо от других реакций.
Основные типы сложных реакций мы рассмотрим на примере реакций первого порядка.
1. Обратимые реакции первого порядка:
Закон действующих масс записывается следующим образом:
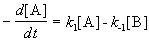
Если начальные концентрации веществ A и B обозначить, соответственно, a и b и ввести степень превращения x ([A] = a — x, [B] = b + x), то кинетическое уравнение приобретает вид:
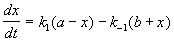
Решение этого уравнения можно выразить через степень превращения, соответствующую достижению равновесия:
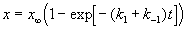
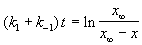
где x 
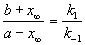
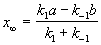
При t 

2. Параллельные реакции первого порядка:
Кинетическое уравнение записывается с учетом принципа независимости:
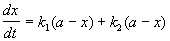
Решение этого уравнения записывается так же, как и для одной реакции первого порядка:
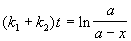
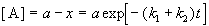
Для параллельных реакций в любой момент времени отношение концентраций продуктов постоянно и определяется константами скорости элементарных стадий:
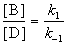
3. Последовательные реакции первого порядка:
Пусть в начальный момент времени есть только вещество A. Применим к этой системе закон действующих масс и принцип независимости химических реакций:
Решение этой системы дает концентрации веществ:
Концентрация промежуточного вещества достигает максимума при
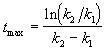
Величина этого максимума определяется отношением констант k2 / k1. Если оно велико, т.е. k2 >> k1, то промежуточный продукт не успевает накапливаться и его концентрация в любой момент времени мала. В этом случае для анализа кинетических уравнений можно использовать приближенный метод квазистационарных концентраций ( 6).
Пример 5-1. Для обратимой реакции первого порядка
Kравн = 8, а k1 = 0.4 с -1 . Вычислите время, при котором концентрации веществ A и B станут равными, если начальная концентрация вещества B равна 0.
Решение. Из константы равновесия находим константу скорости обратной реакции:
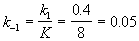
По условию, мы должны найти время, за которое прореагирует ровно половина вещества A. Для этого надо подставить значение x(t) = a/2 в решение кинетического уравнения для обратимых реакций (5.1) и (5.2):
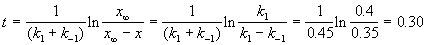
Пример 5-2. В параллельных реакциях первого порядка
выход вещества B равен 63%, а время превращения A на 1/3 равно 7 минутам. Найдите k1 и k2.
Решение. Кинетическое уравнение (5.3) для разложения вещества в параллельных реакциях имеет вид уравнения первого порядка, в которое вместо одной константы скорости входит сумма констант скорости отдельных стадий. Следовательно, по аналогии с реакциями первого порядка, по времени превращения A на 1/3 (x(t) = a/3) можно определить сумму констант k1 + k2:
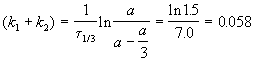
Выход вещества В равен 63%, а вещества D — 37%. Отношение этих выходов равно отношению конечных концентраций веществ B и D, следовательно оно равно отношению соответствующих констант скорости:
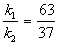
Решая это уравнение совместно с предыдущим, находим: k1 = 0.037 мин -1 , k2 = 0.021 мин -1 .
Пример 5-3. Имеется следующее равновесие:
Как связаны между собой константы k1 — k6?
Решение основано на принципе детального равновесия:
Если сложная система находится в равновесии, то в каждой из элементарных стадий также соблюдается равновесие.
Это означает, что во всех трех процессах: A 


Перемножив почленно эти три равенства и поделив левую и правую части на произведение равновесных концентраций [A] . [B]. [C], находим искомое соотношение между константами скорости:
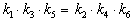
5-1. Нарисуйте графики зависимости концентраций веществ A и B от времени в обратимой реакции A 
5-5. Превращение роданида аммония NH4SCN в тиомочевину (NH4)2CS — обратимая реакция первого порядка. Рассчитайте константы скорости прямой и обратной реакций, используя следующие экспериментальные данные:
t, мин
Доля прореагировавшего NH4SCN, %
5-6. Один из методов оценки возраста биологических объектов основан на измерении содержания в них оптических изомеров аминокислот. В живых организмах отношение концентраций D- и L-изомеров постоянно ([D]0 / [L]0 = a). В мертвых организмах происходит рацемизация:
Чему равен возраст биологического объекта, в котором [D] / [L] = b? Решите задачу в общем виде и для образца, содержащего аспарагиновую кислоту (k = 1.48 . 10 -5 лет -1 , a = 0.07, b = 0.27).(ответ)
5-7. В параллельных реакциях первого порядка
выход вещества B равен 53%, а время превращения A на 1/3 равно 40 c. Найдите k1 и k2.(ответ)
5-8. Реакция разложения вещества А может протекать параллельно по трем направлениям:
Концентрации продуктов в смеси через 5 мин после начала реакции были равны: [B] = 3.2 моль/л, [C] = 1.8 моль/л, [D] = 4.0 моль/л. Определите константы скорости k1 — k3, если период полураспада вещества А равен 10 мин.(ответ)
5-9. Реакция разложения вещества А может протекать параллельно по трем направлениям:
Концентрации продуктов в смеси через 10 мин после начала реакции были равны: [B] = 1.6 моль/л, [C] = 3.6 моль/л, [D] = 7.8 моль/л. Определите константы скорости k1 — k3, если период полураспада вещества А равен 8 мин.(ответ)
5-10. Покажите, что при двух параллельных реакциях
энергия активации суммарной реакции разложения A связана с энергиями активации отдельных стадий следующим образом:
*5-11. В системе идут две параллельные газофазные реакции: А + B 

5-12. На одном графике нарисуйте зависимости концентрации вещества B от времени в системе последовательных реакций A 

| [предыдущий раздел] | [содержание] | [следующий раздел] |


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
http://www.trotted.narod.ru/physchem/26.htm
http://www.chem.msu.su/rus/teaching/eremin/5.html