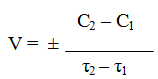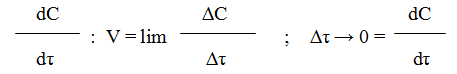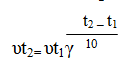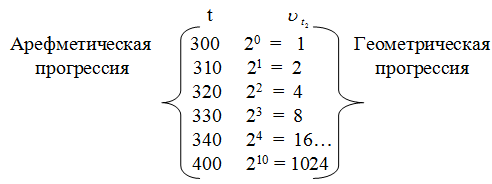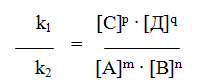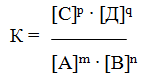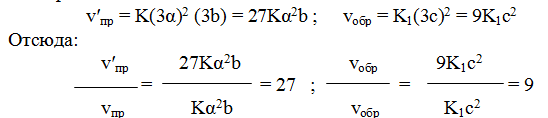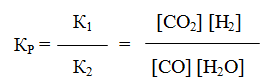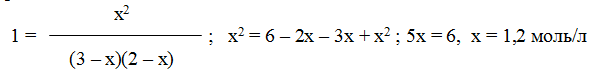Кинетическое уравнение для реакций разных порядков
Из уравнений (4) и (5) видно, что критериями первого порядка реакции по реагенту А является линейная зависимость ln [ A ] – t или ln 
В тоже время по тангенсам углов наклона линейных зависимостей можно определить константы скорости.
Другой тест правильности выбранного первого порядка является постоянство константы скорости реакции, вытекающее из уравнения (5)
Размерность константы скорости первого порядка dim < k >= [1/ c ], [1/мин] или соответственно с -1 , мин -1
Третий тест основан на концентрационной зависимости времени полупревращения. Условие полупревращения [ A ] = 0,5[ A ]0 , тогда в соответствии с уравнением (5)
Можно видеть, что критерием первого порядка реакции является независимость времени полупревращения t ½ от начальной концентрации реагента [ A ]0.
Примерами подобных реакций первого порядка являются реакции изомеризации, а также реакции разложения некоторых сложных молекул в газовой фазе.
и в жидкой фазе, например, гидролиз трет-бутилбромида.
Для реакции A + B → C + D можно записать уравнение скорости
Обозначим [ A ]0 и [ B ]0 – начальными концентрациями реагентов А и В, а Х – количество прореагировавших А и В, тогда уравнение (1) приобретет вид
Разделяя переменные, имеем
Проинтегрируем левую часть этого уравнения методом неопределенных коэффициентов, для чего представим дробь
в виде суммы дробей
Решая совместно эти уравнения, имеем

Подставляя значения α и β в уравнение (3) и (4) и интегрируя полученные уравнения в соответствующих пределах
Из уравнения (5) видно, что критерием правильности выбранного второго порядка реакции является линейность зависимости

По тангенсу угла наклона этой зависимости можно определить константу скорости реакции. Другим критерием правильности выбранного второго порядка является постоянство значений k , вычисленных в соответствии с уравнением (5):
во всем диапазоне пар значений τ – х.
Размерность константы скорости второго порядка

Если вещества А и В взяты в равных количествах или реакция идет с участием одного вещества, например
то при постоянстве объема удобно использовать в качестве переменной концентрацию одного из исходных веществ
тогда кинетическое уравнение будет иметь вид
Интегрируя это уравнение в соответствующих пределах
приходим к выражению
Из уравнений (7) и (8) следует, что критериями правильности выбранного второго порядка являются линейный характер зависимости 1/[ A ] от t и постоянство значения k , вычисленных для различных пар значений [ A ] – t по формуле
Третий критерий правильности второго порядка основан на определении времени полупревращения t ½ . Так как [ A ] = 0.5[ A ]0, то в соответствии с уравнением (7)

Можно видеть, что критерием второго порядка является обратно пропорциональная зависимость между t ½ и начальной концентрацией реагента. В соответствии с выражениями (7) и (8) константы скорости второго порядка можно определить по тангенсу угла наклона зависимостей 

Имеется множество реакций протекающих по кинетике второго порядка:
и простой случай, соответствующий равенству исходных и текущих концентраций реагентов
Разделяя переменные и интегрируя
Из уравнения (3) видно, что критериями правильности выбранного третьего порядка является линейность зависимостей 

для всех пар значений t и [ A ] и обратно пропорциональная зависимость между временем полупревращения и квадратом начальной концентрации реагента
В соответствии с уравнением (3) константа скорости третьего порядка может быть определена по тангенсу угла наклона зависимости 

Интегрирование уравнения (1)
приводит к выражениям
Из уравнений (2) и (3) следует, что критериями нулевого порядка по реагенту А являются линейный характер зависимости [ A ] от t , постоянство k , вычисленного по формуле

Из уравнений (2) и (3) следует, что константа скорости нулевого порядка может быть определена по тангенсу угла наклона зависимостей [ A ]0 – [ A ] или [ A ] от времени
Сложные реакции представляют собой совокупность простых реакций. К сложным реакциям относятся обратимые реакции.
При кинетическом анализе сложных реакций руководствуются принципом независимости простых реакций, согласно которому каждая простая реакция, входящая в сложную ведет себя кинетически так, как если бы она была единственная.
в начальный момент времени концентрация реагента A составляет [ A ]0, а [ B ] = 0, то уравнение этой реакции запишется как
Выражая r через концентрацию [A] имеем


где X – количество молей вещества A в единице объеме, которое прореагировало к моменту τ и соответственно количество молей вещества B в единице объеме, которое образовалось к этому моменту. Преобразуя правую часть уравнения (2)

В условиях равновесия
При τ ® ¥ X стремится к своему равновесному значению X ® X ¥ . Тогда
где
Тогда кинетическое уравнение (3) примет вид
Интегрируя это уравнение в соответствующих пределах
и
В соответствии с выражениями (6) и (7) кинетические зависимости для A и B будут иметь следующий вид
Пользуясь интегральной формой кинетического уравнения (5) и соотношением 
Так, в соответствии с (5)
так как 
Подставляя последнее выражение в уравнение (8), имеем
Подставляя выражение (10) в уравнение (8), имеем
Рассмотрим систему параллельных реакций первого порядка
В соответствии с ранее принятыми обозначениями суммарная скорость расходования реагента A выразится уравнением
По форме уравнение (1) подобно кинетическому уравнению необратимой реакции первого порядка, поэтому его интегральная форма имеет вид.
Разрешая уравнение (2) относительно [ A ] имеем
Для определения констант k 1 и k 2 рассмотрим уравнения конкурирующих параллельных реакций.
Поделив почленно, левые и правые части уравнений (5) и (6), имеем уравнение 
Разделяя, левые и правые части уравнений (5) и (1), (6) и (7), приходим к очевидным равенствам

интегрирование которых дает уравнения:

Подставляя в последние уравнения выражение (4) приходим к равенствам
Уравнения (2) и (8) являются основой для определения абсолютных значений констант скорости конкурирующих реакций k 1 и k 2 . На первом этапе можно определить сумму констант скоростей k 1 + k 2 , пользуясь уравнением (2). Затем на основе линейных зависимостей между XB и X , а также XC и X определяют брутто константы 

Нетрудно показать, что для трех параллельных реакций первого порядка


Этот случай более сложен по сравнению с предыдущим. Рассмотрим систему параллельных реакций
Уравнение скорости расхода A в этой системе реакций с учетом его количества, прореагировавшего к моменту времени t (Х) имеет вид:
или с учетом преобразований
обозначая 
Разделяя переменные, приходим к выражению
Интегрируем левую часть уравнения (3) методом неопределенных коэффициентов, для чего представим левую её часть в виде суммы дробей.

так как 

Тогда 
Откуда 

С учетом (4) возвращаемся к уравнению (3)
Интегрирование уравнения (5) приводит к выражению
Откуда
или
Возвращаясь к соотношению 
Рассмотрим систему двух последовательных реакций первого порядка
В силу принципа независимости скорости расходования реагента A выражается уравнением скорости необратимой реакции первого порядка
Решение которого дается в виде


Уравнение скорости изменения концентрации промежуточных продуктов
Разделим почленно левые и правые части уравнений (3) и (1)
Уравнение (4) имеет признаки однородного уравнения первого порядка. Для его решения вводим обозначение
Подставляя последнее выражение в уравнение (4), имеем:
Разделяем переменные и интегрируем
и
тогда
и
или
Так как 
В тоже время в соответствии с уравнением (2)
Тогда уравнение (5) можно преобразовать в форму
Выведенные зависимости показывают, что в случае необратимых последовательных реакций уравнение для первого промежуточного продукта связано с характеристиками лишь первых двух стадий, оставаясь одинаковым при любом числе и характеристиках последующих стадий. При этом независимо от начальной концентрации реагента A , значение второй характеристики материального баланса 
Используя уравнение (5) можно найти 
Из анализа уравнения (6) следует, что при XA = 0 и XA = 1 

откуда
и значение максимума
Из выражений (8) и (9) видно, что положение и величина максимума промежуточного продукта в необратимых реакциях первого порядка зависит только от соотношения констант скоростей первых двух стадий. При этом, чем больше величина 

Уравнение образования продукта C :
Максимальная скорость 
Легко видеть, что это условие соответствует одновременно условию максимума концентрации B , определяемого уравнениями(8) и (9). Качественно проанализированные зависимости могут быть представлены графически.
Неэлементарные реакции состоят из ряда элементарных стадий, составляющих их механизм. Кинетика таких реакций определяется последовательностью элементарных стадий, их характером (обратимые, необратимые), природой реагентов, интермедиатов и продуктов реакции. При кинетическом анализе неэлементарных реакций возникает задача определения концентраций интермедиатов, играющих ключевую роль в образовании продуктов или расходовании реагентов. В качестве инструмента такого определения используется принцип квазистационарных концентраций Боденштейна – Семенова. Согласно этому принципу скорость изменения концентраций нестабильных интермедиатов пренебрежимо мала по сравнению со скоростью изменения концентраций реагентов и продуктов реакции и её можно считать равной нулю. Применение принципа стационарных концентраций к неэлементарным реакциям, протекающим по сложному механизму, позволяет исключить из кинетического описания процессов неизвестные концентрации интермедиатов и получить одно или некоторый минимум дифференциальных уравнений скорости, выраженных через подлежащие измерению концентрации реагентов и продуктов реакции.
Рассмотрим пример неэлементарной реакции, описываемой стехиометрией
и протекающей через образование интермедиата Q
Скорость реакции можно приравнять к скорости образования продукта B
В соответствии с принципом квазистационарных концентраций
откуда
Подставляя последнее выражение в уравнение (1) приходим к уравнению скорости реакции
Если экспериментально возможно непосредственно измерить скорость реакции, то обработку кинетических данных можно провести, преобразуя уравнение (3) как:
Последнее уравнение приводится к виду
Обрабатывая зависимость (4) в координатах 

Химическая кинетика и равновесие. Принцип Ле Шателье
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Химическая кинетика и равновесие
- 6.1. Понятие о скорости химических реакций
- 6.2. Зависимость скорости реакции от концентрации реагентов
- 6.3.Влияние температуры на скорость реакции
- 6.4. Энергия активации
- 6.5. Понятие о катализе и катализаторах
- 6.6. Химическое равновесие. Принцип Ле Шателье
Кинетика — учение о скорости различных процессов, в том числе химических реакций. Критерием принципиальной осуществимости реакций является неравенство ∆Gp.T. 0 298 H2O (u) = – 228,59 кДж/моль, a ∆G 0 298 АlI3(к) = -313,8 кДж/моль и, следовательно, при T = 298 К и р= 1,013.10 5 Па возможны реакции, идущие по уравнениям:
Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платина для первой и вода для второй). Катализатор как бы снимает кинетический «тормоз» и проявляется термодинамическая природа вещества.
6.1. Понятие о скорости химических реакций. Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (в случае гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенной реакции). Скорость реакции обычно характеризуются изменением концентрации какого-либо из исходных или конечных продуктов реакции в единицу времени и чаще всего выражают в моль/л · с.
Различают среднюю скорость химической реакции за данный промежуток времени и истинную скорость реакции в данный момент времени. Если в момент времени концентрация вещества была C1, а для момента она стала C2, то средняя скорость реакции для интервала времени τ2 – τ1 будет равна
Знак минус пишут в том случае, если концентрация вещества во времени уменьшается (исходное вещество), а знак плюс – если концентрация увеличивается (продукт реакции). Скорость реакции всегда положительна. Истинная скорость в данный момент определяется пределом, к которому стремится выражение при ∆τ → 0, т.е. первой производной от концентрации по времени:
Измерить среднюю и истинную скорость химической реакции можно, найдя зависимость изменения концентрации реагирующих веществ в системе от времени.
Об изменении концентрации веществ в системе можно судить или непосредственно, или определяя какое-либо свойство реакционной системы. Это может быть вес осадка, образующегося в ходе реакции, объем реакционной системы, давление, цвет, электропроводность и т.п.
Скорость химических реакций зависит от многих факторов, основные из которых — концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе.
6.2. Зависимость скорости реакции от концентрации реагентов. Чтобы атом и молекулы смогли вступить в реакцию, необходимо их столкновение друг с другом, так как силы химического взаимодействия действуют только на очень малом расстоянии. Чем больше молекул реагирующих веществ в единице объема, т.е. чем больше их концентрация, тем чаще будут происходить столкновения и тем быстрее будут идти химические реакции. Поэтому увеличение концентрации реагирующих веществ ускоряет ход химической реакции. На основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакций от концентрации реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для реакции, протекающей по уравнению А + В = С + Д, этот закон выразится уравнением:
где: СА и СВ – молярные концентрации вещества А и В;
k – коэффициент пропорциональности, называемой константой скорости реакции.
Основной закон химической кинетики часто называют законом действующих масс. Из уравнения (1) нетрудно установить физический смысл константы скорости k; она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1моль/л или когда их произведение равно единице.
Следует иметь в виду, что понятие скорости реакции относится к данной реакции, а не к отдельным реагирующим веществам. Очевидно, что для каждой реакции при постоянной температуре ее константа скорости будет величиной постоянной, и, следовательно, зная k , можно сравнивать скорости химического взаимодействия различных веществ: чем больше k , тем быстрее реагируют данные вещества. Константа скорости реакции зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентрации вещества.
Уравнение (1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Для реакции, записанной в общем виде , кинетическим уравнением будет
где: m и n – коэффициенты в уравнении реакции.
Уравнение (2) является общим алгебраическим выражением закона действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам соответствующих веществ в уравнении реакции.
Основной закон химической кинетики не учитывает концентрации реагирующих веществ в твердом состоянии, ибо их концентрации постоянны и они реагируют лишь на поверхности, которая остается неизменной. Так, например, для реакции горения угля кинетическое уравнение реакции имеет вид:
где: k – константа скорости;
СС – концентрация твердого вещества;
S – площадь поверхности.
Это величины постоянные. Обозначим произведение постоянных величин через k 1 , получим т.е. скорость реакции пропорциональна только концентрации кислорода.
6.3.Влияние температуры на скорость реакции. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением
где: – скорости реакции соответственно при началом (t1) и конечной (t2) температурах;
γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличится скорость реакции с повышением температуры реагирующих веществ на 10 градусов.
Дадим иную формулировку уравнения (1). Примем скорость реакции при начальной температуре (например, при 300 ° С) за 1 и будем выражать с помощью уравнения (1) скорость реакции , определяя ее для разных температур (с интервалом в 10 ° ). Тогда получим:
Из этого легко вывести следующее правило: при повышении температуры в арифметической прогрессии скорость реакции возрастает в геометрической прогрессии.
Температура влияет на скорость реакции, увеличивая константу скорости. Отношение, показывающее, во сколько раз увеличилась константа скорости при увеличении температуры на 10 ° , называется температурным коэффициентом скорости реакции, т.е.
Зависимость скорости реакции от температуры более точно выражается уравнением Аррениуса
6.4. Энергия активации. Быстрое изменение скорости реакции с изменением температуры объясняет теория активации. Почему нагревание вызывает столь значительное ускорение химических превращений? Для ответа на этот вопрос нужно вспомнить, в чем заключается сущность химической реакции.
Химическое превращение происходит тогда, когда возникают условия для перераспределения электронной плотности столкнувшихся частиц. Этот процесс требует затраты времени и энергии. Мгновенных процессов в природе вообще не существует.
Реакционно-способную систему можно охарактеризовать тремя последовательно совершающимися состояниями:
[начальное] → [переходное] → [конечное]
Для реакции взаимодействия газообразных веществ A2 и B2:
можно записать ее состояние
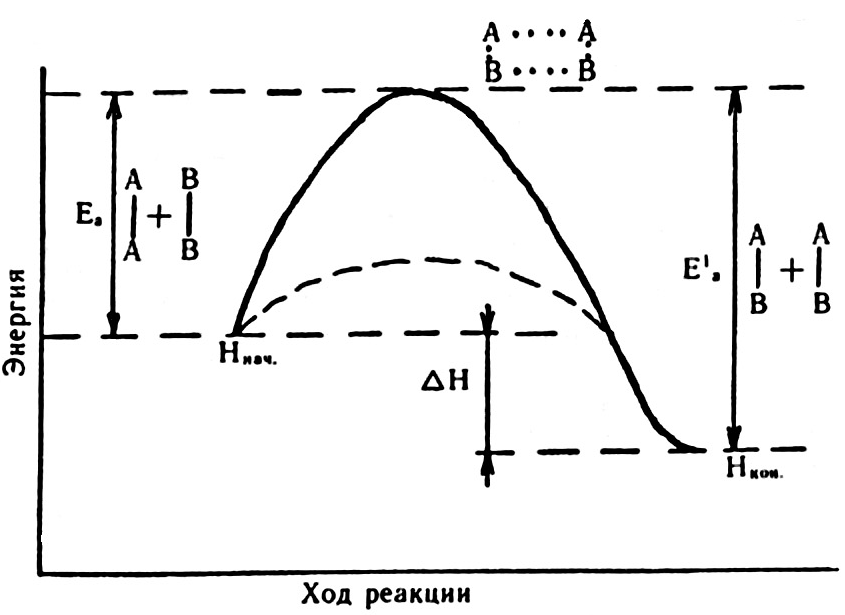
Рис. 22. Изменение энергии реагирующей системы
Переходное состояние системы отвечает образованию так называемого активированного комплекса (A2B2). В этом комплексе происходит перераспределение электронной плотности между атомами: связи A―B начинают образовываться одновременно с разрывом связей A―A и B―B. В активированном комплексе как бы объединены «полуразрушенные» молекулы A2 и B2 и «полуобразовавшиеся» молекулы AB. Активированный комплекс существует очень короткое время (порядка 10 -13 с). Его распад приводит к образованию молекул AB либо молекул A2 и B2. Образование активированного комплекса требует затраты энергии. Вероятность того, что при столкновении двух молекул образуется активированный комплекс и произойдет реакция, зависит от энергии сталкивающихся частиц. Реагируют только те из молекул, энергия которых для этого достаточна. Такие молекулы называют активными. Необходимую для перехода веществ в состояние активированного комплекса энергию называют энергией активации (Eа). Ее определяют опытным путем и обычно выражают в кДж/моль. Так, например, для соединения водорода и йода Eа = 167,4кДж/моль, а для распада йодоводорода Eа = 186,2кДж/моль.
Энергия активации зависит от природы реагирующих веществ и служит характеристикой каждой реакции.
Энергетические изменения в реагирующей системе можно представить схемой, которая изображена на рис. 22.
Здесь ось абсцесс характеризует ход реакции: исходное состояние → переходное состояние → конечное состояние. По оси ординат отложена потенциальная энергия системы. Исходное состояние имеет энергию Hнач., конечное – Hкон. Разность энергий начального и конечного состояний системы равна тепловому эффекту реакции ∆H:
Энергия активированного комплекса выше энергии начального и конечного состояний системы. Таким образом, энергия активации – это своеобразный энергетический барьер, который отделяет исходные вещества от продуктов реакции.
Обратная реакция – превращение АВ в газообразные A2 и B2, естественно, также протекает через образование активированного комплекса A2B2. но величина энергии активации в этом случае иная, чем при синтезе АВ.
Как видно из рис. 22, затраченная на активацию молекул энергия затем, при образовании продуктов реакции, полностью или частично выделяется. Если при распаде активированного комплекса выделяется энергии больше, чем это необходимо для активирования молекул, то реакция экзотермическая, а в противном случае – эндотермическая.
Итак, скорость реакции непосредственно зависит от числа молекул, обладающих энергией, достаточной для образования активированного комплекса, а следовательно, способных к химическому превращению. Чем больше в системе активных молекул, тем скорость реакции больше. Один из путей увеличения числа активных молекул – нагревание.
6.5. Понятие о катализе и катализаторах. Катализом называется изменение скорости химических реакций в присутствии веществ – катализаторов. Катализаторы – это вещества, изменяющие скорость реакции за счет участия в промежуточном химическом взаимодействии с компонентами реакции, но восстанавливающие после каждого цикла промежуточного взаимодействия свой химический состав.
Различают положительный и отрицательный катализ. В случае положительного катализа скорость химической реакции при введении катализатора возрастает, например, получение серной кислоты или окисление аммиака в азотную кислоту с помощью платины. При отрицательном катализе, – наоборот, уменьшается, например, замедление взаимодействия раствора сульфита натрия с кислородом воздуха в присутствии этилового спирта. Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, снижающие скорость реакции, ингибиторами (механизм действия последних отличен от катализаторов).
Химические реакции, протекающие в присутствии катализаторов, называются каталитическими. На большинство химических реакций может быть оказано каталитическое воздействие. Число катализаторов велико. Их каталитическая активность весьма различна. Она определяется изменением скорости реакции, вызываемым катализатором.
Различают два вида катализа – гомогенный (однородный) и гетерогенный (неоднородный) катализ.
При гомогенном катализе реагирующие вещества и катализатор образуют однородную систему – газовую или жидкую. В этом случае между катализатором и реагирующими веществами отсутствует поверхность раздела. Примером может служить каталитическое окисление оксида серы (IV) оксидами азота в камерном способе получения серной кислоты (газовая фаза), а также действие разнообразных ферментов в биологических процессах. Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
При гетерогенном катализе реагирующие вещества и катализаторы образуют систему из разных фаз. В этом случае между катализатором и реагирующими веществами существует поверхность раздела. Обычно катализатор является твердым веществом, а реагирующие вещества – газами или жидкостями. Например, окисление аммиака (газообразная фаза) в присутствии платины (твердая фаза). Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность твердого катализатора будет зависеть и от свойств его поверхности (размера, химического состава, строения и состояния).
Действие положительных катализаторов сводится к уменьшению энергии активации реакции, другими словами, к снижению высоты энергетического барьера (см. рис. 22, пунктирная кривая).
В присутствии катализатора образуется активированный комплекс с более низким уровнем энергии, чем без него, а потому скорость реакции резко возрастает.
Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ. Так, если медленно протекающую реакцию A + B = AB вести в присутствии катализатора K, то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя непрочное промежуточное соединение:
Реакция протекает быстро, так как энергия активации этого процесса мала. Затем промежуточное соединение АК взаимодействует с другим исходным веществом, выделяя катализатор К в свободном состоянии:
Энергия активации этого процесса также мала, а потому реакция протекает с достаточной скоростью. Если теперь оба процесса, протекающие одновременно, суммировать, то получим окончательное уравнение уже быстро протекающей реакции:
Поверхность катализатора неоднородна. На ней имеются так называемые активные центры, на которых, главным образом, и протекают каталитические реакции. Реагирующие вещества адсорбируются на этих центрах, в результате чего увеличивается концентрация их на поверхности катализатора. Это отчасти приводит к ускорению реакции. Но главной причиной возрастания скорости реакции является сильное повышение химической активности адсорбированных молекул. Под действием катализатора у адсорбированных молекул ослабляются связи между атомами и они делаются более реакционноспособными. В этом случае реакция ускоряется благодаря снижению энергии активации (в том числе за счет образования поверхностных промежуточных соединений).
Некоторые вещества снижают или полностью уничтожают активность твердого катализатора. Такие вещества называются каталитическими ядами.
В качестве примера можно привести соединения мышьяка, ртути, свинца, цианиды, к которым особенно чувствительны платиновые катализаторы.
Однако имеются и такие вещества, которые усиливают действие катализаторов данной реакции, хотя сами катализаторами не являются. Эти вещества называются промоторами (например, промотирование платиновых катализаторов добавками железами, алюминия и др.).
Следует особо отметить, что действие катализаторов избирательно, поэтому применяя разные катализаторы, можно получить из одного и того же вещества разные продукты. Для каждой реакции имеется свой наилучший катализатор.
Роль катализаторов в химическом производстве исключительно велика. (например, получение серной кислоты, синтез аммиака, получение из твердого угля жидкого топлива, переработка нефти и природного газа, получение искусственного каучука и т.д.). Большая роль принадлежит биологическим катализаторам – ферментам– особым веществам животного или растительного происхождения, являющихся белками. Они обладают каталитическим действием по отношению к некоторым биохимическим реакциям за счет понижения их очередной инактивации.
6.6. Химическое равновесие. Принцип Ле Шателье. Реакции, которые протекают в одном направлении и идут до конца, называются необратимыми. Их не так много. Большинство реакций являются обратимыми, т.е. они протекают в противоположных направлениях и не идут до конца. Например, реакция J2 + H2 2HJ при 350°С является типичной обратимой реакцией. В этом случае устанавливается подвижное химическое равновесие и скорости прямого процесса и обратного делаются равными.
Химическое равновесие – такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
Химическое равновесие называют динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно.
Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными концентрациями. Обычно их обозначают при помощи квадратных скобок, например, [J2], [H2], [HJ] в отличие от неравновесных, обозначаемых СJ2, Cн2, СнJ
Количественной характеристикой химического равновесия служит величина, называемая константной химического равновесия. Изобразим обратимую реакцию в общем виде:
Согласно закону действующих масс, скорости прямой (V1) и обратной (V2) реакций выражаются уравнениями:
При равновесии скорости прямой и обратной реакций равны друг другу, откуда
Но k1 и k2 для данной реакции при одной и той же температуре являются величинами постоянными, а значит, и их отношение будет величиной постоянной. Обозначим его через К, получим
где: К – константа химического равновесия.
Она зависит от температуры и природы реагирующих веществ, но не зависит от их концентрации. Константа равновесия показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции, если концентрации каждого из реагирующих веществ равна 1 моль/л. В этом физический смысл К. Значения К находят путем расчета или на основании экспериментальных данных. Константа равновесия – важная характеристика реакции. По ее значению можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
На состояние химического равновесия оказывает влияние концентрация реагирующих веществ, температура, а для газообразных веществ – и давление.
При изменении одного из этих параметров равновесие нарушается, и концентрация всех реагирующих веществ будет изменяться до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций.
Подобный переход реакционной системы из одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия. Если при изменении условий увеличивается концентрация конечных веществ, то говорят о смещении равновесия вправо. Если же увеличивается концентрация исходных веществ, то равновесие смещается влево.
Направление смещения химического равновесия при изменениях концентрации реагирующих веществ, температуры и давления (в случае газовых реакций) определяется общим положением, известным под названием принципа подвижного равновесия или принципа Ле Шателье: если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяется концентрация, температура, давление), то оно благоприятствует протеканию одной из двух противоположных реакций, которая ослабляет воздействие. Поясним это правило на примере синтеза аммиака:
Если увеличить концентрации азота или водорода, то это будет благоприятствовать реакции, протекающей с уменьшением концентрации этих веществ, т.е. равновесие сместится вправо. Наоборот, при увеличении концентрации аммиака равновесие сместится влево.
Поскольку прямая реакция протекает с выделением тепла, то повышение температуры будет благоприятствовать реакции с поглощением тепла, т.е. равновесие будет смещаться влево. Наоборот, понижение температуры вызовет смещение равновесия вправо.
Чтобы решить вопрос, как влияет на смещение равновесия изменение давления, надо подсчитать число молей газообразных веществ в левой и правой частях уравнения. В приведенном примере в левой части уравнения содержится 4 моль (4 объема), а в правой – 2 моль (2 объема). Поскольку увеличение давления должно благоприятствовать процессу, ведущему к уменьшению объема, то в данном случае равновесие сместится вправо. Уменьшение давления сместит равновесие влево. Если же в уравнении обратимой реакции число молей в левой части равно числу молей в правой части, то изменение давления не вызывает смещения химического равновесия.
Следует отметить, что все катализаторы одинаково ускоряют как прямую, так и обратную реакции и поэтому на смещение равновесия влияние не оказывают, а только способствуют более быстрому его достижению.
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе
если объем газовой смеси уменьшится в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [SO2] = а,
[О2] =b, [SO3] == с. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объема равны
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а, [О2] = Зb; [SO3] = Зс. При новых концентрациях скорости v’пр прямой и обратной реакций:
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной — только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70° С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
Следовательно, скорость реакции vT2. при 70 0 С больше скорости реакции vT1 при 30° С в 16 раз.
Пример 3. Константа равновесия гомогенной системы
при 850 0 С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СO]исх = 3 моль/л, [H2O]иcx = 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
В условии задачи даны исходные концентрации, тогда как в выражение Кр входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [CO2]p = x моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и H2O расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ (моль/л):
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:
Таким образом, искомые равновесные концентрации: [СO2]р = 1,2 моль/л; [H2]p = 1,2 моль/л; [СO]р= 3-1,2 = 1,8 моль/л; [Н2O]р =2-1,2 =0,8 моль/л.
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РС15?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения РС15 эндотермическая (H > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру: б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РС15, так и уменьшением концентрации РС13 или Сl2.
http://farmf.ru/lekcii/himicheskaya-kinetika-i-ravnovesie-printsip-le-shatele/