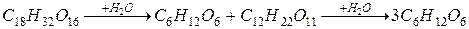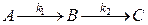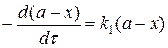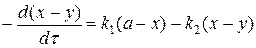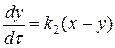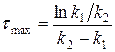Кинетические кривые для последовательных реакций.
КИНЕТИКА ПОСЛЕДОВАТЕЛЬНЫХ РЕАКЦИЙ.
Последовательныминазываются реакции, состоящие из нескольких стадий, следующих друг за другом, например, гидролиз трисахаридов в кислой среде:
Рассмотрим реакцию, состоящую из двух мономолекулярных стадий:
Вещество В в данной реакции является промежуточным веществом.
Обозначим через а – начальную концентрацию вещества А ( 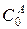
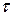
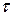
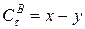
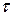
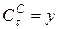
Напишем кинетические уравнения последовательной реакции.
Скорость реакции по изменению концентрации реагента А запишется (I ступень):
Скорость реакции по изменению концентрации реагента В (II ступень) запишется:
Скорость реакции по приросту концентрации реагента С (III ступень) запишется:
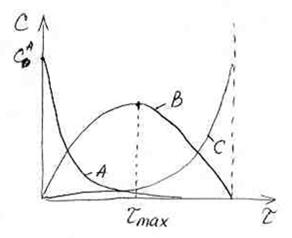
Кинетические кривые для последовательных реакций.
Концентрация вещества А с течением времени плавно уменьшается до нуля, что отображает кинетическая кривая для реагента А.
Концентрация реагента С в ходе реакции плавно возрастает, пока не достигнет своего максимального значения, что также отображается ходом кинетической кривой для данного реагента.
Кинетическая кривая для реагента В имеет максимум. Он обусловлен тем, что в начале процесса, пока концентрация вещества А достаточна большая, расходование вещества В компенсируется расходованием вещества А. На кинетической кривой – рост. Когда вещества А становится очень мало, то оно уже не может компенсировать расход вещества В на II ступени, поэтому на кинетической кривой наблюдается спад.
Время, за которое достигается максимальное значение концентрации вещества В, называют 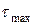
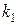
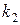
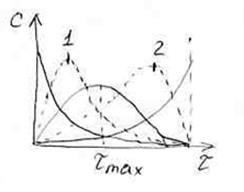
Рассмотрим два случая относительно разности значений констант скоростей 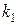
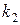
1. Когда скорость первой стадии намного больше скорости второй стадии: 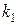
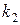
В этом случае достижение максимальной концентрации промежуточного вещества В происходит быстро. Максимум, соответствующий 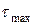
2.Когда скорость первой стадии намного меньше скорости второй стадии:
Дата добавления: 2019-10-16 ; просмотров: 728 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ