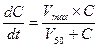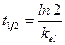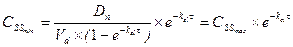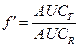Кинетика элиминации первого и нулевого порядка
После введения лекарства в организм, его концентрация в крови вначале возрастает от нуля до некоторого уровня (при внутривенном введении это происходит практически мгновенно), а затем начинает снижаться, вследствие процессов элиминации и распределения.
Поскольку процесс элиминации лекарства носит вид ферментативной реакции (в случае его биотрансформации) или простого массопереноса (в случае экскреции), то очевидно, что он подчиняется законам химической кинетики и описывается классическим уравнением Михаэлиса-Ментен:
При этом, фактически, при введении в организм лекарственного средства возникают 2 возможные ситуации:
· Если уровень концентрации лекарства в организме (С) значительно меньше, чем величина его полумаксимальной скорости элиминации (V50), т.е. С — kt .
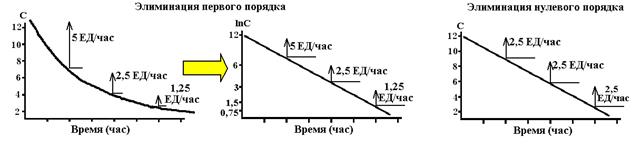
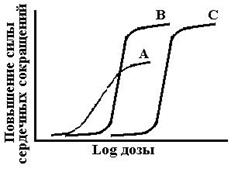
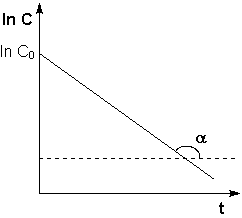
Таким образом, кинетикой элиминации первого порядка называют такой вид элиминации лекарства, при котором скорость удаления лекарственного вещества из крови пропорциональна его концентрации в организме и в единицу времени элиминируется постоянная доля (фракция) лекарства. График кинетики элиминации первого порядка имеет вид экспоненциальной кривой и может быть линеаризован в полулогарифмических координатах.
Большинство современных лекарств элиминируется кинетикой первого порядка.
· Если уровень концентрации лекарства в организме значительно превышает полумаксимальную скорость его элиминации (C>>V50), то уравнение сводится к виду:
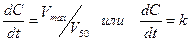
Это дифференциальное уравнение нулевого порядка, поэтому такой вид кинетики называют кинетикой элиминации нулевого порядка. Данное уравнение показывает, что скорость элиминации лекарства является величиной постоянной и не зависит от его концентрации в организме. Решая уравнение можно найти, что С=С0-kt.
Таким образом, кинетикой элиминации нулевого порядка называют такой вид элиминации, при котором скорость удаления лекарственного вещества из организма постоянна и в единицу времени элиминируется постоянное количество лекарственного вещества. График кинетики нулевого порядка имеет вид прямой линии в обычных координатах.
Кинетика элиминации нулевого порядка встречается относительно редко:
[ При инфузионном капельном введении лекарственного средства с постоянной скоростью. В этом случае она описывает фазу поступления лекарства.
[ При абсорбции лекарства из депо-форм (лекарственные формы продленного действия), которая протекает также с постоянной скоростью.
[ При насыщаемом метаболизме, т.е. в тех случаях, когда вводимая доза лекарства превышает возможности ферментов метаболизма по утилизации лекарственного средства. Такая ситуация возникает при введении высоких доз этанола, ацетилсалициловой кислоты, фенитоина.
Схема 9. Типичные формы фармакокинетических кривых при различных вариантах кинетики. Слева представлена кривая элиминации лекарства в соответствии с кинетикой первого порядка. В центре – та же кривая после преобразования оси концентраций в логарифмическую форму. Справа представлена кривая кинетики нулевого порядка.
1. Элиминация первого порядка. Термин «первого порядка» обозначает, что скорость элиминации пропорциональна концентрации вещества, то есть, чем выше концентрация тем выше количество вещества, которое элиминируется в единицу времени. В результате концентрация лекарства в плазме снижается во времени экспоненциально (см. рис. 1-5, слева). Лекарственные средства с элиминацией первого порядка характеризуются постоянной величиной периода полуэлиминации, независимо от содержания вещества в организме. Концентрация такого лекарства в крови за каждый период полусуществования будет понижаться на 50%. Большинство лекарств, при клиническом применении, обладают кинетикой первого порядка.
Элиминация нулевого порядка. Термин «нулевой порядок» обозначает, что скорость элиминации постоянна и не зависит от концентрации вещества (см. рис. 1-5, справа). Механизмы элиминации некоторых веществ являются насыщенными уже при низких концентрациях этих соединений. Как результат этого, концентрация таких лекарств в плазме понижается линейно во времени. Это характерно для этанола (при широком диапазоне его концентраций в организме) и фенитоина, а также для аспирина при высоких терапевтических или токсических концентрацях.
Основной целью лекарственной терапии является обеспечение в организме терапевтического уровня лекарства. Для этого используют введение вначале нагрузочной, а затем – поддерживающих доз лекарства. Напомним формулы для расчета этих доз:
При непрерывном внутрисосудистом введении между поддерживающей и нагрузочной дозами (скоростями введения) существует следующая зависимость:
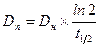
Период полуэлиминации (t½, мин -1 ) – это время, необходимое для снижения концентрации лекарственного вещества в крови ровно наполовину. При этом не играет роли каким путем достигается снижение концентрации – при помощи биотрансформации, экскреции или же за счет сочетания обоих процессов. Обычно период полуэлиминации определяют из соотношения:
Все три показателя Vd, Cl и t½ связаны между собой следующими соотношениями:
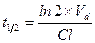
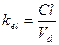
Концентрация лекарственного средства в плазме крови, которая достигается при условии, что скорость введения лекарства в организм уравновешивает скорость его выведения получила название стационарной концентрации лекарственного вещества(СSS). Из уравнения:
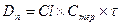
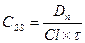
Таким образом, величина CSS прямо пропорциональна вводимой дозе и обратно пропорциональна интервалу между введениями лекарства. Поскольку лекарственное вещество вводится через дискретные интервалы времени, то очевидно, что величина СSS не будет постоянной, а начнет колебаться в каком-то диапазоне от максимального уровня (вскоре после введения лекарства) до минимального уровня перед очередным приемом лекарства. Эти границы колебаний не трудно рассчитать, они составляют:

Различают 3 вида эквивалентности:
[ Химическая (фармацевтическая) эквивалентность – означает, что 2 лекарственных препарата содержат одно и то же лекарственное вещество в равных количествах и в соответствии с действующими стандартами. При этом неактивные ингридиенты лекарственных препаратов могут различаться.
[ Биоэквивалентность – означает, что два химически эквивалентных лекарственных препарата различных производителей при введении в организм человека в равных дозах и по одинаковой схеме всасываются и поступают в системный кровоток в равной степени, т.е. обладают сопоставимыми показателями биодоступности.
[ Терапевтическая эквивалентность. Данное понятие означает, что 2 лекарственных препарата, содержащих одно и то же лекарственное средство, которые применяют в равных дозах и по одинаковой схеме вызывают сопоставимый терапевтический эффект. Терапевтическая эквивалентность не зависит от биоэквивалентности лекарственных препаратов. Два препарата могут быть биологически эквивалентны, но при этом иметь разную терапевтическую эквивалентность.
Основным критерием биоэквивалентности является отношение площадей под фармакокинетической кривой для двух изучаемых лекарственных средств, а также отношение максимальных концентраций этих лекарств в крови пациента:
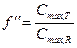
Считают, что допустимыми колебаниями этих параметров является диапазон 0,8-1,2 (т.е. биодоступность двух сравниваемых лекарств не должна различаться более чем на 20%).
Цитоплазматические рецепторы. Находятся в цитозоле клетки. Лиганд рецептора (липофильное вещество) проникает через ее мембрану и связывается с рецептором. В покое эти рецепторы экранированы особым белком теплового шока (hsp-белок). При связывании с лигандом рецептор освобождает этот белок и образует пары с другими рецепторами данного семейства. Затем, активированный рецептор поступает в ядро клетки, где связывается с особыми рецепторными последовательностями нуклеотидов ДНК и регулирует экспрессию генов. К данному семейству относятся рецепторы для стероидных гормонов, витаминов А и D, тиреоидных гормонов.
Трансмембранные рецепторы, связанные с ионными каналами. Представляют собой белки, которые формируют в мембране ионный канал. При взаимодействии лиганда с рецепторной субъединицей белка проницаемость ионного канала меняется. К данной группе рецепторов относят:
] Н-холинорецепторы, связанные с Na + -каналами. При взаимодействии с ацетилхолином рецептор открывает натриевый канал и под влиянием тока ионов натрия в клетку возникает деполяризация мембраны и генерируется потенциал действия.
] ГАМКА-рецепторы, которые связаны с Cl — -каналами. При взаимодействии с g-аминомасляной кислотой рецептор открывает канал и обеспечивает поступление в клетку ионов хлора. Возникает гиперполяризация мембраны и переход ее в состояние покоя.
Трансмембранные рецепторы, связанные с G-белками. Эти рецепторы состоят из 3 субъединиц. Рецепторный белок располагается на наружной стороне мембраны. При взаимодействии с лигандом он передает сигнал на внутримембранный G-белок, который за счет энергии ГТФ перемещается к внутренней стороне мембраны и изменяет активность эффекторных белков. Эффекторные белки расположены на внутренней стороне мембраны и представляют собой ферменты, которые образуют «вторичные мессенджеры» – молекулы-посредники, которые передают сигнал в клетку и вызывают развитие ответной реакции. В качестве эффекторных белков выступают:
] Аденилатциклаза – это фермент, который гидролизует АТФ с образованием циклического АМФ
] Гуанилатциклаза – это фермент, который гидролизует ГТФ с образованием цГМФ. Молекула цГМФ активирует в клетке цГМФ-зависимые протеинкиназы, которые также фосфорилируют белки.
Трансмембранные рецепторы-ферменты. Данный вид рецепторов представлен молекулами, состоящими из 2 субъединиц. Рецепторная субъединица располагается с наружной стороны мембраны, а каталитическая (т.е. обладающая ферментативногй активностью) – прошивает мембрану клетки насквозь. При взаимодействии с лигандом рецепторная субъединица активирует каталитическую часть молекулы. В качестве каталитической субъединицы выступают:
] Тирозинкиназы – ферменты, которые фосфорилируют остатки тирозина в молекулах белков. К такому типу рецепторов относится инсулиновый рецептор.
] Серин-треонинкиназы – ферменты, которые фосфорилируют остатки серина и треонина в молекулах белков. К такому типу относят некоторые из интерлейкиновых рецепторов.
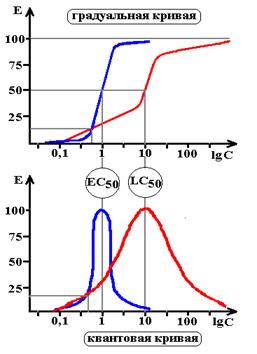
Градуальные кривые зависимости «доза-эффект». А – зависимость изменения частоты сердечных сокращений от дозы лекарства в нормальных координатах, В – та же кривая в полулогарифмических координатах (одна из шкал переведена в форму десятичных логарифмов), С – кривая связывания того же вещества с рецепторами миокарда.
Emax – максимальный эффект, Bmax – максимальное число связанных рецепторов, ЕС50 – концентрация лекарства при которой возникает эффект равный половине максимального, Kd – константа диссоциации вещества от рецептора, при которой связано 50% рецепторов.
Схема 4. Сравнительная характеристика кардиотонических средств. Как следует из представленных графиков EC50,A
Молекулярность реакции. Порядок реакции Уравнение кинетики реакций 1-го, 2-го и нулевого порядка. Период полупревращений.
Молекулярность и порядок реакцииПри изучении реакций выделяют молекулярность и порядок реакции.Молекулярность реакции — это число молекул исходных веществ, принимающих участие в одном (единичном) химическом превращении. При этом число молекул образующихся продуктов не имеет значения. В соответствии с приведенным определением различают реакции:
1) мономолекулярные, в которых только один вид молекул участвует в превращении, причем стехиометрический коэффициент в уравнении равен единице, например,запись А > С означает, что молекула вещества А превращается в молекулу вещества С;
2) бимолекулярные, в которых участвуют два различных вида молекул или две молекулы одного вида (стехиометрический коэффициент во втором случае равен двум), например, А + В>С или 2А > С;
3) тримолекулярные, в которых участвуют три молекулы одного или разного видов, например,
А + В + D > С или 2 А + В > С, или 3А>С.
Реакции более высокой молекулярности маловероятны. Связано это с причиной, о которой говорилось ранее. Выше было сказано, что порядок химической реакции выражаетсяс уммой:
где аi — показатели степени концентрации исходных веществ в уравнении действующих масс.
Они приравнивались стехиометрическим коэффициентам компонентов химической реакции. Исходя из этого можно сделать заключение, что молекулярность и порядок реакции это одинаковые величины. Однако, это не всегда так. Порядок реакции или равен молекулярности или, в большинстве случаев, меньше её. Расхождение между порядком реакции и её молеклярностью может быть вызвано разными причинами.
1. Молекулярность реакции величина теоретическая, а порядок реакции — экспериментальная. Между теоретическими и экспериментальными величинами почти всегда есть различия.
2. Если, например, в реакции bB + dD = P,скорость которой W = КСBbCD d
один из компонентов, например, компонент B, находится в избытке, то в ходе данной реакции его концентрация будет изменяться незначительно и в уравнении скорости реакции можно принять СB = const. Но в таком случае скорость реакции практически зависит от концентрации только компонента D, то есть W = К1CD d тогда порядок реакции равен d, а молекулярность реакции (b + d).
3. Если данная реакция является гетерогенной, то в зависимости от условий протекания порядок такой реакции может быть различным.
4. Порядок каталитической реакции также может отличаться от молекулярности, причина — сложный механизм таких реакций.
5. Для сложной реакции, протекающей в несколько стадий, порядок реакции и её молекулярность не совпадают. В данном случае порядок реакции определяет какая-либо промежуточная (лимитирующая) стадия. Как правило порядок этой стадии отличается от молекулярности сложной реакции.
В качестве критерия скорости реакции нередко используется период полупревращения t1/2 , равный времени, в течение которого концентрация реагента уменьшается вдвое по сравнению с начальной концентрацией.
Первый порядок имеют реакции диссоциации или разложения молекул Н2 → 2Н; радиоактивного распада 22286Rn →4 2α +21882Rn (радон).
Для реакций первого порядка кинетическое уравнение имеет вид- dС/ dt = k1 С.
Разделяя переменные — dС/С = k1 dt и интегрируя полученное уравнение, находят ∫СС0 -dС/С = (integ)0t k1 dt, находят -(lnС – lnС0) = k1t
lnС = lnС0 – k1 t ; С = С0exp(-k1 t)
реакции первого порядка имеют особенности:
— график зависимости lnС от t выражается прямой линией. Это значит, что в полулогарифмических координатах, при разных начальных концентрациях прямые будут параллельны между собой;
-концентрация исходного вещества стремится к нулю при t-> oo. Полностью
вещество реагирует за бесконечно большой промежуток времени;
—скорость реакции также отличается экспоненциальной зависимостью r = k1С0e- k1 t
-размерность константы скорости реакции первого порядка соответствует обратному времени и ее можно выразить в обратных секундах, минутах, часах и т.д;
—время полупревращения при С = С0/2
t1/2 = ln2 /k, т.е. не зависит от начальной концентрации реагирующего вещества;
—кинетическая кривая реакции первого порядка инвариантна при линейном преобразовании концентрации (график имеет вид верхней части равносторонней гиперболы стр 249). Примеры реакций второго порядка : Н2 + I2 ->2НI ; или 2NО 2->2NО + О2
если в реакции участвуют два компонента, концентрации которых равны, то дифференциальное уравнение имеет вид — dС/dt = k2 С × С. (или С2)
Разделение переменных и интегрирование в пределах от Со до С приводит к следующему результату:
1/С — 1/С0 = k2 t
из уравнения следует, что концентрация исходных веществ зависит от времени следующим образом:
С = С0 / (1+ k2 С0 t)
Полученные уравнения позволяют отметить следующие особенности реакций второго порядка:
-при равенстве начальных концентраций реагирующих веществ обратная концентрация линейно зависит от времени (стр 251) 1/С = 1/С0 + k2 t
—константа скорости k2 = (1/ t) ( 1 /С — 1 /С0) = (1/t) (С0 – С) /СС0 где k – л моль-1 с-1
—время полупревращения при С=С0 /2
(1 /С0 /2) – (1 /С0) = k2 t1 /2 отсюда t1/2 = 1 / (k2 С0)
в отличие от реакций первого порядка время полупревращения реакций второго порядка обратно пропорционально начальной концентрациНулевой порядок имеет место в тех случаях, когда убыль вещества в результате протекания химической реакции восполняется доставкой его из другой фазы. Нулевой порядок наблюдается если скорость процесса лимитируется подачей энергии, необходимой для активации реагирующих молекул. Например, при фотохимических реакциях определяющим фактором может служить количество поглощенного излучения, а не концентрация вещества. Часто в каталитических реакциях скорость зависит от концентрации катализатора, а не от концентрации реагирующих веществ.
Кинетическое уравнение для реакция нулевого порядка имеет вид: — dС/ dt = k.
Разделяя переменные (- dС= k dt ) и интегрируя в пределах от начальной концентрации Со (t =0) до текущей концентрации С в момент времени t:- ∫СС0 dС = ∫0t k dt получают С = С0 — k t реакции нулевого порядка имеют следующие особенности:
-в соответствии с последним выражением в реакциях нулевого порядка концентрация исходного вещества линейно уменьшается о времени (кинетическая кривая — линейная зависимость стр 247);
—константа скорости k = (С0 – С ) /t. Ее размерность такая же как и размерность скорости реакции;
—время полупревращения t1/2, при С = С0/2 t1/2 = С0 / 2 k, т.е. для реакции нулевого порядка t1/2 пропорционально начальной концентрации исходного вещества.
Дата добавления: 2016-01-16 ; просмотров: 2849 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Кинетическое уравнение реакции нулевого порядка имеет вид
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
2.1 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
2.1.1 Кинетическое уравнение химической реакции. Порядок реакции.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики :
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
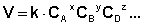
Коэффициент пропорциональности k есть константа скорости химической реакции . Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции . Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
2.1.2 Реакции нулевого порядка
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
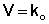
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
2.1.3 Реакции первого порядка
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А ––> В. Реакции первого порядка характеризуются кинетическим уравнением вида (II.6). Подставим в него выражение (II.2):
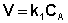
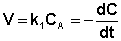
После интегрирования выражения (II.7) получаем:
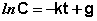
Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со. Получаем:
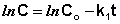
Рис. 2.3 Зависимость логарифма концентрации от времени для реакций
первого порядка
Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 2.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени.
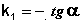
Из уравнения (II.9) легко получить выражение для константы скорости односторонней реакции первого порядка:
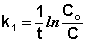
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со:
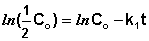
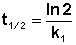
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
2.1.4 Реакции второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
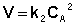
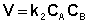
Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (II.14) или, что то же самое, в уравнении вида (II.15) концентрации исходных веществ одинаковы; уравнение (II.14) в этом случае можно переписать следующим образом:
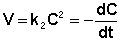
После разделения переменных и интегрирования получаем:
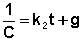
Постоянную интегрирования g, как и в предыдущем случае, определим из начальных условий. Получим:
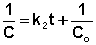
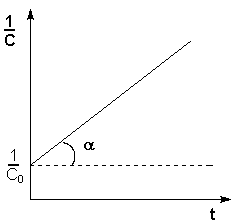
Т.о., для реакций второго порядка, имеющих кинетическое уравнение вида (II.14), характерна линейная зависимость обратной концентрации от времени (рис. 2.4) и константа скорости равна тангенсу угла наклона прямой к оси времени:
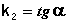
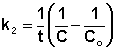
Рис. 2.4 Зависимость обратной концентрации от времени для реакций
второго порядка
Если начальные концентрации реагирующих веществ Cо,А и Cо,В различны, то константу скорости реакции находят интегрированием уравнения (II.21), в котором CА и CВ – концентрации реагирующих веществ в момент времени t от начала реакции:
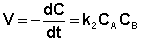
В этом случае для константы скорости получаем выражение
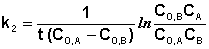
Порядок химической реакции есть формально-кинетическое понятие, физический смысл которого для элементарных (одностадийных) реакций заключается в следующем: порядок реакции равен числу одновременно изменяющихся концентраций. В случае элементарных реакций порядок реакции может быть равен сумме коэффициентов в стехиометрическом уравнении реакции; однако в общем случае порядок реакции определяется только из экспериментальных данных и зависит от условий проведения реакции. Рассмотрим в качестве примера элементарную реакцию гидролиза этилового эфира уксусной кислоты (этилацетата), кинетика которой изучается в лабораторном практикуме по физической химии:
Если проводить эту реакцию при близких концентрациях этилацетата и воды, то общий порядок реакции равен двум и кинетическое уравнение имеет следующий вид:
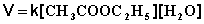
При проведении этой же реакции в условиях большого избытка одного из реагентов (воды или этилацетата) концентрация вещества, находящегося в избытке, практически не изменяется и может быть включена в константу скорости; кинетическое уравнение для двух возможных случаев принимает следующий вид:
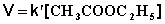
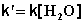
2) Избыток этилацетата:
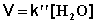
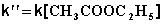
В этих случаях мы имеем дело с т.н. реакцией псевдопервого порядка . Проведение реакции при большом избытке одного из исходных веществ используется для определения частных порядков реакции.
Copyright © С. И. Левченков, 1996 — 2005.
http://helpiks.org/6-49386.html
http://physchem.chimfak.sfedu.ru/Source/PCC/Kinetics_2.htm