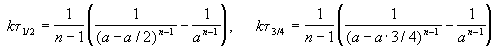Катализаторы процесса синтеза аммиака. Кинетика и механизм каталитической реакции. Колонна синтеза аммиака: устройство, потоки газа и температурный режим
Страницы работы
Содержание работы
9.Катализаторы процесса синтеза аммиака. Кинетика и механизм каталитической реакции. Колонна синтеза аммиака: устройство, потоки газа и температурный режим. Уравнение для расчета молярной теплоты реакции синтеза.
9.1. Синтез аммиака протекает с заметной скоростью только в присутствии катализатора. Скорость синтеза аммиака на железном катализаторе, активированном Al2O3 и K2O определяется ур-ем Темкина – Пыжова:
υ- скорость реакции,
k1— константа скорости образования аммиака прямой р-ции;
k2— константа скорости разложения аммиака обратной р-ции.
Заметим, что k1/k2 = K.(К-константа равновесия)
Pi— парциальные давления участников р-ции,
α – постоянная удовлетворяющая неравенству 0 0 С
Для промышленных катализаторов α=0,5 при 400-500 0 С. Значение энергии активации для промышленных кат-ров 167,5 кДж/моль. На поверхности катализатора протекают следующие промежуточные стадии:
1. N2(газ) → 2N(адсорбируются на атомы); Лимитирующей — наиболее медленной являетсяся стадия 1
2. H2(газ)→2H(адсорбируется на атомы); активированная адсорбция газообразного N2 катализатором.
3. N(адс) + H(адс)→NH(адс); Медленно протекает и стадия 3-
4. NH(адс)+ H(адс)→ NH2(адс); присоединение 1-го атома Н2 к сорбированному N.
5. NH2(адс)+ H(адс) → NH3(адс).
Катализаторы: В промышленности распространен железный катализатор (магнетит Fe3O4 сплавляют с промоторами). Катализаторы активируют восстановлением водорода. Широко используетсяся СТК марка СА-1(Fe 32-38% и Al2O3, K2O, CaO). Его выпускают в дробленом и гранулированном виде. Он предназначен для работы в колоннах синтеза при 400-500 0 С до 60 МПа и содержании в АВС кислородных соединений до 40см 3 /м 3 . При этих условиях катализатор обеспечивает стабильную работу 3-5лет. Если нет яда до 8 лет. Есть СА-2 для работы при 475-600С.
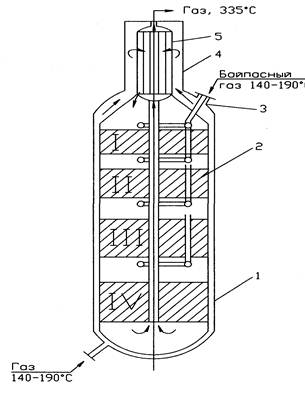
9.3.КОЛОННА (см. рис.): мощность агрегата 1360т/сут, Р = до 32Мпа. Вертикальный аппарат, состоит из нижнего и верхнего корпусов высокого давления и насадки.
1 – нижний корпус; 2 – насадка; 3 – штуцер байпасного газа; 4 – верхний корпус; 5 – трубчатый теплообменник. I-IV-полки кат-ра
Нижний корпус: внутренний диаметр = 2,4 м; толщина стенки 25см, Н = 22м.
Верх корпус: внутренний диаметр = 1м, стенка 11см, Н=6,5м.
Насадка 2 состоит из катализаторной коробки и теплообменника 5 (1920труб Ø-ром 12мм). Катализатор размещен на 4 полках, объем и масса увеличиваются по ходу движения газов.
1 полка объем катализатора 7,1м3; 2 -8,4 м3; 3 –12.8 м3; 4 –14.7 м3.
Движение газовых потоков: Перед колонной синтеза газовая смесь (3,3% об NH3) делится на 5 потоков. Основной идет вниз колонны, поднимается по кольцевому зазору (между корпусом и катализаторной коробки) и идет в межтрубное пространство теплообменника. В нем газ нагревается до 400-440 0 С за счет выходящего горячего из катализаторной коробки газа и идет в катализаторную зону на 1 полку. На полке образуетсяся NH3 из АВС. 4 другие линии служат для ввода байпасного газа перед каждой полкой, чтобы регулировать температуру р-ции синтеза. Пройдя 4 слоя катализатора газовая смесь (14-16% об. NH3), температура 480-530 0 С поток поворачивает в центральную трубу, идет вверх в трубное пр-во теплообменника, где охлаждаетсяся до 335 0 С и выходит из колонны.
Температурный режим колонны: 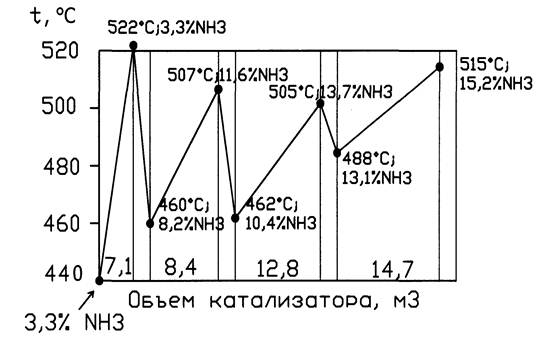
Тепловой эффект реакции синтеза NH3 зависит от температуры и давления и м.б. рассчитан по ур-ю:
где q – тепловой эффект р-ции, кДж/кмоль NH3;
Т – средняя температура в зоне катализа, К;
Р – давление в зоне катализа, МПа.
Это ур-е используется для точных расчетов, упрощенно – через энтальпии участников реакции.
38.Мультиплетная теория катализа академика А. Баландина, её основные положения применительно к реакции синтеза аммимака.
Каталитической активностью обладают участки поверхности катализатора. Теория предполагает, что в образовании поверхностного соединения участвуют группы активных атомов поверхности (мультиплеты), они обладают определенными геометрическими и энергетическими свойствами. Теория рассматривает принципы геометрического и энергетического соответствия.
Геометрическое соответствие: твердое тело м.б. гетерогенным катализатором р-ции, если расположение активных мест на его поверхности находится в геометрическом соответствии с расположением атомов в молекулах реагировавших веществ, т е расстояния между атомами на поверхности катализатора и в молекуле д.б. одинаковы.
Энергетическое соответствие: величины энергетической связи между атомами в мультиплете д.б. равны энергетической связи между атомами в реагировавших молекулах, чтобы катализатор был достаточно активен. энергетический уровень мультиплетного комплекса д. располагаться по середине между энергетическим уровнем исходных веществ и продуктов, а энергия его образования и распада д.б. минимальна.
С2Н4+Н2=С2Н6, никелевый катализатор. связь С-С =0,154 нм; Ni-Ni = 0,264. Это мультиплет комплекс, примерно то же самое с аммиаком.
Синтез аммиака
Что такое синтез аммиака
Синтез аммиака это взаимодействие азота с водородом в жестких условиях, поскольку реакция обратима весь процесс производят при нагревании до 500°, выше дает отрицательный вариант с меньшим выхода аммиака, также одним из условий синтеза повышенное давление, что хорошо сказывается на выходе NH3.
NH3 получение в лаборатории

Проверяют прибор на герметичность. Пускают ток азота и водорода, следя за тем, чтобы число пузырьков этих газов, проходящих через промывные склянки 1 и 2 с концентрированной серной кислотой, относилось как 1 :3. Скорость поступления азота и водорода регулируют с помощью кранов или зажимов от газометра и аппарата Киппа.
Проверяют полноту вытеснения воздуха из установки (поджиганием в пробирке газа, собранного у газоотводной трубки 7) и отсутствие аммиака в исходной азотоводородной смеси (лак мусом или фенолфталеином). Включают электрический ток и следят, чтобы в трубке-реакторе 3 спираль 4 с катализатором раскалилась докрасна.
Рис. Установка для синтеза аммиака:
1, 2 —промывные склянки, 3 — трубка-реактор, 4 электроспираль, 5, 7 — газоотводные трубки, 6 — дугообразная трубка.
Азотоводородная смесь, проходя над спиралью с катализатором без нагревания, не образует даже следов аммиака. Аммиак появляется, когда катализатор нагревается.
После появления окраски в дугообразной трубке 6 с фенолфталеином ее отключают и к отверстию газоотводной трубки 5 подносят стеклянную палочку, смоченную концентрированной соляной кислотой (или влажную лакмусовую бумагу красного цвета). Для окончания опыта выключают электрический ток, закрывают кран аппарата Киппа, продолжая некоторое время пропускать азот до полного удаления из аппарата водорода и охлаждения катализатора.
Синтез аммиака — обратимая экзотермическая реакция:
Для начала реакции необходимо нагревание, осуществляемое накаливанием электроспирали до красного цвета (около 400°С). (При очень сильном нагревании аммиак не образуется.) Обнаружение аммиака подтверждается следующими реакциями: а) в растворе с помощью фенолфталеина:
б) в воздухе (по образованию белого дыма в присутствии концентрированной соляной или азотной кислот):
Меры предосторожности. Водород необходимо проверить на чистоту.
В такой же реакционной трубке можно осуществить опыт разложения аммиака и обнаружить образовавшийся водород. С этой целью пропускают аммиак над нагретой спиралью с катализатором, собирают продукты разложения и испытывают их на горючесть.
Физические свойства аммиака
Горючий бесцветный газ. Мол. масса 17,03; температура кипения — 33,4 °С; плотность по воздуху 0,597; коэф. диф. газа в воздухе 0,198 см 2 /с; тепл. cгop. —316,5 кДж/моль; растворимость в воде 34,2% (масс). Т. самовоспл. 650 °С; конц. пределы распр. пл. в воздухе 15—28% (об.), в кислороде 13,5—79% (об.); миним. энергия зажигания 680 мДж; макс. давл. взрыва 588 кПа; МВСК 16,2% (об,); ад. т. гор. 1777 К; норм, скорость распр. пл. 0,23 м/с при 150 °С.
Аммиачная вода
Водный раствор аммиака, не способна к горению; над ее поверхностью возможно образование взрывоопасной смеси аммиака с воздухом. Показатели пожарной опасности приведены в табл.
Таблица . Показатели пожаровзрывоопасности аммиачной воды
| Концентрации раствора, % (масс.) | Температура самовоспламенения, °С | Температурные пределы распр. пл., °С | |
| нижний | верхний | ||
| 15 27 | >750 >750 | 23 -2 | 33 10 |
В открытых сосудах и при разливе в помещении вероятность создания взрывоопасной концентрации практически отсут.
Аммиачно водородные смеси
Горючи. В табл. 2. приведены значения конц. пределов распр, пл. по газовоздушным смесям различного состава при нормальных условиях.
Значения верхних пределов распр. шл. аммиачно водородных смесей в воздухе, обогащенном кислородом, приведены в табл. 3.
Таблица 2 . Показатели, пожаровзрывоопасности аммиачно водородных смесей
| Состав горючей | смеси. % (об.) | Конц. пределы распр. пл., % (об.) | |
| аммиак | водород | нижний | верхний |
| 100 | 0 | 15 | 28 |
| 90 | 10 | 11,5 | 31,3 |
| 80 | 20 | 9,2 | 34,9 |
| 70 | 30 | 7,3 | 38,5 |
| 60 | 40 | 6,3 | 43,7 |
| 50 | 50 | 5,7 | 47 |
| 40 | 60 | 5,2 | 51,2 |
| 30 | 70 | 4,6 | 56,2 |
| 20 | 80 | 4,3 | 61,6 |
| 10 | 90 | 4,02 | 67,1 |
| 5 | 95 | — | 71,5 |
Таблица 3. Верхние пределы распространения пламени аммиачно-водородных смесей
| Состав горючей смеси, % (об.) | Верхние пределы распр. пл., % (об.), при содержании кислорода в воздухе, % (об.) | ||||
| аммиак | водород | 28 | 36 | 43,7 | 52 |
| 100 | 0 | 39,5 | 49 | 57 | 62 |
| 80 | 20 | — | 57 | 62,5 | — |
| 60 | 40 | — | 64 | 70 | — |
| 40 | 60 | — | 70,4 | 74,5 | — |
| 20 | 80 | — | 78 | 80 | — |
Также в лабораторных условиях можно получить аммиак нагревание нашатыря с гашеной известью Са(ОН)2 Реакция выражается уравнением
Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через склянку с натронной известью (смесь извести с едким натром).
Многие нитриды полностью гидролизуются водой с образова нием аммиака и гидроокиси металла. Например;
Цель статьи
В данной статье мы узнали методы и способы образования NH3 , в лабораторных условиях, рассмотрели синтез аммиака с помощью аппарата Киппа, узнали пажароопасность аммиачно водородных смесей
Статья на тему Синтез аммиака
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Кинетическое уравнение реакции синтеза аммиака
1. Основные понятия и постулаты химической кинетики
Химическая кинетика — раздел физической химии, изучающий скорости химических реакций. Основные задачи химической кинетики: 1) расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача); 2) определение механизмов реакций по кинетическим кривым (обратная задача).
Скорость химической реакции описывает изменение концентраций реагирующих веществ в единицу времени. Для реакции
aA + bB + . 
скорость реакции определяется следующим образом:
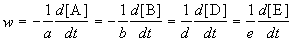
где квадратные скобки обозначают концентрацию вещества (обычно измеряется в моль/л), t — время; a, b, d, e — стехиометрические коэффициенты в уравнении реакции.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики — законом действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в некоторые степени:
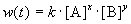
где k — константа скорости (не зависящая от концентрации); x, y — некоторые числа, которые называют порядком реакции по веществам A и B, соответственно. Эти числа в общем случае никак не связаны с коэффициентами a и b в уравнении реакции. Сумма показателей степеней x + y называется общим порядком реакции. Порядок реакции может быть положительным или отрицательным, целым или дробным.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. Элементарные реакции бывают только трех типов: мономолекулярные (A 


ПРИМЕРЫ
Пример 1-1. Скорость образования NO в реакции 2NOBr(г) 
Решение. По определению, скорость реакции равна:
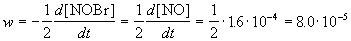
Из этого же определения следует, что скорость расходования NOBr равна скорости образования NO с обратным знаком:
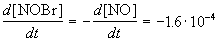
Пример 1-2. В реакции 2-го порядка A + B 
Решение. По закону действующих масс, в любой момент времени скорость реакции равна:
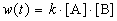
К моменту времени, когда [A] = 1.5 моль/л, прореагировало по 0.5 моль/л веществ A и B, поэтому [B] = 3 – 0.5 = 2.5 моль/л. Константа скорости равна:
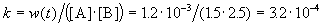
К моменту времени, когда [B] = 1.5 моль/л, прореагировало по 1.5 моль/л веществ A и B, поэтому [A] = 2 – 1.5 = 0.5 моль/л. Скорость реакции равна:
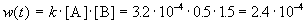
ЗАДАЧИ
1-1. Как выражается скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3 через концентрации азота и водорода? (ответ)
1-2. Как изменится скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3, если уравнение реакции записать в виде N2 + 3H2 = 2NH3? (ответ)
1-3. Чему равен порядок элементарных реакций: а) Сl + H2 = HCl + H; б) 2NO + Cl2 = 2NOCl? (ответ)
1-4. Какие из перечисленных величин могут принимать а) отрицательные; б) дробные значения: скорость реакции, порядок реакции, молекулярность реакции, константа скорости, стехиометрический коэффициент? (ответ)
1-5. Зависит ли скорость реакции от концентрации продуктов реакции? (ответ)
1-6. Во сколько раз увеличится скорость газофазной элементарной реакции A = 2D при увеличении давления в 3 раза?(ответ)
1-7. Определите порядок реакции, если константа скорости имеет размерность л 2 /(моль 2 . с). (ответ)
1-8. Константа скорости газовой реакции 2-го порядка при 25 о С равна 10 3 л/(моль . с). Чему равна эта константа, если кинетическое уравнение выражено через давление в атмосферах?(ответ)
1-9. Для газофазной реакции n-го порядка nA 
1-10. Константы скорости прямой и обратной реакции равны 2.2 и 3.8 л/(моль . с). По какому из перечисленных ниже механизмов могут протекать эти реакции: а) A + B = D; б) A + B = 2D; в) A = B + D; г) 2A = B.(ответ)
1-11. Реакция разложения 2HI 
1-12. Скорость реакции 2-го порядка A + B 
1-13. В реакции 2-го порядка A + B 
1-14. В реакции 2-го порядка A + B 
1-15. Скорость газофазной реакции описывается уравнением w = k . [A] 2 . [B]. При каком соотношении между концентрациями А и В начальная скорость реакции будет максимальна при фиксированном суммарном давлении? (ответ)
2. Кинетика простых реакций
В данном разделе мы составим на основе закона действующих масс и решим кинетические уравнения для необратимых реакций целого порядка.
Реакции 0-го порядка. Скорость этих реакций не зависит от концентрации:
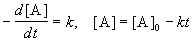
где [A] — концентрация исходного вещества. Нулевой порядок встречается в гетерогенных и фотохимических реакциях.
Реакции 1-го порядка. В реакциях типа A 
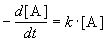
При решении кинетических уравнений часто используют следующие обозначения: начальная концентрация [A]0 = a, текущая концентрация [A] = a — x(t), где x(t) — концентрация прореагировавшего вещества A. В этих обозначениях кинетическое уравнение для реакции 1-го порядка и его решение имеют вид:
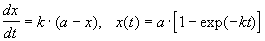
Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции:
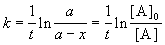
Время, за которое распадается половина вещества A, называют периодом полураспада t 1/2. Он определяется уравнением x(t 1/2) = a/2 и равен
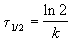
Реакции 2-го порядка. В реакциях типа A + B 
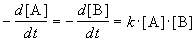
При решении этого уравнения различают два случая.
1) одинаковые начальные концентрации веществ A и B: a = b. Кинетическое уравнение имеет вид:
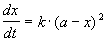
Решение этого уравнения записывают в различных формах:
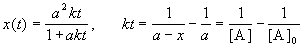
Период полураспада веществ A и B одинаков и равен:
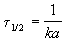
2) Начальные концентрации веществ A и B различны: a 
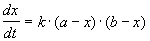
Решение этого уравнения можно записать следующим образом:
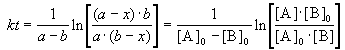
Периоды полураспада веществ A и B различны: 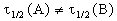
Реакции n-го порядка nA 
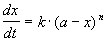
Решение кинетического уравнения:
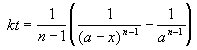
Период полураспада вещества A обратно пропорционален (n-1)-й степени начальной концентрации:
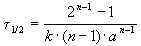
Пример 2-1. Период полураспада радиоактивного изотопа 14 C — 5730 лет. При археологических раскопках было найдено дерево, содержание 14 C в котором составляет 72% от нормального. Каков возраст дерева?
Решение. Радиоактивный распад — реакция 1-го порядка. Константа скорости равна:
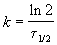
Время жизни дерева можно найти из решения кинетического уравнения с учетом того, что [A] = 0.72 . [A]0:
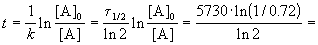
Пример 2-2. Установлено, что реакция 2-го порядка (один реагент) завершается на 75% за 92 мин при исходной концентрации реагента 0.24 М. Какое время потребуется, чтобы при тех же условиях концентрация реагента достигла 0.16 М?
Решение. Запишем два раза решение кинетического уравнения для реакции 2-го порядка с одним реагентом:
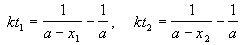
где, по условию, a = 0.24 M, t1 = 92 мин, x1 = 0.75 . 0.24 = 0.18 M, x2 = 0.24 — 0.16 = 0.08 M. Поделим одно уравнение на другое:
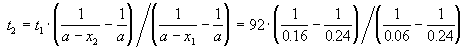
Пример 2-3. Для элементарной реакции nA 
и поделим одно выражение на другое. Постоянные величины k и a из обоих выражений сократятся, и мы получим:
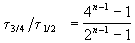
Этот результат можно обобщить, доказав, что отношение времен, за которые степень превращения составит a и b , зависит только от порядка реакции:
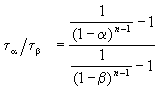
ЗАДАЧИ
2-1. Пользуясь решением кинетического уравнения, докажите, что для реакций 1-го порядка время t x, за которое степень превращения исходного вещества достигает x, не зависит от начальной концентрации. (ответ)
2-2. Реакция первого порядка протекает на 30% за 7 мин. Через какое время реакция завершится на 99%? (ответ)
2-3. Период полураспада радиоактивного изотопа 137 Cs, который попал в атмосферу в результате Чернобыльской аварии, — 29.7 лет. Через какое время количество этого изотопа составит менее 1% от исходного? (ответ)
2-4. Период полураспада радиоактивного изотопа 90 Sr, который попадает в атмосферу при ядерных испытаниях, — 28.1 лет. Предположим, что организм новорожденного ребенка поглотил 1.00 мг этого изотопа. Сколько стронция останется в организме через а) 18 лет, б) 70 лет, если считать, что он не выводится из организма?(ответ)
2-5. Константа скорости для реакции первого порядка SO2Cl2 = SO2 + Cl2 равна 2.2 . 10 -5 с -1 при 320 о С. Какой процент SO2Cl2 разложится при выдерживании его в течение 2 ч при этой температуре?(ответ)
2-6. Константа скорости реакции 1-го порядка
2N2O5(г) 
при 25 о С равна 3.38 . 10 -5 с -1 . Чему равен период полураспада N2O5? Чему будет равно давление в системе через а) 10 с, б) 10 мин, если начальное давление было равно 500 мм рт. ст. (ответ)
2-7. Реакцию первого порядка проводят с различными количествами исходного вещества. Пересекутся ли в одной точке на оси абсцисс касательные к начальным участкам кинетических кривых? Ответ поясните.(ответ)
2-8. Реакция первого порядка A 
2-9. Реакция второго порядка 2A 
2-10. Вещество A смешали с веществами B и C в равных концентрациях 1 моль/л. Через 1000 с осталось 50% вещества А. Сколько вещества А останется через 2000 с, если реакция имеет: а) нулевой, б) первый, в) второй, в) третий общий порядок?(ответ)
2-11. Какая из реакций — первого, второго или третьего порядка — закончится быстрее, если начальные концентрации веществ равны 1 моль/л и все константы скорости, выраженные через моль/л и с, равны 1? (ответ)
CH3CH2NO2 + OH — 
имеет второй порядок и константу скорости k = 39.1 л/(моль . мин) при 0 о С. Был приготовлен раствор, содержащий 0.004 М нитроэтана и 0.005 М NaOH. Через какое время прореагирует 90% нитроэтана? (ответ)
2-13. Константа скорости рекомбинации ионов H + и ФГ — (фенилглиоксинат) в молекулу НФГ при 298 К равна k = 10 11.59 л/(моль . с). Рассчитайте время, в течение которого реакция прошла на 99.999%, если исходные концентрации обоих ионов равны 0.001 моль/л. (ответ)
2-14. Скорость окисления бутанола-1 хлорноватистой кислотой не зависит от концентрации спирта и пропорциональна [HClO] 2 . За какое время реакция окисления при 298 К пройдет на 90%, если исходный раствор содержал 0.1 моль/л HClO и 1 моль/л спирта? Константа скорости реакции равна k = 24 л/(моль . мин). (ответ)
2-15. При определенной температуре 0.01 М раствор этилацетата омыляется 0.002 М раствором NaOH на 10% за 23 мин. Через сколько минут он будет омылен до такой же степени 0.005 М раствором KOH? Считайте, что данная реакция имеет второй порядок, а щелочи диссоциированы полностью.(ответ)
2-16. Реакция второго порядка A + B 
*2-17. Скорость автокаталитической реакции A 
*2-18. Автокаталитическая реакция A 
*2-19. Автокаталитическая реакция A 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
http://znaesh-kak.com/x/h/%D1%81%D0%B8%D0%BD%D1%82%D0%B5%D0%B7-%D0%B0%D0%BC%D0%BC%D0%B8%D0%B0%D0%BA%D0%B0
http://www.chem.msu.su/rus/teaching/eremin/1-2.html