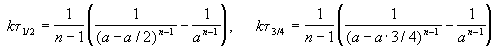Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается .
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором .
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например , при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
Кинетическое уравнение скорости реакции это
1. Основные понятия и постулаты химической кинетики
Химическая кинетика — раздел физической химии, изучающий скорости химических реакций. Основные задачи химической кинетики: 1) расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача); 2) определение механизмов реакций по кинетическим кривым (обратная задача).
Скорость химической реакции описывает изменение концентраций реагирующих веществ в единицу времени. Для реакции
aA + bB + . 
скорость реакции определяется следующим образом:
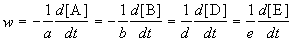
где квадратные скобки обозначают концентрацию вещества (обычно измеряется в моль/л), t — время; a, b, d, e — стехиометрические коэффициенты в уравнении реакции.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики — законом действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в некоторые степени:
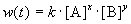
где k — константа скорости (не зависящая от концентрации); x, y — некоторые числа, которые называют порядком реакции по веществам A и B, соответственно. Эти числа в общем случае никак не связаны с коэффициентами a и b в уравнении реакции. Сумма показателей степеней x + y называется общим порядком реакции. Порядок реакции может быть положительным или отрицательным, целым или дробным.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. Элементарные реакции бывают только трех типов: мономолекулярные (A 


ПРИМЕРЫ
Пример 1-1. Скорость образования NO в реакции 2NOBr(г) 
Решение. По определению, скорость реакции равна:
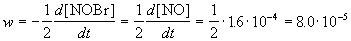
Из этого же определения следует, что скорость расходования NOBr равна скорости образования NO с обратным знаком:
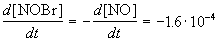
Пример 1-2. В реакции 2-го порядка A + B 
Решение. По закону действующих масс, в любой момент времени скорость реакции равна:
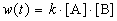
К моменту времени, когда [A] = 1.5 моль/л, прореагировало по 0.5 моль/л веществ A и B, поэтому [B] = 3 – 0.5 = 2.5 моль/л. Константа скорости равна:
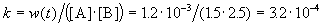
К моменту времени, когда [B] = 1.5 моль/л, прореагировало по 1.5 моль/л веществ A и B, поэтому [A] = 2 – 1.5 = 0.5 моль/л. Скорость реакции равна:
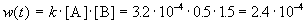
ЗАДАЧИ
1-1. Как выражается скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3 через концентрации азота и водорода? (ответ)
1-2. Как изменится скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3, если уравнение реакции записать в виде N2 + 3H2 = 2NH3? (ответ)
1-3. Чему равен порядок элементарных реакций: а) Сl + H2 = HCl + H; б) 2NO + Cl2 = 2NOCl? (ответ)
1-4. Какие из перечисленных величин могут принимать а) отрицательные; б) дробные значения: скорость реакции, порядок реакции, молекулярность реакции, константа скорости, стехиометрический коэффициент? (ответ)
1-5. Зависит ли скорость реакции от концентрации продуктов реакции? (ответ)
1-6. Во сколько раз увеличится скорость газофазной элементарной реакции A = 2D при увеличении давления в 3 раза?(ответ)
1-7. Определите порядок реакции, если константа скорости имеет размерность л 2 /(моль 2 . с). (ответ)
1-8. Константа скорости газовой реакции 2-го порядка при 25 о С равна 10 3 л/(моль . с). Чему равна эта константа, если кинетическое уравнение выражено через давление в атмосферах?(ответ)
1-9. Для газофазной реакции n-го порядка nA 
1-10. Константы скорости прямой и обратной реакции равны 2.2 и 3.8 л/(моль . с). По какому из перечисленных ниже механизмов могут протекать эти реакции: а) A + B = D; б) A + B = 2D; в) A = B + D; г) 2A = B.(ответ)
1-11. Реакция разложения 2HI 
1-12. Скорость реакции 2-го порядка A + B 
1-13. В реакции 2-го порядка A + B 
1-14. В реакции 2-го порядка A + B 
1-15. Скорость газофазной реакции описывается уравнением w = k . [A] 2 . [B]. При каком соотношении между концентрациями А и В начальная скорость реакции будет максимальна при фиксированном суммарном давлении? (ответ)
2. Кинетика простых реакций
В данном разделе мы составим на основе закона действующих масс и решим кинетические уравнения для необратимых реакций целого порядка.
Реакции 0-го порядка. Скорость этих реакций не зависит от концентрации:
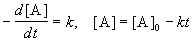
где [A] — концентрация исходного вещества. Нулевой порядок встречается в гетерогенных и фотохимических реакциях.
Реакции 1-го порядка. В реакциях типа A 
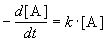
При решении кинетических уравнений часто используют следующие обозначения: начальная концентрация [A]0 = a, текущая концентрация [A] = a — x(t), где x(t) — концентрация прореагировавшего вещества A. В этих обозначениях кинетическое уравнение для реакции 1-го порядка и его решение имеют вид:
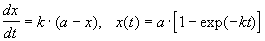
Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции:
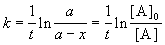
Время, за которое распадается половина вещества A, называют периодом полураспада t 1/2. Он определяется уравнением x(t 1/2) = a/2 и равен
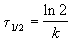
Реакции 2-го порядка. В реакциях типа A + B 
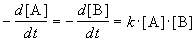
При решении этого уравнения различают два случая.
1) одинаковые начальные концентрации веществ A и B: a = b. Кинетическое уравнение имеет вид:
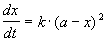
Решение этого уравнения записывают в различных формах:
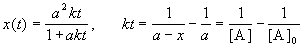
Период полураспада веществ A и B одинаков и равен:
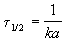
2) Начальные концентрации веществ A и B различны: a 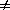
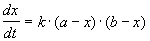
Решение этого уравнения можно записать следующим образом:
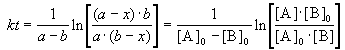
Периоды полураспада веществ A и B различны: 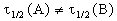
Реакции n-го порядка nA 
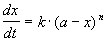
Решение кинетического уравнения:
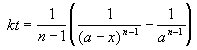
Период полураспада вещества A обратно пропорционален (n-1)-й степени начальной концентрации:
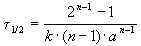
Пример 2-1. Период полураспада радиоактивного изотопа 14 C — 5730 лет. При археологических раскопках было найдено дерево, содержание 14 C в котором составляет 72% от нормального. Каков возраст дерева?
Решение. Радиоактивный распад — реакция 1-го порядка. Константа скорости равна:
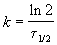
Время жизни дерева можно найти из решения кинетического уравнения с учетом того, что [A] = 0.72 . [A]0:
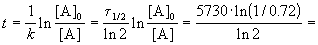
Пример 2-2. Установлено, что реакция 2-го порядка (один реагент) завершается на 75% за 92 мин при исходной концентрации реагента 0.24 М. Какое время потребуется, чтобы при тех же условиях концентрация реагента достигла 0.16 М?
Решение. Запишем два раза решение кинетического уравнения для реакции 2-го порядка с одним реагентом:
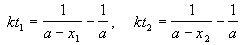
где, по условию, a = 0.24 M, t1 = 92 мин, x1 = 0.75 . 0.24 = 0.18 M, x2 = 0.24 — 0.16 = 0.08 M. Поделим одно уравнение на другое:
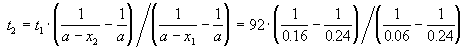
Пример 2-3. Для элементарной реакции nA 
и поделим одно выражение на другое. Постоянные величины k и a из обоих выражений сократятся, и мы получим:
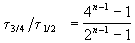
Этот результат можно обобщить, доказав, что отношение времен, за которые степень превращения составит a и b , зависит только от порядка реакции:
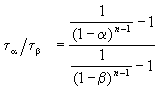
ЗАДАЧИ
2-1. Пользуясь решением кинетического уравнения, докажите, что для реакций 1-го порядка время t x, за которое степень превращения исходного вещества достигает x, не зависит от начальной концентрации. (ответ)
2-2. Реакция первого порядка протекает на 30% за 7 мин. Через какое время реакция завершится на 99%? (ответ)
2-3. Период полураспада радиоактивного изотопа 137 Cs, который попал в атмосферу в результате Чернобыльской аварии, — 29.7 лет. Через какое время количество этого изотопа составит менее 1% от исходного? (ответ)
2-4. Период полураспада радиоактивного изотопа 90 Sr, который попадает в атмосферу при ядерных испытаниях, — 28.1 лет. Предположим, что организм новорожденного ребенка поглотил 1.00 мг этого изотопа. Сколько стронция останется в организме через а) 18 лет, б) 70 лет, если считать, что он не выводится из организма?(ответ)
2-5. Константа скорости для реакции первого порядка SO2Cl2 = SO2 + Cl2 равна 2.2 . 10 -5 с -1 при 320 о С. Какой процент SO2Cl2 разложится при выдерживании его в течение 2 ч при этой температуре?(ответ)
2-6. Константа скорости реакции 1-го порядка
2N2O5(г) 
при 25 о С равна 3.38 . 10 -5 с -1 . Чему равен период полураспада N2O5? Чему будет равно давление в системе через а) 10 с, б) 10 мин, если начальное давление было равно 500 мм рт. ст. (ответ)
2-7. Реакцию первого порядка проводят с различными количествами исходного вещества. Пересекутся ли в одной точке на оси абсцисс касательные к начальным участкам кинетических кривых? Ответ поясните.(ответ)
2-8. Реакция первого порядка A 
2-9. Реакция второго порядка 2A 
2-10. Вещество A смешали с веществами B и C в равных концентрациях 1 моль/л. Через 1000 с осталось 50% вещества А. Сколько вещества А останется через 2000 с, если реакция имеет: а) нулевой, б) первый, в) второй, в) третий общий порядок?(ответ)
2-11. Какая из реакций — первого, второго или третьего порядка — закончится быстрее, если начальные концентрации веществ равны 1 моль/л и все константы скорости, выраженные через моль/л и с, равны 1? (ответ)
CH3CH2NO2 + OH — 
имеет второй порядок и константу скорости k = 39.1 л/(моль . мин) при 0 о С. Был приготовлен раствор, содержащий 0.004 М нитроэтана и 0.005 М NaOH. Через какое время прореагирует 90% нитроэтана? (ответ)
2-13. Константа скорости рекомбинации ионов H + и ФГ — (фенилглиоксинат) в молекулу НФГ при 298 К равна k = 10 11.59 л/(моль . с). Рассчитайте время, в течение которого реакция прошла на 99.999%, если исходные концентрации обоих ионов равны 0.001 моль/л. (ответ)
2-14. Скорость окисления бутанола-1 хлорноватистой кислотой не зависит от концентрации спирта и пропорциональна [HClO] 2 . За какое время реакция окисления при 298 К пройдет на 90%, если исходный раствор содержал 0.1 моль/л HClO и 1 моль/л спирта? Константа скорости реакции равна k = 24 л/(моль . мин). (ответ)
2-15. При определенной температуре 0.01 М раствор этилацетата омыляется 0.002 М раствором NaOH на 10% за 23 мин. Через сколько минут он будет омылен до такой же степени 0.005 М раствором KOH? Считайте, что данная реакция имеет второй порядок, а щелочи диссоциированы полностью.(ответ)
2-16. Реакция второго порядка A + B 
*2-17. Скорость автокаталитической реакции A 
*2-18. Автокаталитическая реакция A 
*2-19. Автокаталитическая реакция A 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
ХИМИЧЕСКАЯ КИНЕТИКА
ХИМИЧЕСКАЯ КИНЕТИКА – (от греч. кинетикос – движущий) наука о механизмах химических реакций и закономерностях их протекания во времени.
В 19 в. результате развития основ химической термодинамики химики научились рассчитывать состав равновесной смеси для обратимых химических реакций. Кроме того, на основании несложных расчетов можно было, не проводя экспериментов, сделать вывод о принципиальной возможности или невозможности протекания конкретной реакции в данных условиях. Однако «принципиальная возможность» реакции еще не означает, что она пойдет. Например, реакция С + О2 → СО2 с точки зрения термодинамики весьма благоприятна, во всяком случае, при температурах ниже 1000° С (при более высоких температурах происходит уже распад молекул СО2), т.е. углерод и кислород должны (практически со 100%-ным выходом) превратиться в диоксид углерода. Однако опыт показывает, что кусок угля может годами лежать на воздухе, при свободном доступе кислорода, не претерпевая никаких изменений. То же можно сказать и о множестве других известных реакций. Например, смеси водорода с хлором или с кислородом могут сохраняться очень долго без всяких признаков химических реакций, хотя в обоих случаях реакции термодинамически благоприятны. Это означает, что после достижения равновесия в стехиометрической смеси H2 + Cl2 должен остаться только хлороводород, а в смеси 2Н2 + О2 – только вода. Другой пример: газообразный ацетилен вполне стабилен, хотя реакция C2H2 → 2C + H2 не только термодинамически разрешена, но и сопровождается значительным выделением энергии. Действительно, при высоких давлениях, ацетилен взрывается, однако в обычных условиях он вполне стабилен.
Термодинамически разрешенные реакции, подобные рассмотренным, могут пойти только в определенных условиях. Например, после поджигания уголь или сера самопроизвольно соединяются с кислородом; водород легко реагирует с хлором при повышении температуры или при действии ультрафиолетового света; смесь водорода с кислородом (гремучий газ) взрывается при поджигании или при внесении катализатора. Почему же для осуществления всех этих реакций необходимы специальные воздействия – нагревание, облучение, действие катализаторов? Химическая термодинамика не дает ответа на этот вопрос – понятие времени в ней отсутствует. В то же время для практических целей очень важно знать, пройдет ли данная реакция за секунду, за год или же за многие тысячелетия.
Опыт показывает, что скорость разных реакций может отличаться очень сильно. Практически мгновенно идут многие реакции в водных растворах. Так, при добавлении избытка кислоты к щелочному раствору фенолфталеина малинового цвета раствор мгновенно обесцвечивается, это означает, что реакция нейтрализации, а также реакция превращения окрашенной формы индикатора в бесцветную идут очень быстро. Значительно медленнее идет реакция окисления водного раствора иодида калия кислородом воздуха: желтая окраска продукта реакции – иода появляется лишь через продолжительное время. Медленно протекают процессы коррозии железных и особенно медных сплавов, многие другие процессы.
Предсказание скорости химической реакции, а также выяснение зависимости этой скорости от условий проведения реакции – одна из важных задач химической кинетики – науки, изучающей закономерности протекания реакций во времени. Не менее важна и вторая задача, стоящая перед химической кинетикой – изучение механизма химических реакций, то есть детального пути превращения исходных веществ в продукты реакции.
Скорость реакции.
Проще всего определить скорость для реакции, протекающей между газообразными или жидкими реагентами в гомогенной (однородной) смеси в сосуде постоянного объема. В этом случае скорость реакции определяется как изменение концентрации любого из участвующих в реакции веществ (это может быть исходное вещество или продукт реакции) в единицу времени. Это определение можно записать в виде производной: v = dc/dt, где v – скорость реакции; t – временя, c – концентрация. Эту скорость легко определить, если есть экспериментальные данные по зависимости концентрации вещества от времени. По этим данным можно построить график, который называется кинетической кривой. Скорость реакции в заданной точке кинетической кривой определяется наклоном касательной в этой точке. Определение наклона касательной всегда связано с некоторой ошибкой. Точнее всего определяется начальная скорость реакции, поскольку вначале кинетическая кривая обычно близка к прямой; это облегчает проведение касательной в начальной точке кривой.
Если время измерять в секундах, а концентрацию – в молях на литр, то скорость реакции измеряется в единицах моль/(л·с). Таким образом, скорость реакции не зависит от объема реакционной смеси: при одинаковых условиях она будет одинаковой и в маленькой пробирке, и в многотоннажном реакторе.
Величина dt всегда положительна, тогда как знак dc зависит от того, как изменяется со временем концентрация – уменьшается (для исходных веществ) или увеличивается (для продуктов реакции). Чтобы скорость реакции всегда оставалась величиной положительной, в случае исходных веществ перед производной ставят знак минус: v = –dc/dt. Если реакция идет в газовой фазе, вместо концентрации веществ в уравнении скорости часто используют давление. Если газ близок к идеальному, то давление р связано с концентрацией с простым уравнением: p = cRT.
В ходе реакции разные вещества могут расходоваться и образовываться с разной скоростью, в соответствии с коэффициентами в стехиометрическом уравнении (см. СТЕХИОМЕТРИЯ), поэтому, определяя скорость конкретной реакции, следует учитывать эти коэффициенты. Например, в реакции синтеза аммиака 3H2 + N2 → 2NH3 водород расходуется в 3 раза быстрее, чем азот, а аммиак накапливается в 2 раза быстрее, чем расходуется азот. Пэтому уравнение скорости для этой реакции записывают следующим образом: v = –1/3 dp(H2)/dt = –dp(N2)/dt = +1/2 dp(NH3)/dt. В общем случае, если реакция стехиометрическая, т.е. протекает точно в соответствии с записанным уравнением: aA + bB → cC + dD, ее скорость определяют как v = –(1/a)d[A]/dt = –(1/b)d[B]/dt = (1/c)d[C]/dt = (1/d)d[D]/dt (квадратными скобками принято указывать молярную концентрацию веществ). Таким образом, скорости по каждому веществу жестко связаны между собой и, определив экспериментально скорость для любого участника реакции, легко рассчитать ее для любого другого вещества.
Большинство реакций, используемых в промышленности, относятся к гетерогенно-каталитическим. Они протекают на поверхности раздела фаз между твердым катализатором и газовой или жидкой фазой. На поверхности раздела двух фаз протекают и такие реакции как обжиг сульфидов, растворение металлов, оксидов и карбонатов в кислотах, ряд других процессов. Для таких реакций скорость зависит и от величины поверхности раздела, поэтому скорость гетерогенной реакции относят не к единице объема, а к единице поверхности. Измерить величину поверхности, на которой идет реакция, не всегда просто.
Если реакция протекает в замкнутом объеме, то ее скорость в большинстве случаев максимальна в начальный момент времени (когда максимальна концентрация исходных веществ), а затем, по мере превращения исходных реагентов в продукты и, соответственно, снижения их концентрации, скорость реакции уменьшается. Встречаются и реакции, в которых скорость увеличивается со временем. Например, если медную пластинку опустить в раствор чистой азотной кислоты, то скорость реакции будет расти со временем, что легко наблюдать визуально. Ускоряются со временем также процессы растворения алюминия в растворах щелочей, окисления многих органических соединений кислородом, ряд других процессов. Причины такого ускорения могут быть разными. Например, это может быть связано с удалением защитной оксидной пленки с поверхности металла, или с постепенным разогревом реакционной смеси, или с накоплением веществ, ускоряющих реакцию (такие реакции называются автокаталитическими).
В промышленности реакции обычно проводят путем непрерывной подачи в реактор исходных веществ и вывода продуктов. В таких условиях можно добиться постоянной скорости протекания химической реакции. С постоянной скоростью протекают и фотохимические реакции при условии полного поглощения падающего света (см. ФОТОХИМИЧЕСКИЕ РЕАКЦИИ).
Лимитирующая стадия реакции.
Если реакция осуществляется путем последовательно протекающих стадий (не обязательно все из них являются химическими) и одна из этих стадий требует значительно большего времени, чем остальные, то есть идет намного медленнее, то такая стадия называется лимитирующей. Именно эта самая медленная стадия определяет скорость всего процесса. Рассмотрим в качестве примера каталитическую реакцию окисления аммиака. Здесь возможны два предельных случая.
1. Поступление молекул реагентов – аммиака и кислорода к поверхности катализатора (физический процесс) происходит значительно медленнее, чем сама каталитическая реакция на поверхности. Тогда для повышения скорости образования целевого продукта – оксида азота совершенно бесполезно повышать эффективность катализатора, а надо позаботиться об ускорении доступа реагентов к поверхности.
2. Подача реагентов к поверхности происходит значительно быстрее самой химической реакции. Вот здесь имеет смысл совершенствовать катализатор, подбирать оптимальные условия для каталитической реакции, так как лимитирующей стадией в данном случае является каталитическая реакция на поверхности.
Теория столкновений.
Исторически первой теорией, на основании которой можно было рассчитывать скорости химических реакций, была теория столкновений. Очевидно, что для того, чтобы молекулы прореагировали, они прежде всего должны столкнуться. Отсюда следует, что реакция должна идти тем быстрее, чем чаще сталкиваются друг с другом молекулы исходных веществ. Поэтому каждый фактор, влияющий на частоту столкновений между молекулами, будет влиять и на скорость реакции. Некоторые важные закономерности, касающиеся столкновений между молекулами, были получены на основании молекулярно-кинетической теории газов.
В газовой фазе молекулы движутся с большими скоростями (сотни метров в секунду) и очень часто сталкиваются друг с другом. Частота столкновений определяется прежде всего числом частиц в единице объема, то есть концентрацией (давлением). Частота столкновений зависит также и от температуры (с ее повышением молекулы движутся быстрее) и от размера молекул (большие молекулы сталкиваются друг с другом чаще, чем маленькие). Однако концентрация влияет на частоту столкновений значительно сильнее. При комнатной температуре и атмосферном давлении каждая молекула средних размеров испытывает в секунду несколько миллиардов столкновений.
На основании этих данных можно рассчитать скорость реакции А + В → С между двумя газообразными соединениями А и В, предполагая, что химическая реакция проходит при каждом столкновении молекул реагентов. Пусть в литровой колбе при атмосферном давлении есть смесь реагентов А и В при равных концентрациях. Всего в колбе будет 6·10 23 /22,4 = 2,7·10 22 молекул, из которых 1,35·10 22 молекул вещества А и столько же молекул вещества В. Пусть за 1 с каждая молекула А испытывает 10 9 столкновений с другими молекулами, из которых половина (5·10 8 ) приходится на столкновения с молекулами В (столкновения А + А не приводят к реакции). Тогда всего в колбе за 1 с происходит 1,35·10 22 ·5·10 8
7·10 30 столкновений молекул А и В. Очевидно, что если бы каждое из них приводило к реакции, она прошла бы мгновенно. Однако многие реакции идут достаточно медленно. Отсюда можно сделать вывод, что лишь ничтожная доля столкновений между молекулами реагентов приводит к взаимодействию между ними.
Для создания теории, которая позволяла бы рассчитать скорость реакции на основании молекулярно-кинетической теории газов, нужно было уметь рассчитывать общее число столкновений молекул и долю «активных» столкновений, приводящих реакции. Нужно было также объяснить, почему скорость большинства химических реакций сильно возрастает при повышении температуры – скорость молекул и частота столкновений между ними увеличиваются с температурой незначительно – пропорционально 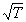
Эти проблемы были решены на основании теории столкновений следующим образом. При столкновениях молекулы непрерывно обмениваются скоростями и энергиями. Так, данная молекула в результате «удачного» столкновения может заметно увеличить свою скорость, тогда как при «неудачном» столкновении она может почти остановиться (похожую ситуацию можно наблюдать на примере бильярдных шаров). При нормальном атмосферном давлении столкновения, а следовательно, изменения скорости происходят с каждой молекулой миллиарды раз в секунду. При этом скорости и энергии молекул в значительной степени усредняются. Если в данный момент времени «пересчитать» в заданном объеме газа молекулы, обладающие определенными скоростями, то окажется, что значительная часть их имеет скорость, близкую к средней. В то же время многие молекулы обладают скоростью меньше средней, а часть движется со скоростями больше средней. С увеличением скорости доля молекул, имеющих данную скорость, быстро уменьшается. В соответствии с теорией столкновений, реагируют только те молекулы, которые при столкновении обладают достаточно высокой скоростью (и, следовательно, большим запасом кинетической энергии). Такое предположение было сделано в 1889 году шведским химиком Сванте Аррениусом.
Энергия активации.
Аррениус ввел в обиход химиков очень важное понятие энергии активации (Ea) – это та минимальная энергия, которой должна обладать молекула (или пара реагирующих молекул), чтобы вступить в химическую реакцию. Энергию активации измеряют обычно в джоулях и относят не к одной молекуле (это очень маленькая величина), а к молю вещества и выражают в единицах Дж/моль или кДж/моль. Если энергия сталкивающихся молекул меньше энергии активации, то реакция не пойдет, а если равна или больше, то молекулы прореагируют.
Энергии активации для разных реакций определяют экспериментально (из зависимости скорости реакции от температуры). Изменяться энергия активации может в довольно широких пределах – от единиц до нескольких сотен кДж/моль. Например, для реакции 2NO2 → N2O4 энергия активации близка к нулю, для реакции 2Н2О2 → 2Н2О + О2 в водных растворах Ea = 73 кДж/моль, для термического разложения этана на этилен и водород Ea = 306 кДж/моль.
Энергия активации большинства химических реакций значительно превышает среднюю кинетическую энергию молекул, которая при комнатной температуре составляет всего лишь около 4 кДж/моль и даже при температуре 1000° С не превышает 16 кДж/моль. Таким образом, чтобы прореагировать, молекулы обычно должны иметь скорость значительно больше средней. Например, в случае Ea = 200 кДж/моль сталкивающиеся молекулы небольшой молекулярной массы должны иметь скорость порядка 2,5 км/с (энергия активации в 25 раз больше средней энергии молекул при 20° С). И это – общее правило: для большинства химических реакций энергия активации значительно превышает среднюю кинетическую энергию молекул.
Вероятность для молекулы запасти в результате серии столкновений большую энергию очень мала: такой процесс требует для нее колоссального числа последовательных «удачных» столкновений, в результате которых молекула только набирает энергию, не теряя ее. Поэтому для многих реакций лишь ничтожная доля молекул имеет энергию, достаточную для преодоления барьера. Эта доля, в соответствии с теорией Аррениуса, определяется формулой: a = e –Ea /RT = 10 –Ea /2,3RT
10 –Ea /19Т, где R = 8,31 Дж/(моль . К). Из формулы следует, что доля молекул, обладающих энергией Ea, как и доля активных столкновений a, очень сильно зависит как от энергии активации, так и от температуры. Например, для реакции с Ea = 200 кДж/моль при комнатной температуре (Т
300 К) доля активных столкновений ничтожно мала: a = 10 –200000/(19,300)
10 –35 . И если каждую секунду в сосуде происходит 7·10 30 столкновений молекул А и В, то понятно, что реакция идти не будет.
Если увеличить вдвое абсолютную температуру, т.е. нагреть смесь до 600 К (327° С); при этом доля активных столкновений резко возрастет: a = 10 –200000/(19,600)
4·10 –18 . Таким образом, повышение температуры в 2 раза увеличило долю активных столкновений в 4·10 17 раз. Теперь каждую секунду из общего числа примерно 7·10 30 столкновений к реакции будет приводить 7·10 30 ·4·10 –18
3·10 13 . Такая реакция, в которой каждую секунду исчезает 3·10 13 молекул (из примерно 10 22 ), хотя и очень медленно, но все же идет. Наконец, при температуре 1000 К (727° C) a
3·10 –11 (из каждых 30 миллиардов столкновений данной молекулы реагента одно приводит к реакции). Это уже много, так как за 1 с в реакцию будут вступать 7·10 30 ·3·10 –11 = 2·10 20 молекул, и такая реакция пройдет за несколько минут (с учетом снижения частоты столкновений с уменьшением концентрации реагентов).
Теперь понятно, почему повышение температуры может так сильно увеличить скорость реакции. Средняя скорость (и энергия) молекул с повышением температуры увеличивается незначительно, но зато резко повышается доля «быстрых» (или «активных») молекул, обладающих достаточной для протекания реакции скоростью движения или достаточной колебательной энергией.
Расчет скорости реакции с учетом общего числа столкновений и доли активных молекул (т.е. энергии активации), часто дает удовлетворительное соответствие с экспериментальными данными. Однако для многих реакций наблюдаемая на опыте скорость оказывается меньше рассчитанной по теории столкновений. Это объясняется тем, что для осуществления реакции нужно, чтобы столкновение было удачным не только энергетически, но и «геометрически», то есть молекулы должны в момент столкновения определенным образом ориентироваться относительно друг друга. Таким образом, при расчетах скорости реакций по теории столкновений, помимо энергетического, учитывают и стерический (пространственный) фактор для данной реакции.
Уравнение Аррениуса.
Зависимость скорости реакции от температуры обычно описывают уравнением Аррениуса, которое в простейшем виде можно записать как v = v0 a = v0e –Ea/RT , где v0 – скорость, которую имела бы реакция при нулевой энергии активации (фактически это частота столкновений в единице объеме). Поскольку v0 слабо зависит от температуры, все определяет второй сомножитель – экспоненциальный: с увеличением температуры этот сомножитель быстро увеличивается, причем тем быстрее, чем больше энергия активации Еа. Указанная зависимость скорости реакции от температуры называется уравнением Аррениуса, оно – одно из важнейших в химической кинетике. Для приблизительной оценки влияния температуры на скорость реакции иногда используют так называемое «правило Вант-Гоффа» (см. ВАНТ-ГОФФА ПРАВИЛО).
Если реакция подчиняется уравнению Аррениуса, логарифм ее скорости (измеренной, например, в начальный момент) должен линейно зависеть от абсолютной температуры, то есть график зависимости lnv от 1/Т должен быть прямолинейным. Наклон этой прямой равен энергии активации реакции. По такому графику можно предсказать, какова будет скорость реакции при данной температуре или же – при какой температуре реакция будет идти с заданной скоростью.
Несколько практических примеров использования уравнения Аррениуса.
1. На упаковке замороженного продукта написано, что его можно хранить на полке холодильника (5° С) в течение суток, в морозильнике, отмеченном одной звездочкой (–6° С), – неделю, двумя звездочками (–12° С) – месяц, а в морозильнике со значком *** (что означает температуру в нем –18° С) – 3 месяца. Предположив, что скорость порчи продукта обратно пропорциональна гарантийному сроку хранения tхр, в координатах lntхр, 1/Т получаем, в соответствии с уравнением Аррениуса, прямую. Из нее можно рассчитать энергию активации биохимических реакций, приводящие к порче данного продукта (около 115 кДж/моль). Из того же графика можно выяснить, до какой температуры надо охладить продукт, чтобы его можно было хранить, например, 3 года; получается –29° С.
2. Альпинисты знают, что в горах трудно сварить яйцо, и вообще любую пищу, требующую более или менее длительного кипячения. Качественно причина этого понятна: с понижением атмосферного давления уменьшается температура кипения воды. С помощью уравнения Аррениуса можно рассчитать, сколько времени потребуется, например, чтобы сварить вкрутую яйцо в г. Мехико, расположенном на высоте 2265 м, где нормальным считается давление 580 мм рт.ст., а вода при таком пониженном давлении кипит при 93° С. Энергия активации реакция «свертывания» (денатурации) белка была измерена и оказалась очень большой по сравнению со многими другими химическими реакциями – порядка 400 кДж/моль (она может несколько отличаться для различных белков). В таком случае понижение температуры от 100 до 93° С (то есть от 373 до 366 К) приведет к замедлению реакции в 10 (400000/19)(1/366 – 1/373) = 11,8 раза. Именно поэтому жители высокогорья предпочитают варке пищи ее жарку: температура сковородки, в отличие от температуры кастрюли с кипятком, не зависит от атмосферного давления.
3. В кастрюле-скороварке пища готовится при повышенном давлении и, следовательно, при повышенной температуре кипения воды. Известно, что в обычной кастрюле говядина варится 2–3 часа, а компот из яблок – 10–15 мин. Учитывая, что оба процесса имеют близкую энергию активации (около 120 кДж/моль), можно по уравнению Аррениуса рассчитать, что в скороварке при 118°С мясо будет вариться 25–30 мин, а компот – всего 2 мин.
Уравнение Аррениуса очень важно для химической промышленности. При протекании экзотермической реакции выделяющаяся тепловая энергия нагревает не только окружающую среду, но и сами реагенты. это может привести к нежелательному сильному ускорению реакции. Расчет изменения скорости реакции и скорости тепловыделения при повышении температуры позволяет избежать теплового взрыва (см. ВЗРЫВЧАТЫЕ ВЕЩЕСТВА).
Зависимость скорости реакции от концентрации реагентов.
Скорость большинства реакций со временем постепенно снижается. Этот результат хорошо согласуется с теорией столкновений: по мере протекания реакции концентрации исходных веществ падают, снижается и частота столкновений между ними; соответственно уменьшается и частота столкновения активных молекул. Это приводит к уменьшению скорости реакции. В этом состоит сущность одного из основных законов химической кинетики: скорость химической реакции пропорциональна концентрации реагирующих молекул. Математически это можно записать в виде формулы v = k[A][B], где k – постоянная, называемая константой скорости реакции. Приведенное уравнение называется уравнением скорости химической реакции или кинетическим уравнением. Константа скорости для данной реакции не зависит от концентрации реагентов и от времени, но она зависит от температуры в соответствии с уравнением Аррениуса: k = k0e –Ea/RT .
Простейшее уравнение скорости v = k[A][B] всегда справедливо в том случае, когда молекулы (или другие частицы, например, ионы) А, сталкиваясь с молекулами В, могут непосредственно превращаться в продукты реакции. Подобные реакции, идущие в один прием (как говорят химики, в одну стадию), называются элементарными реакциями. Таких реакций немного. Большинство реакций (даже таких с виду таких простых как H2 + I2 ® 2HI) не являются элементарными, поэтому исходя из стехиометрического уравнения такой реакции записать его кинетическое уравнение нельзя.
Кинетическое уравнение можно получить двумя способами: экспериментально – измеряя зависимость скорости реакции от концентрации каждого реагента по отдельности, и теоретически – если известен детальный механизм реакции. Чаще всего (но не всегда) кинетическое уравнение имеет вид v = k[A] x [B] y , где x и y называются порядками реакции по реагентам А и В. Эти порядки, в общем случае, могут быть целыми и дробными, положительными и даже отрицательными. Например, кинетическое уравнение для реакции термического распада ацетальдегида CH3CHO ® CH4 + CO имеет вид v = k[CH3CHO] 1,5 , т.е. реакция имеет полуторный порядок. Иногда возможно случайное совпадение стехиометрических коэффициентов и порядков реакции. Так, эксперимент показывает, что реакция H2 + I2 ® 2HI имеет первый порядок как по водороду, так и по иоду, то есть ее кинетическое уравнение имеет вид v = k[H2][I2] (именно поэтому эту реакцию в течение многих десятилетий считали элементарной, пока в 1967 не был доказан ее более сложный механизм).
Если известно кинетическое уравнение, т.е. известно, как скорость реакции зависит от концентраций реагентов в каждый момент времени, и известна константа скорости, то можно рассчитать зависимость от времени концентраций реагентов и продуктов реакции, т.е. теоретически получить все кинетические кривые. Для таких расчетов используются методы высшей математики или компьютерные расчеты, и они не представляют принципиальных трудностей.
С другой стороны, полученное экспериментально кинетическое уравнение помогает судить о механизме реакции, т.е. о совокупности простых (элементарных) реакций. Выяснение механизмов реакций является важнейшей задачей химической кинетики. Это очень трудная задача, так как механизм даже простой с виду реакции может включать множество элементарных стадий.
Можно проиллюстрировать применение кинетических методов для определения механизма реакции на примере щелочного гидролиза алкилгалогенидов с образованием спиртов: RX + OH – → ROH + X – . Экспериментально было обнаружено, что для R = CH3, C2H5 и т.д. и X = Cl скорость реакции прямо пропорционально концентрациям реагентов, т.е. имеет первый порядок по галогениду RX и первый – по щелочи, и кинетическое уравнение имеет вид v = k1[RX][OH – ]. В случае третичных алкилиодидов (R = (CH3)3C, X = I) порядок по RX – первый, а по щелочи – нулевой: v = k2[RX]. В промежуточных случаях, например, для изопропилбромида (R = (CH3)2CH, X = Br), реакция описывается более сложным кинетическим уравнением: v = k1[RX][OH – ] + k2[RX]. На основании этих кинетических данных был сделан следующий вывод о механизмах подобных реакций.
В первом случае реакция идет в один прием, путем непосредственного столкновения молекул спирта с ионами ОН – (так называемый механизм SN2). Во втором случае реакция идет в две стадии. Первая стадия – медленная диссоциация алкилиодида на два иона: RI → R + + I – . Вторая – очень быстрая реакция между ионами: R + + OH – → ROH. Скорость суммарной реакции зависит только от медленной (лимитирующей) стадии, поэтому она не зависит от концентрации щелочи; отсюда – нулевой порядок по щелочи (механизм SN1). В случае вторичных алкилбромидов осуществляются одновременно оба механизма, поэтому кинетическое уравнение более сложное.
http://www.chem.msu.su/rus/teaching/eremin/1-2.html
http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/HIMICHESKAYA_KINETIKA.html