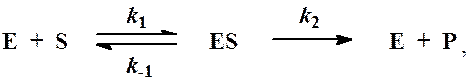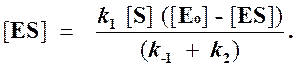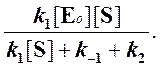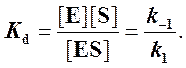Уравнение Михаэлиса-Ментен. Ингибирование ферментов
Страницы работы
Содержание работы
УРАВНЕНИЕ МИХАЭЛИСА —МЕНТЕН
Простейшей моделью для построения и обсуждения теорий ферментативной кинетики является кинетика односубстратных реакций. Хотя чаще всего в реакциях участвует не один, а большее число субстратов, реакцию можно рассматривать как односубстратную, если второй субстрат присутствует в очень большой концентрации. Большинство получаемых выводов можно использовать непосредственно при рассмотрении более сложных ферментативных реакций.
Как уже упоминалось, концентрация субстрата является одним из наиболее важных факторов, определяющих скорость ферментативной реакции.
В начале XX столетия Л. Михаэлисом и М. Ментен было предложено простейшее кинетическое выражение для скорости ферментативной односубстратной реакции.
Схема ферментативного процесса записывается следующим образом:
где Е — фермент; S — субстрат, подвергающийся ферментативной реакции; Р — образующийся в результате продукт;
Уравнение скорости ферментативной реакции, выведенное Михаэлисом и Ментен, предположивших, что превращение субстрата происходит только в переходном фермент-субстратном комплексе, основывается на двух предпосылках.
1. Реакция между ферментом и субстратом находится в равновесии. Это условие выполняется, если скорость распада комплекса на свободный фермент и субстрат значительно больше скорости распада его до свободного фермента и продукта (k-1 >> k2).
2. Концентрация свободного субстрата остается практически постоянной в течение начального периода реакции, тогда концентрация субстрата [S] может быть принята равной полной концентрации субстрата [So]. Это условие выполняется, если полная концентрация субстрата значительно больше полной концентрации фермента, как это обычно имеет место при кинетических исследованиях.
При высокой каталитической активности фермента реальное значение концентрации фермент-субстратного комплекса отличается от его значения в условиях равновесия. Для анализа кинетики реакции с учетом этого обстоятельства Бриггс и Холдейн предложили дополнить теорию Михаэлиса — Ментен условием стационарного состояния.
Согласно этому условию в любой момент реакции скорости образования и распада комплекса ES практически равны, так что концентрация комплекса [ES] может считаться постоянной (квазистационарной) в течение короткого периода времени, необходимого для измерения скорости. В течение более продолжительного периода времени концентрация комплекса [ES] будет изменяться по ходу реакции в связи с падением концентрации субстрата, но скорость изменения ее всегда будет существенно меньше, чем скорость ферментативной реакции.
Для стационарного состояния, при котором
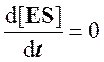

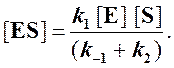
Из уравнения материального баланса для фермента
где [Eo] ─ его начальная концентрация, а [E] ─ текущая концентрация свободного, не связанного в фермент-субстратный комплекс белка, можно записать
и подставить в выражение (1):
Отсюда концентрация ES равна
[ES] =
Тогда начальная скорость ферментативной реакции, измеряемая по скорости образования продукта Р, равна
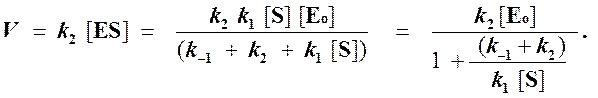
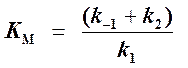
то выражение (2) можно записать в следующем виде:
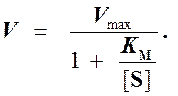
Выражение (3) называется уравнением Михаэлиса —Ментен и описывает зависимость скорости односубстратной ферментативной реакции от концентрации субстрата. Из этого уравнения видно, что при увеличении концентрации субстрата (при неизменной концентрации фермента) скорость реакции стремится к предельному значению, равному Vmax.
При выводе уравнения Михаэлиса — Ментен, кроме вышеперечисленных, принимается во внимание еще несколько не совсем реальных допущений, таких как:
1) отсутствие образования значимого количества комплекса ЕР и других форм фермента;
2) необратимость второй стадии реакции, т. е. образования продукта Р. Это связано с тем, что мы рассматриваем только начальную скорость процесса, когда обратной реакцией из-за фактического отсутствия продукта еще можно пренебречь;
3) связывание с активным центром на каждой субъединице фермента только одной молекулы субстрата;
4) использование для всех реагирующих веществ вместо активностей их концентраций.
Если k2 значительно меньше k-1, то этим членом в выражении константы Михаэлиса можно пренебречь, и КM становится равной отношению 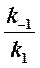
Таким образом, являясь аналогом константы диссоциации фермент-субстратного комплекса ES, константа Михаэлиса характеризует сродство фермента к субстрату. Чем ниже КM, тем выше сродство.
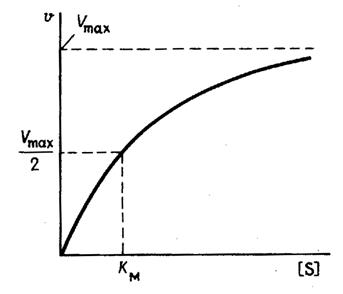
На рис. 1 приведено графическое изображение уравнения Михаэлиса — Ментен.
Рис. 1.Зависимость скорости ферментативной реакции от концентрации субстрата
Зависимость фермента от количества субстрата описывает ферментативная кинетика
Уравнения Михаэлиса-Ментен и Лайнуивера-Берка
Общую теорию ферментативной кинетики и зависимость активности фермента от субстрата.описали Л.Михаэлис и М.Л.Ментен, выразив его в своем уравнении. Бриггс и Холдейн усовершенствовали их уравнение, введя введя в него константу Михаэлиса (Km), определяемую экспериментально.
Уравнение Михаэлиса-Ментен показывает взаимосвязь максимально возможной скорости, реальной скорости реакции, константы Михаэлиса и концентрации субстрата. Так как пользоваться графиком, построенным в прямых координатах V и [S] для точных расчетов неудобно, то Г.Лайнуивер и Д.Бэрк преобразовали уравнение Бриггса–Холдейна в обратные координаты.
Уравнение Михаэлиса-Ментен
Уравнение Лайнуивера-Бэрка
На самом деле уравнение Михаэлиса-Ментен в данном виде предложили Бриггс и Холдейн, но в честь основоположников оно носит название Михаэлиса-Ментен.
Выделяют три основных решения уравнения Михаэлиса-Ментен:
1. Концентрация субстрата равна величине константы Михаэлиса ([S] = Km).
В этом случае, решая уравнение Михаэлиса-Ментен, получаем, что скорость реакции V будет равна половине максимальной Vmax.(V = ½ Vmax).
В математическом смысле Km соответствует концентрации субстрата при которой скорость реакции равна половине максимальной. Ее биологический смысл заключается в характеристике сродства фермента к субстрату, а именно: увеличение величины Кm означает снижение сродства фермента к субстрату.
2. Концентрация субстрата значительно больше Km ([S] >> Km). В этом случае величиной Km можно пренебречь, при решении получим, что скорость реакции максимальна (плато на графике).
3. Концентрация субстрата значительно меньше Km ([S]
Ферментативный катализ. Уравнение Михаэлиса-Ментена
Ферментами (энзимами) называются вещества белковой природы, которые ускоряют химические реакции, протекающие в клетках и тканях живого организма. Поэтому их еще называют биокатализаторами, а словами академика Павлова «возбудителями жизни».
Молекула фермента имеет чередующиеся полярные группы СООН, NH2, NH, OH, SH и др. и неполярные гидрофобные группы (первичная структура). Макромолекула фермента может изгибаться и свертываться в клубки с образованием внутримолекулярных водородных связей (вторичная структура белка). Сложные ферменты содержат ионы металлов с переменной степенью окисления (Fe, Cu), которые участвуют в окислительно-восстановительных реакциях. Ферменты классифицируют по типу катализируемой реакции: гидролазы (реакции гидролиза), изомеразы (изомерные превращения), оксиредуктазы (окислительно-восстановительные реакции). Активные центры фермента способны избирательно связывать молекулу реагирующего вещества (субстрата), образую с ней единый фермент-субстратный комплекс. Большое значение имеет геометрическое соответствие структур активного центра фермента и самого субстрата – «ключ-замок».
Активность ферментов в миллионы раз выше химических катализаторов.
Ферментативный катализ занимает промежуточное положение между гомогенным и гетерогенным катализом. Его отличительные черты: высокая каталитическая активность (малые количества фермента и высокие скорости), специфичность или селективность действия (один фермент ускоряет определенную реакцию), низкие температуры и сильное влияние рН среды и присутствия других веществ. Ингибиторами (I) называют вещества, осложняющие течение ферментативной реакции вследствие образования комплексов с ферментом или фермент-субстратным комплексом.
В фармацевтической продукции ферментные препараты занимают большую часть ассортимента. При инфекционных заболеваниях используются препараты, разрушающие оболочку болезнетворных бактерий. Широко известны препараты, применяемые при нарушениях функций желудочно-кишечного тракта, ферменты для рассасывания гнойных скоплений и тромбов, например, стрептокиназа.
Кинетика ферментативных реакций.
Скорость ферментативной (энзимной) реакции Vферм зависит от концентрации фермента СE и концентрации ресубстрата CS. Наблюдается прямо пропорциональная зависимость Vферм от от начальной концентрации С0,Е (первый порядок по ферменту). Зависимость Vферм от концентрации субстрата имеет нелинейный вид (рис.1), однако, при низких концентрациях субстрата порядок по субстрату первый, а при высоких – нулевой.
Зависимость скорости ферментативной реакции от концентрации субстрата
Определение константы Михаэлиса — Ментана графическим методом
Простейшая схема ферментативного катализа /1/ включает обратимое образование фермент-субстратного комплекса (ES), который необратимо превращается в продукт (Р)

Константа равновесия первой стадии выражена через константы скорости прямо (k1) и обратной реакции (k-1), а константа скорости второй стадии k2
http://biokhimija.ru/fermenty/fermentativnaya-kinetika.html
http://pandia.ru/text/80/238/10682.php