Расчеты горения
Расчеты горения ведут по химическим уравнениям реакций, используя законы газового состояния: Бойля – Мариотта 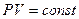
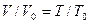
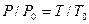
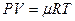
Рассмотрим реакцию горения водорода в кислороде: 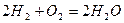
Рассмотрим реакцию горения метана в кислороде: 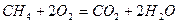
В практических условиях сжигание газа осуществляется в воздухе. Примем состав сухого воздуха: О2 – 21 %, N2 – 79%. Следовательно, 1 м 3 кислорода содержится в 100/21 = 4,76 м 3 воздуха. Или на 1 м 3 кислорода приходится 3,76 м 3 азота. Отсюда условная формула воздуха: (О2 + 3,76N2).
Запишем реакцию горения водорода в воздухе:
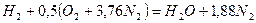
Из уравнения следует, что при нормальных условиях для полного сгорания 1 м 3 водорода требуется 0,5 × 4,76 = 2,38 м 3 воздуха. Таким образом, для сгорания 1 м 3 водорода требуется 2,38 м 3 воздуха. В результате образуются продукты сгорания: 1 м 3 воды в виде пара и 1,88 м 3 азота.
Запишем реакцию горения метана в воздухе:
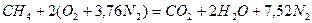
Из уравнения следует, что для полного сгорания 1 м 3 метана необходимо 2 × 4,76 = 9,52 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 метана требуется 9,52 м 3 сухого воздуха. Продукты сгорания содержат 1 м 3 диоксида углерода, 2 м 3 паров воды и 7,52 м 3 азота.
Запишем реакцию горения пропана в воздухе:
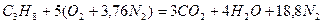
Из уравнения видно, что для полного сгорания 1 м 3 пропана необходимо 5 × 4,76 = 23,8 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 пропана требуется 23,8 м 3 сухого воздуха.
Приведенные расчеты выполнены для стехиометрических уравнений и полученные соотношения воздуха и газа называются стехиометрическими. Например, для горения метана в воздухе стехиометрическое соотношение – 9,52. В реальных условиях воздуха может не хватать для полного сгорания газа или, напротив, воздух подается в избыточном количестве. Для характеристики реальных соотношений воздуха и газа в процессе горения введена безразмерная величина: коэффициент избытка воздуха (окислителя) – коэффициент α. Для стехиометрического соотношения α = 1. Если имеет место недостаток воздуха, то α 1. Например, в процессе горения израсходовано 23 м 3 воздуха и 2 м 3 метана. Подсчитываем коэффициент α. Реальное соотношение воздуха и газа 23/2 = 11,5. Отсюда α = 11,5/9,52 = 1,2.
Выше показано, как можно подсчитывать необходимое количество воздуха для сгорания и определять объем продуктов сгорания для индивидуальных газов. Но обычно используемый газ – смесь различных газов. В этом случае расчет теоретически необходимого объема воздуха (воздуха сухого) ведется по формуле:
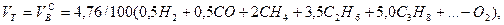
где 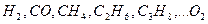
Используемый для сжигания атмосферный воздух содержит влагу, поэтому расчет объема влажного воздуха производят по формуле:
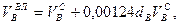
где 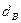
0,00124 – объем 1 г водяного пара.
И, наконец, определяется объем воздуха действительный с учетом величины коэффициента α по формуле:
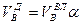
Пример. Имеется газ состава СН4 – 95%, С3Н8 – 5%. Определить объем воздуха действительного для сжигания данного газа при α = 1,1 и 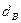

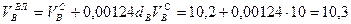
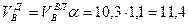
Объем продуктов сгорания газовой смеси определяется по следующим формулам.
Объем диоксида углерода
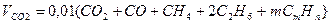
Объем водяных паров
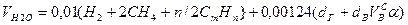
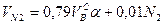
где N2 – процентное содержание азота в газовой смеси.
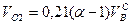
Суммарный объем продуктов сгорания

Дата добавления: 2015-06-22 ; просмотров: 8149 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Кислород горение расчеты по уравнениям
Рябов Химия 8 Решение задач Кислород
Рябов Химия 8 Решение задач Кислород — это цитаты (задачи) из Главы 2 «Кислород. Горение» пособия Сборник задач и упражнений по химии: 8-9 классы: к учебникам Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия. 8 кл.», «Химия. 9 кл». ФГОС (к новым учебникам) / М.А. Рябов. — М. : Издательство «Экзамен», 2016 . А также ответы и решения задач из указанного сборника.
Цитаты из вышеуказанного учебного пособия использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях (пп. 1 п. 1 ст. 1274 ГК РФ), при этом цитаты переработаны в удобный для пользователя формат. При постоянном использовании задач по химии в 8 классе необходимо купить книгу: Михаил Рябов: Химия. 8-9 классы. Сборник задач и упражнений. ФГОС / М.: Экзамен, 2018. Ответы и решения расчетных задач помогут родителям проверить правильность выполнения домашних заданий.
Ответы на расчетные задачи
2.5. Определите массу: а) 3 моль газообразного кислорода, б) 14 моль газообразного кислорода.
РЕШЕНИЕ: 
Ответ: а) 96 г, б) 448 г.
2.39. Определите массовую долю кислорода: а) в оксиде углерода(II), б) в оксиде азота(I), в) в оксиде фосфора(III), г) в оксиде кремния(IV).
РЕШЕНИЕ: 
Ответ: а) 0,571, б) 0,364, в) 0,436, г) 0,533.
2.40. Определите массовую долю кислорода: а) в серной кислоте H2SO4, б) в пероксиде водорода Н2O2, в) в карбонате кальция СаСО3, г) в сульфате меди CuSO4.
РЕШЕНИЕ: 
Ответ: а) 0,653, б) 0,941, в) 0,48, г) 0,40.
2.53. Определите массу кислорода, необходимую для окисления: а) 2 моль глюкозы, б) 45 г глюкозы.
РЕШЕНИЕ: 
Ответ: а) 384 г, б) 48 г.
2.55. Определите массу кислорода, необходимую для сжигания: а) 1 кг ацетилена, б) 3 моль ацетилена.
РЕШЕНИЕ: 
Ответ: а) 3,08 кг, б) 240 г.
2.56. Сколько (в кг) кислорода необходимо для полного сгорания: а) 80 кг метана СН4, б) 16 кг серы, в) 60 кг угля, г) 100 кг гептана С7Н16?
РЕШЕНИЕ: 
Ответ: а) 320 кг, б) 16 кг, в) 160 кг, г) 176 кг.
2.59. Какая масса кислорода была получена в ходе реакции фотосинтеза, если при этом: а) образовалось 90 г глюкозы, б) поглотилось 5 моль углекислого газа?
РЕШЕНИЕ: 
Ответ: а) 96 г, б) 160 г.
2.60. Какая масса углекислого газа поглотилась в ходе фотосинтеза, если: а) выделилось 160 г кислорода, б) образовалось 2 моль глюкозы?
РЕШЕНИЕ: 
Ответ: а) 220 г, б) 528 г.
2.92. Массовая доля кислорода в воздухе равна 0,231. Определите массу кислорода, который можно получить: а) из 1000 кг воздуха, б) из 600 г воздуха.
РЕШЕНИЕ: 
Ответ: а) 231 кг, б) 139 г.
2.93. Массовая доля кислорода в воздухе равна 0,231. Определите массу воздуха, необходимого для получения: а) 100 кг кислорода, б) 200 г кислорода.
РЕШЕНИЕ: 
Ответ: а) 433 кг, б) 866 г.
2.94. Определите массу воздуха с массовой долей кислорода, равной 0,231, необходимого для полного сгорания: а) 23 кг этилового спирта С2Н5ОН, б) 62 кг фосфора, в) 12 кг магния, г) 29 кг бутана С4Н10.
РЕШЕНИЕ: 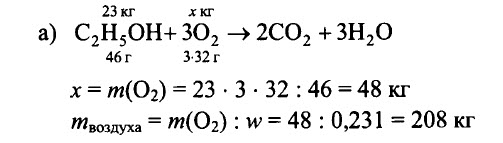
Ответ: а) 208 кг, б) 346 кг, в) 34,6 кг, г) 442 кг.
Рябов Химия 8 Решение задач Кислород
Следующий раздел «Рябов Химия 8 Решение задач Водород»
Разработка урока по химии «Решение задач по теме»Кислород. Горение»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Тема урока: «Решение задач по теме «Кислород. Горение.»
Тип урока: закрепление знаний и умений учащихся
Цели урока: 1. обобщить и закрепить знания учащихся в решении задач по теме «Кислород. Горение»;
2. развивать умение анализирования заданий, нахождения способа решения задач;
3. привитие интереса к дальнейшему развитию науки.
Оборудование: презентация, карточки с заданиями; маркеры, ватман, клей, воздушные шары для заданий, корзина
Сообщение темы и целей урока.
Деление учащихся на группы
На интерактивную доску выводятся вопросы. От каждой команды один представитель выбирает вопрос. Если группа не отвечает на этот вопрос правильно, то ответ могут дать другие группы
Кем и когда был открыт кислород?
Назовите физические свойства кислорода.
Из приведенных ниже веществ определите те, из которых в лаборатории получают кислород: CaCO 3 , KClO 3 , Na 2 O , H 2 O , KMnO 4 , BaSO 4 , H 2 O 2 , K 3 PO 4
Каким образом можно проверить наличие кислорода в пробирке?
Нахождение кислорода в природе. Как пополняется запас кислорода в воздухе?
О чем идет речь в данных предложениях:
А) Кислород – газ, не имеющий цвета и запаха, необходим для дыхания живых организмов.
Б) В ПС кислород занимает 8 номер, его атомная масса равна 16.
№ 1. Вычисление массовой доли элемента.
Определите, в каком из этих веществ массовая доля кислорода больше: CO , NO , Н 2 О.
№ 2. Задачи на определение количества вещества
Определите, какую массу занимает кислород О 2 объемом 16л при н.у.( V m =22,4л/моль)
Определите число атомов кислорода О 2 , масса которого равна 5г ( N A = 6,02·10 23 моль -1 )
Ответ: 1. m (О 2 ) =22.7 г (23г) 2. N (О 2 )=0,96·10 23 = 9,6·10 22
Каждая группа получает конверт с разрезанными уравнениями реакций. Необходимо правильно составить уравнения реакций и расставить коэффициенты
№ 4. Решение задач по уравнению химической реакции
Определите массу кислорода O 2 необходимого для сжигания 8 г магния. (Ответ: 5,3г)
Сколько граммов оксида меди (II) С uO образовалось при сгорании 6,4 г меди в кислороде. (Ответ: 8г)
Сколько грамм сульфида алюминия Al 2 S 3 можно получить при взаимодействии 2,7 г алюминия с серой. (Ответ: 7,5г)
Подсчитывают баллы в листах оценивания
На стикерах учащиеся пишут отзывы об уроке и крепят на доску на соответствующую ступень
– все смог решить, могу помочь другу
– смог решить не все, нужно повторить
3 – не смог решить, нужна помощь друга
Повторить §§ 31-38, № , стр. .
Лист оценивания уч-ся _____ класса
Лист оценивания уч-ся _____ класса
Активность на уроке
Активность на уроке
Работа в группе
Работа в группе
Задачи на определение количества вещества
Задачи на определение количества вещества
Решение задач по уравнению химической реакции
Решение задач по уравнению химической реакции
Лист оценивания уч-ся _____ класса
Лист оценивания уч-ся _____ класса
Активность на уроке
Активность на уроке
Работа в группе
Работа в группе
Задачи на определение количества вещества
Задачи на определение количества вещества
Решение задач по уравнению химической реакции
Решение задач по уравнению химической реакции
Лист оценивания уч-ся _____ класса
Лист оценивания уч-ся _____ класса
Активность на уроке
Активность на уроке
Работа в группе
Работа в группе
Задачи на определение количества вещества
Задачи на определение количества вещества
Решение задач по уравнению химической реакции
Решение задач по уравнению химической реакции
Лист оценивания уч-ся _____ класса
Лист оценивания уч-ся _____ класса
Активность на уроке
Активность на уроке
Работа в группе
Работа в группе
Задачи на определение количества вещества
Задачи на определение количества вещества
Решение задач по уравнению химической реакции
Решение задач по уравнению химической реакции
Сколько грамм сульфида алюминия Al 2 S 3 можно получить при взаимодействии
2,7 г алюминия с серой.
Сколько граммов оксида меди (II) С uO образовалось при сгорании 6,4 г меди в кислороде.
Определите, в каком из этих веществ массовая доля кислорода больше: CO , NO , Н 2 О.
Определите, в каком из этих веществ массовая доля кислорода больше: CO , NO , Н 2 О.
Определите, в каком из этих веществ массовая доля кислорода больше: CO , NO , Н 2 О.
Определите, какую массу занимает кислород О 2 объемом 16л при н.у. ( V m =22,4л/моль)
Определите число атомов кислорода О 2 , масса которого равна 5г ( N A = 6,02·10 23 моль -1 )
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 945 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 25 человек из 16 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 40 человек из 24 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 591 495 материалов в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
«Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников»
Свидетельство и скидка на обучение каждому участнику
Другие материалы
- 14.02.2018
- 340
- 0
- 14.02.2018
- 172
- 0
- 14.02.2018
- 753
- 2
- 14.02.2018
- 657
- 0
- 14.02.2018
- 1174
- 27
- 14.02.2018
- 6050
- 43
- 14.02.2018
- 349
- 0
- 14.02.2018
- 353
- 0
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 14.02.2018 2040
- DOCX 21.2 кбайт
- 19 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Бабаян Елена Размиковна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 7 лет
- Подписчики: 1
- Всего просмотров: 59277
- Всего материалов: 31
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Школьник из Сочи выиграл международный турнир по шахматам в Сербии
Время чтения: 1 минута
В Курганской области дистанционный режим для школьников продлили до конца февраля
Время чтения: 1 минута
В Белгородской области отменяют занятия в школах и детсадах на границе с Украиной
Время чтения: 0 минут
РДШ организовало сбор гуманитарной помощи для детей из ДНР
Время чтения: 1 минута
Курские власти перевели на дистант школьников в районах на границе с Украиной
Время чтения: 1 минута
В приграничных пунктах Брянской области на день приостановили занятия в школах
Время чтения: 0 минут
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
http://uchitel.pro/%D1%80%D1%8F%D0%B1%D0%BE%D0%B2-%D1%85%D0%B8%D0%BC%D0%B8%D1%8F-8-%D1%80%D0%B5%D1%88%D0%B5%D0%BD%D0%B8%D0%B5-%D0%B7%D0%B0%D0%B4%D0%B0%D1%87-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4/
http://infourok.ru/razrabotka-uroka-po-himii-reshenie-zadach-po-temekislorod-gorenie-2604216.html




