Расчет коэффициентов активности
ГОУ ВПО «Уральский государственный технический университет — УПИ имени первого Президента России »
Кафедра технологии электрохимических производств
Расчет коэффициентов активности
Методические указания для выполнения курсовой работы по дисциплине «Введение в теорию растворов электролитов»
для студентов, обучающихся по
направлению 240100 – химическая технология и биотехнология (профиль технология электрохимических производств)
профессор, д-р хим. наук
профессор, д-р хим. наук ,
Научный редактор профессор д-р хим. наук Ирина Борисовна Мурашова
Расчет коэффициентов активности: Методические указания для выполнения расчетной работы по дисциплине «Введение в теорию растворов электролитов»/ , . Екатеринбург: УГТУ-УПИ 2009.12с.
В методических указаниях излагаются основы расчета коэффициентов активности. Показана возможность расчета этой величины на основе различных теоретических моделей.
Библиогр.: 5 назв. 1 Табл.
Подготовлено кафедрой «Технология электрохимических производств».
ОГЛАВЛЕНИЕ
Современные представления о механизме образования растворов электролитов. Равновесные электроды
Варианты заданий на курсовую работу
ВВЕДЕНИЕ
Теоретические представления о строении растворов впервые были сформулированы в теории электролитической диссоциации Аррениуса:
1. Электролитами называются вещества, которые при растворении в соответствующих растворителях (например, вода) распадаются (диссоциируют) на ионы. Процесс называется электролитической диссоциацией. Ионы в растворе представляют собой заряженные частиц, которые ведут себя подобно молекулам идеального газа, то есть не взаимодействуют друг с другом.
2. Не все молекулы распадаются на ионы, а только некоторая доля б, которая называется степенью диссоциации

Коэффициент активности можно определить по уравнению
Глава 3. ЭЛЕКТРОЛИТЫ
3.1.Теоретическая часть
Электролитами называются вещества, обладающие электропроводностью за счет движения ионов. Подвижные ионы, которые осуществляют электропроводность, могут образоваться двумя путями:
- За счет растворения или плавления ионных соединений. Ионными являются в основном соединения щелочных и щелочноземельных металлов с неметаллами; а также фториды, оксиды и соли оксокислот большинства металлов с валентностью не более IV. Например, ионными веществами можно считать MgO, CaF2, FeSO4, NaCl, Ca(NO3)2.
- За счет химической реакции ковалентных соединений с растворителем. Например, при взаимодействии хлороводорода с водой идет реакция:
HCl + H2O = H3O + + Cl —
Образование подвижных ионов при растворении вещества принято называть электролитической диссоциацией данного вещества.
Диссоциация может быть необратимой и обратимой. В первом случае электролит называется сильным, во втором — слабым.
Сильными электролитами являются все соли щелочных и щелочноземельных металлов, их гидроксиды, а также некоторые кислоты. Например, NaCl, Ca(OH)2, HCl.
Слабыми электролитами оказывается большинство кислот и гидроксидов металлов (за исключением гидроксидов щелочных и щелочноземельных металлов). Например, Al(OH)3, H3PO4, CH3СOOH и многие другие.
В растворах сильных электролитов диссоциация необратима. Поэтому концентрации ионов в их растворах равны концентрации растворенного вещества с учетом коэффициентов в формуле соединения. Например, в 0,1 М растворе NaCH3COO концентрации обоих ионов также равны 0,1 моль/л, а в 0,1 М растворе Al2(SO4)3 С(Al 3+ ) = 0,2 моль/л, а С(SO4 2– ) = 0,3 моль/л.
При диссоциации кислот и оснований в водных растворах образуются соответственно ионы H + и OH – . Произведение их концентраций представляет собой константу диссоциации воды:
H2O 
Kв = [H + ] . [OH – ] 10 –14 (3.2)
Эта константа называется также ионным произведением воды. При комнатной температуре она приблизительно равна 10 –14 и увеличивается до 5,5. 10 –13 при 100 o С.
Из уравнения (3.2) следует, что, зная одну из концентраций [H + ] или [OH – ] в любом водном растворе, можно вычислить другую.
Концентрацию ионов водорода в растворе принято описывать с помощью водородного показателя рН, равного десятичному логарифму их концентрации, взятому с обратным знаком:
Аналогично можно ввести и величину рОН = –lg С(ОH – ).
Из уравнения (3.2) очевидно, что при комнатной температуре рН + рОН = 14 (3.4)
В 0,01 М растворе сильной кислоты, например HCl, должно быть рН = -lg 0,01 = 2.
Однако такой расчет не учитывает влияния взаимодействия между ионами в растворе на его свойства. Для более точного описания свойств растворов вместо концентраций необходимо использовать активности ионов: а = fC . (3.5)
В этой формуле а — активность, С — молярная концентрация, f — коэффициент активности иона.
Коэффициент активности зависит от концентраций всех ионов, присутствующих в растворе, т.е. от так называемой ионной силы раствора µ, вычисляемой по формуле:
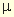
Здесь Сi — молярная концентрация i-го иона и Zi — его заряд.
В разбавленных растворах (с ионной силой 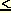
lgfi = -0,5Zi 2 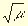
Например, в 0,01 M растворе соляной кислоты ионная сила
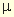
соответственно коэффициент активности ионов H +
lg f(Н + ) = -0,5Z 2 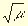
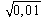
Коэффициент активности хлорид-иона в этом случае такой же.
С учетом коэффициента активности значение рН = -lg a(H + ) равно -lg[C(H + )•f] = -lg(0,01•0,89) = 2,05.
Сравнение значений рН, вычисленных с использованием концентраций и активностей показывает, что для 0,01 М раствора HCl они достаточно близки. Их отличие не превышает ошибки экспериментального измерения pH (±0,05). Следовательно, влиянием ионной силы на рН разбавленных растворов можно пренебречь.
В растворах более высокой концентрации различия становятся заметными, но теоретический расчет коэффициента активности сильно усложняется. Поэтому, на практике, во всех расчетах, кроме наиболее ответственных, вместо активностей применяют концентрации, хотя это и вносит определенную ошибку.
В растворах слабых электролитов диссоциация обратима и существует равновесие между недиссоциированными молекулами и ионами:
CH3COOH 
которое описывается соответствующей константой, называемой константой диссоциации Kд.:
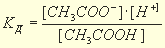
Значения констант диссоциации слабых электролитов определены экспериментально и приведены в справочниках. Чем константа меньше, тем слабее электролит. Для сильных электролитов константы отсутствуют, т. к. их диссоциация необратима.
Если молекула слабого электролита состоит более чем из двух ионов, то его диссоциация идет по ступеням, и каждая ступень характеризуется своей константой диссоциации:
H2S 
HS — 
Бывает, что по первой ступени диссоциации электролит ведет себя как сильный, а по остальным — как слабый, например,
H2SO4 = H + + HSO4 — (диссоциация необратима)
HSO4 
Степень диссоциации и константа диссоциации слабого электролита связаны между собой соотношением:
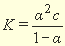
где -степень диссоциации, K — константа диссоциации, С -общая концентрация электролита.
При малой величине степени диссоциации ( ; + в растворе слабой кислоты. В 0,1 М растворе уксусной кислоты концентрация ионов водорода равна 0,0013 моль/л, а в 1 М — 0,0042 моль/л. Однако при очень высоких концентрациях (80–100% кислоты) диссоциация начинает ослабляться из-за низкой концентрации воды, являющейся участником процесса диссоциации. Поэтому концентрация ионов водорода в растворах кислот, смешивающихся с водой в любых соотношениях, проходит через максимум, соответствующий чаще всего 20–30% кислоты.
Добавление к раствору слабого электролита продуктов его диссоциации, т. е. соответствующих катионов или анионов, в соответствии с принципом Ле Шателье подавляет диссоциацию. Такие растворы, например смесь уксусной кислоты и ее соли или аммиака и соли аммония, обладают интересным и практически важным свойством поддерживать определенное значение pH, слабо меняющееся при изменении концентрации и добавлении других кислот и оснований. Они получили название буферных растворов.
Температурная зависимость степени диссоциации слабого электролита определяется, в соответствии с принципом Ле Шателье энтальпией этого процесса. У большинства электролитов она мала, так что их диссоциация от температуры зависит слабо. Исключение составляет вода, энтальпия диссоциации которой равна почти 60 кДж/моль. Большая величина и положительный знак энтальпии диссоциации воды приводят к существенному возрастанию с температурой ее константы диссоциации (ионного произведения).
Ионы, образовавшиеся при электролитической диссоциации, могут участвовать в разнообразных химических реакциях. Эти реакции оказываются обратимыми и в них устанавливаются равновесия, если как среди исходных веществ, так и среди продуктов имеются слабые электролиты, устойчивые комплексные ионы, осадки или газы. Примерами таких равновесий могут служить:
- Взаимодействие ацетат-иона с водой
CH3COO – + H2OCH3COOH + OH – (3.13)
обратимо благодаря присутствию двух слабых электролитов: слева — воды, справа- уксусной кислоты. - Реакция
AgClк + 2NH3[Ag(NH3)2] + + Cl – (3.14)
обратима благодаря присутствию слева малорастворимой соли AgCl, а справа — устойчивой комплексной частицы [Ag(NH3)2] + . - Равновесие ZnS + 2H +
Zn 2+ + H2S
(3.15)
устанавливается в закрытой системе в связи с наличием среди исходных веществ осадка сульфида цинка, а среди продуктов газообразного сероводорода.
Первый из приведенных примеров является частным случаем гидролиза солей, т.е. взаимодействия ионов солей с водой, обратного реакции нейтрализации. Его удобно рассматривать как кислотно-основное равновесие в рамках теории Брёнстеда. Согласно этой теории:
Кислотой называется молекула или ион — донор протона, например, H3O + , H2S, Al(H2O)6 3+ .
Основанием называется молекула или ион — акцептор протона, например, OH — , NH3, PO4 3- , Al(OH)6 3- .
Амфолитом называется молекула или ион, которые могут быть как донором, так и акцептором протона, например H2O, HS — , HPO4 – .
При таком подходе гидролиз солей — это взаимодействие ионов солей, выступающих в качестве кислот или оснований, с водой, являющейся амфолитом.
Примером кислоты по Бренстеду является гидратированный катион, который отщепляет протон от своей гидратной оболочки, например:
Al(H2O)6 3+ + H2O 
Для упрощения уравнение (3.16) записывают так:
Al 3+ + H2O 
Примером основания по Бренстеду является анион: S 2- + H2O 
Из реакций (3.17) и (3.18) видно, что соли слабых оснований при гидролизе создают кислую среду, а соли слабых кислот — щелочную.
Реакции гидролиза обратимы, поэтому их равновесие описывается соответствующей константой — константой гидролиза Кг:
для гидролиза катиона 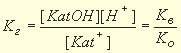
для гидролиза аниона 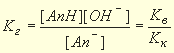
Чем слабее кислота или основание, образующие соль, тем больше константа гидролиза и тем большее количество ионов Н + и ОН – образуется. Поэтому измерение pH растворов солей может служить простым и надежным способом определения силы образующей их кислоты или основания.
Равновесие гидролиза (3.17), (3.18), как правило, смещено влево, так как вода является более слабым электролитом, чем подавляющее большинство кислот и оснований. Оно смещается вправо при разбавлении раствора и при повышении температуры, поскольку с ростом температуры увеличивается Кв, а константы диссоциации большинства слабых кислот и оснований от температуры зависят мало.
Равновесие гидролиза может быть полностью смещено вправо, если гидролизу подвергается как катион, так и анион соли, особенно, когда получающиеся кислота или основание являются малорастворимыми, летучими или неустойчивыми, например,
Al2S3 + 6H2O = 2Al(OH)3 
2Al 3+ + 3CO3 2– + 3H2O = 2Al(OH)3 
Поэтому соли, образованные такими кислотами и основаниями, либо не существуют вообще (карбонаты алюминия, трехвалентного хрома и железа), либо полностью разлагаются водой, хотя и могут быть получены в безводной среде (сульфид алюминия).
Ионные реакции с участием малорастворимых соединений (3.14), (3.15) связаны с константами, определяющими растворимость этих соединений и с константами устойчивости продуктов реакции. Равновесие осадка малорастворимого сильного электролита с раствором:
KtAnк 
описывается константой равновесия, которая называется произведением растворимости ПР:
ПР = a(Kt + ) . a(An – ) [Kt + ][An – ] (3.22)
Поскольку насыщенный раствор малорастворимого электролита является весьма разбавленным, активности ионов равны их концентрациям. Произведения растворимости малорастворимых электролитов табулированы.
Если в каком-либо растворе произведение текущих концентраций ионов [Kt + ][An – ] меньше ПР, то осадок растворяется, если [Kt + ][An – ] > ПР, то он выпадает.
Изменение концентраций ионов в растворе можно осуществить прибавлением одного из них (тогда растворимость вещества понижается) или удалением их из раствора в виде газа, комплексного соединения, менее растворимого вещества и др., тогда происходит растворение осадка. Поэтому многие малорастворимые соли слабых кислот (угольной, сероводородной, щавелевой и других) растворяются в сильных кислотах. При этом ионы кислотного остатка реагируют с протонами, давая молекулы кислот или анионы кислых солей, которые почти всегда более растворимы, чем средние соли тех же катионов.
Для хорошо растворимых соединений из-за большой ионной силы их насыщенных растворов рассчитать активности ионов и, следовательно, вычислить произведение растворимости невозможно.
В то же время равновесие хорошо растворимой кристаллической соли с ее насыщенным раствором существует и подчиняется всем общим законам смещения химического равновесия. В частности, если растворение идет с поглощением теплоты, то растворимость увеличивается с повышением температуры и наоборот.
Большинство равновесий в растворах электролитов устанавливается практически мгновенно. Поэтому ионные реакции в растворах, особенно с участием комплексных соединений, служат удобной моделью для изучения общих законов смещения химического равновесия. Дополнительным преимуществом их является то, что многие комплексные частицы имеют яркие и разнообразные цвета, что позволяет судить о смещении равновесия визуально, по появлению или изменению окраски раствора.
Например, по усилению или ослаблению ярко-красной окраски иона роданида железа (III) [Fe(SCN)6] 3– можно судить о смещении равновесия при различных воздействиях:
Fe 3+ + 6SCN – 
По изменению окраски раствора можно судить и о равновесии реакции
[Co(H2O)6] 2+ + 4Cl – 
В этой реакции участвуют гидратированные ионы и, следовательно, вода является непосредственным ее участником. Замена воды на другой растворитель, к примеру, спирт, приводит к смещению равновесия.
Как и на любое другое равновесие , на равновесие (3.24) оказывает влияние температура. Повышение ее смещает равновесие в сторону эндотермической реакции.
2.1.1.Вопросы по теме.
- Являются ли электролитами следующие вещества: a) HClг, б) H2SO4р-р, в) NaClж, г) NaNO3,кр., д) H2Sр-р, е) CO2р-р, ж) NH3,р-р, з) H2O, и) BaSO4,к, к) Al(OH)3,р-р, л) C2H5OHж,? (Обозначения в виде нижних индексов: г — газ, газообразный; ж — жидкость, жидкий, расплав; к — кристаллический; р-р — водный раствор.)
- Среди растворов нижеперечисленных веществ укажите сильные и слабые электролиты: a) HCl, б) H2SO4, в) NaCl, г) NaNO3, д) H2S, е) CO2, ж) NH3, з) BaSO4, и) Al(OH)3, к) C2H5OH, л) Н3РО4.
- От каких факторов зависит степень диссоциации электролита?
- Среди нижеперечисленных электролитов укажите те, pH растворов которых изменится при прибавлении одноименного аниона: а) HNO3, б) CH3COOH, в) H3PO4, г) NaCl, д) Na3PO4, е) NH4Cl, ж) CuSO4. Если рН изменится, то он увеличится или уменьшится?
- Среди тех же электролитов укажите те, pH растворов которых изменится при прибавлении одноименного катиона. Если рН изменится, то он увеличится или уменьшится?
- Приведите по два примера растворов, прибавление к которым одноименных ионов изменит (в какую сторону?) и не изменит рН растворов.
- Какие ионы в растворах Al2(SO4)3, NaNO2, Na2CO3, FeCl3 являются кислотами или основаниями по Бренстеду?
- Какие факторы влияют на степень гидролиза?
- Какая связь существует между растворимостью и ПР? Приведите два примера веществ, зная растворимость которых, можно вычислить ПР.
- Как изменится растворимость при введении в раствор малорастворимого электролита соли с одноименным ионом и соли, не имеющей с электролитом одинаковых ионов?
- Почему сульфат бария не растворяется в концентрированной серной кислоте, а сульфат свинца растворяется?
Шпаргалки к экзаменам и зачётам
студентам и школьникам
Ответы к экзамену по физической химии для аспирантов — Активность ионов. Ионная сила раствора
Cмотрите так же.
Электрохимия
Активность ионов. Ионная сила раствора. Зависимость коэффициента активности иона от ионной силы раствора. Теория Дебая-Хюккеля.
Активность (ионов) — эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе. Активность отличается от концентрации на некоторую величину. Отношение активности (а) к концентрации вещества в растворе (с, в г-ион/л) называется коэффициентом активности: γ = a/c.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
где cB — молярные концентрации отдельных ионов (моль/л), zB заряды ионов
Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная сила раствора. Для электролитов, в которых присутствуют многозарядные ионы, ионная сила обычно превышает молярность раствора.
Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая — Хюккеля. Основное уравнение этой теории (предельный закон Дебая — Хюккеля) показывает связь между коэффициентом активности иона ze и ионной силы раствора I в виде: 
Отношение активности (a) к общей концентрации вещества в растворе (c, в моль/л), то есть активность ионов при концентрации 1 моль/л, называется коэффициентом активности:
В бесконечно разбавленных водных растворах неэлектролитов коэффициент активности равен единице. Опыт показывает, что по мере увеличения концентрации электролита величины f уменьшаются, проходят через минимум, а затем снова увеличиваются и становятся существенно большими единицы в крепких растворах. Такой ход зависимости f от концентрации определяется двумя физическими явлениями.
Первое особенно сильно проявляется при малых концентрациях и обусловлено электростатическим притяжением между противоположно заряженными ионами. Силы притяжения между ионами преобладают над силами отталкивания, т.е. в растворе устанавливается ближний порядок, при котором каждый ион окружен ионами противоположного знака. Следствием этого является усиление связи с раствором, что находит отражение в уменьшении коэффициента активности. Естественно, что взаимодействие между ионами возрастает при увеличении их зарядов.
При возрастании концентрации все большее влияние на активность электролитов оказывает второе явление, которое обусловлено взаимодействием между ионами и молекулами воды (гидратацией). При этом в относительно концентрированных растворах количество воды становится недостаточным для всех ионов и начинается постепенная дегидратация, т.е. связь ионов с раствором уменьшается, следовательно, увеличиваются коэффициенты активности.
Известны некоторые закономерности, касающиеся коэффициентов активности. Так, для разбавленных растворов (приблизительно до m = 0,05) соблюдается соотношение 1 — f = k√m. В несколько более разбавленных растворах (т ≈ 0,01) величины f не зависят от природы ионов. Это обусловлено тем, что ионы находятся на таких расстояниях друг от друга, на которых взаимодействие определяется только их зарядами.
При более высоких концентрациях наряду с зарядом на величину активности начинает оказывать влияние и радиус ионов.
Для оценки зависимости коэффициентов активности от концентрации в растворах, где присутствует несколько электролитов, Г. Льюис и М. Рэндалл ввели понятие о ионной силе I, которая характеризует интенсивность электрического поля, действующего на ионы в растворе. Ионная сила определяется как полусумма членов, полученных умножением моляльностей каждого иона mi на квадрат его валентности Zi:
ДЕБАЯ — ХЮККЕЛЯ ТЕОРИЯ, статистич. теория разбавленных растворов сильных электролитов, позволяющая рассчитать коэф. активности ионов. Основана на предположении о полной диссоциации электролита на ионы, которые распределены в растворителе, рассматриваемом как непрерывная среда. Каждый ион действием своего электрич. заряда поляризует окружение и образует вокруг себя некоторое преобладание ионов противоположного знака — т. наз. ионную атмосферу. В отсутствие внеш. электрич. поля ионная атмосфера имеет сферич. симметрию и ее заряд равен по величине и противоположен по знаку заряду создающего ее центр. иона. Потенциал j суммарного электрич. поля, создаваемого центр. ионом и его ионной атмосферой в точке, расположенной на расстоянии r от центр. иона, м.б. рассчитан, если ионную атмосферу описывать непрерывным распределением плотности r заряда около центр. иона. Для расчета используют ур-ние Пуассона (в системе СИ):
где n2-оператор Лапласа, e — диэлектрич. проницаемость растворителя, e0 — электрич. постоянная (диэлектрич. проницаемость вакуума). Для каждого i-го сорта ионов r описывается ф-цией распределения Больцмана; тогда в приближении, рассматривающем ионы как точечные заряды (первое приближение Д.-Х.т.), решение ур-ния Пуассона принимает вид: 
В отсутствие внешнего электрического поля ионная атмосфера имеет сферическую симметрию, и её заряд равен по величине и противоположен по знаку заряду создающего её центрального иона. В этой теории не уделено почти никакого внимания образованию пар противоположно заряженных ионов путём непосредственного взаимодействия между ними.
http://www.chem.msu.su/rus/teaching/general/praktika/part3.html
http://spargalki.ru/himia/40-fizicheskaya-himia.html?start=9

 (3.15)
(3.15) 



