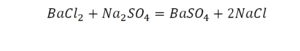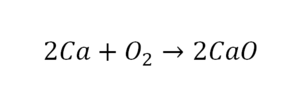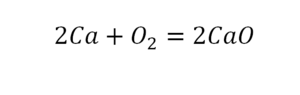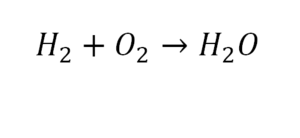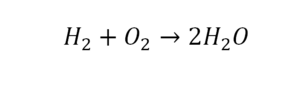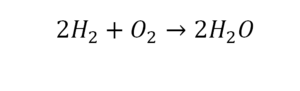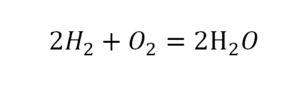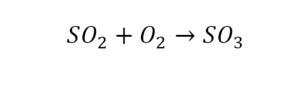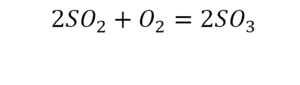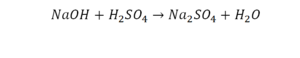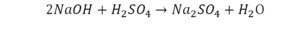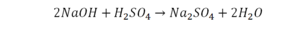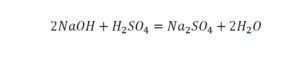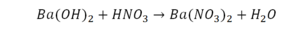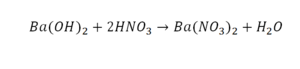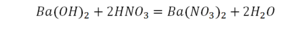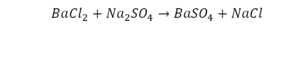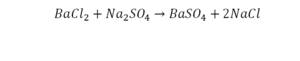Коэффициент это цифра в уравнении обозначающая число частиц
Ключевые слова конспекта: химическая формула, индекс, коэффициент, качественный и количественный состав, формульная единица.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.

Если требуется обозначить не одну, а несколько молекул (или отдельных атомов), то перед химической формулой (или знаком) ставят соответствующую цифру, которую называют коэффициентом. Например, три молекулы воды обозначаются 3Н2О, пять атомов железа — 5Fe. Индекс 1 в химических формулах и коэффициент 1 перед химическими символами и формулами не пишут.
Представленные на рисунке формулы читаются так: три-купрум-хлор-два, пять-алюминий-два-о-три, три-феррум-хлор-три .
Запись 5Н2О (пять-аш-два-о) следует понимать так: пять молекул воды образованы десятью атомами водорода и пятью атомами кислорода.
| ЗАДАНИЕ. Обозначить, используя символы химических элементов а) три молекулы азота б) семь молекул сульфида железа в) четыре атома серы г) два атома кальция д) семь молекул воды е) четыре молекулы кислорода ж) две молекулы сернистой кислотыОТВЕТ: а) три молекулы азота — 3N2 б) семь молекул сульфида железа — 7FeS в) четыре атома серы — S4 г) два атома кальция — Ca2 д) семь молекул воды — 7H2O е) четыре молекулы кислорода — 4O2 ж) две молекулы сернистой кислоты — 2H2SO3Объяснение: коэффициенты показывают количество молекул, индексы — количество атомов. Формулы молекул простых веществ нужно запомнить. Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие. Из двухатомных молекул состоят водород H2, кислород O2, азот N2, галогены F2, Cl2, Br2, I2. Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4. |
По химической формуле мы можем дать веществу название, определить его качественный и количественный состав, а также подсчитать его относительную молекулярную массу.Химическая формула показывает, из атомов каких элементов состоит вещество (то есть качественный состав вещества); и каково соотношение атомов этих элементов (то есть количественный состав вещества).
Формульная единица
Химические формулы веществ, имеющих немолекулярное строение, например FeS, не описывают состав молекулы; а только показывают соотношение элементов, образующих данное вещество.
Так, кристаллическая решётка поваренной соли — хлорида натрия состоит не из молекул, а из ионов. На каждый положительно заряженный ион натрия в ней приходится один отрицательно заряженный ион хлора. Получается, что отношение индексов в записи NaCl совпадает с отношением; в котором химические элементы соединяются между собой, образуя вещество. По отношению к веществам, имеющим немолекулярное строение, такую запись правильнее называть не формула, а формульная единица.
В таком случае величина Мr должна называться не относительной молекулярной массой, а относительной формульной массой. Тем не менее по традиции выражение «относительная молекулярная масса» используют и по отношению к веществам немолекулярного строения.
Конспект урока «Химическая формула. Индекс и коэффициент. Формульная единица«.
Уравнения химических реакций
Уравнение химической реакции – это описание химической реакции с помощью химических формул.
Уравнение химической реакции состоит из двух частей, соединенных знаком равенства. Слева от знака равенства приводятся формулы исходных веществ, а справа – формулы веществ, образующихся в результате реакции, или продуктов реакции. Уравнения показывают не только какие вещества вступают в реакцию, и какие получаются в результате, но и указывают на их количество.
Число атомов каждого элемента в левой и правой частях реакции должно быть одинаковым.
Цифра, стоящая перед формулой любого химического вещества в уравнении химической реакции и показывающая число частиц (а также количество частиц), обозначенных химическойформулой называется стехиометрическим коэффициентом.
Подбор коэффициентов в химических уравнениях осуществляется с помощью простых рассуждений. После того, как написаны формулы исходных веществ и продуктов реакции, расставляются соответствующие стехиометрические коэффициенты. При этом добиваются равенства числа атомов в левой и правой частях уравнения.
Для нахождения неизвестного количества вещества по уравнениям реакций и известному количеству одного из участников реакции, составляют соответствующие пропорции.
Например, требуется определить число моль атомов водорода, необходимое для получения пяти моль молекул водорода по реакции, представленной следующим уравнением:
Из уравнения реакции следует, что из двух атомов (двух моль атомов) водорода образуется одна молекула (один моль молекул) водорода.
2 моль атомов Н — 1 моль молекул Н2,
х моль атомов H — 5 моль молекул Н2.
следует, что для получения 5 моль молекул водорода требуется 10 моль атомов водорода.
x = 5 · 2/1 = 10 моль.
Вопросы для самоконтроля по теме
«Первоначальные понятия химии»
1. Что изучает химия?
2. Что такое вещество?
3. Что такое материя?
4. Каковы основные положения атомно-молекулярного учения?
5. Дайте определение понятиям: а) атом, б) молекула,
в) химический элемент.
6. Что отличает один химический элемент от другого?
7. Что такое химический знак (символ элемента) и что он обозначает?
8. Что обозначает химическая формула?
9. Дайте определение понятиям: а) простое вещество, б) сложное вещество.
10. Какое явление называется аллотропией? Чем оно вызвано?
11. Чем отличаются химические явления от физических?
12. Чем отличается чистое вещество от смеси веществ?
13. Какие признаки химических реакций Вам известны?
14. Что называется абсолютной массой атома? Какой порядок имеют величины абсолютных масс атомов в граммах?
15. Что называется относительной атомной массой?
16. Что такое атомная единица массы?
17. Как можно вычислить абсолютные и относительные молекулярные массы?
18. Что такое моль?
19. Чему равно число Авогадро? Что оно обозначает?
20. Что такое молярная масса? Какова ее размерность?
21. Какой зависимостью связаны между собой масса (m), молярная масса (М) и количество вещества (ν)?
22. Что такое качественный состав вещества?
23. Что такое количественный состав вещества? Какими способами его можно выразить?
24. Как определяется массовая доля элемента в сложном веществе?
25. Что такое валентность?
26. Что такое степень окисления? Чему равна сумма степеней окисления всех атомов в молекуле химического вещества?
Примеры комплексных тестов для самоконтроля знаний
По теме «Первоначальные понятия химии»
Вариант № 1
1. В каком числе случаев упоминаются простые вещества:
олеум*, вода, железо, мел, сера, сахар, графит?
2. Под каким номером приведена запись, изображающая 2 моль молекул воды:
1. Н2О, 2. 2Н2О2, 3. Н2О2, 4. 2Н2О?
3. Под каким номером приведено округленное значение относительной молекулярной массы хлора:
1. 17, 2. 35,5, 3. 71 г/моль, 4. 71 г, 5. 71?
4. В массе 1 грамм какого из перечисленных ниже веществ, содержится наибольшее количество этого вещества (в молях)? В ответе укажите номер, под которым расположена формула этого вещества.
1. Н2, 2. Н2Те, 3. НF, 4. СO2, 5. NO2.
5. Массовые доли меди и цинка в некотором сплаве соответственно равны ω(Cu) = 60 % и ω(Zn) = 40 %. Какое количество вещества (в молях) меди приходится на 1 моль цинка в этом сплаве? В ответе укажите номер, под которым расположено правильное значение.
1. 1,50, 2. 3, 3. 1,525, 4. 63,5, 5. 0,985.
Вариант № 2
1. В каком числе нижеприведенных примеров кислород упоминается в качестве элемента, а не простого вещества:
– атом кислорода имеет заряд ядра, равный 8;
– кислород можно получить фракционированием воздуха;
– данная руда состоит из железа и кислорода;
– магний горит в кислороде?
2. Сколько веществ из числа приведенных ниже являются металлами:
магний, кальций, фосфор, олово, бром, аргон?
3. Чему равно округленное значение относительной молекулярной массы сульфата бария (ВаSO4)? В ответе укажите номер, под которым расположено правильное значение.
1. 0,233, 2. 233, 3. 233 г/моль, 4. 104, 5. 233 г.
4. Учитывая, что масса атома углерода maтома(С) = 1,95·10 –26 кг, рассчитайте значение атомной единицы массы в граммах. В ответе укажите номер, под которым расположено правильное значение.
1. 1,66 · 10 –24 , 2. 1,66 · 10 –27 , 3. 1,95 · 10 –26 ,
4. 6,02 · 10 23 , 5. 1,59 · 10 –23 .
5. Вещество состоит из атомов элементов углерода, водорода и кислорода. Количественный состав его выражается соотношением:
Под каким номером расположена простейшая формула вещества:
 |
* см. табл. 11 приложения.
Вариант № 3
1. В каком числе случаев речь идет о веществе, а не о физическом теле:
вода, сахар, гвоздь, бензин, железо, воронка?
2. В каком числе перечисленных ниже примеров речь идет о признаках химических реакций (а не об условиях химических реакций):
предварительное нагревание реагирующих веществ,
увеличение поверхности соприкосновения реагирующих веществ,
выделение газообразного вещества,
3. Каково отношение масс элементов m (H) : m (С) : m (O) в уксусной кислоте СН3СООН ? В ответе укажите номер, под которым расположено правильное значение.
1. 1 : 6 : 8, 2. 2 : 24 : 10, 3. 2 : 1 : 1, 4. 4 : 2 : 2, 5. 3 : 12 : 16.
4. Чему равна масса в граммах 10 молекул серной кислоты (Н2SO4)? В ответе укажите номер, под которым расположено найденное значение.
1. 1,63 · 10 –21 , 2. 98, 3. 980, 4. 6,02 · 10 –23 , 5. 1,63 ·10 –22 .
5. Чему равно значение массовой доли элемента серы (в %) в сероводороде (Н2S)? В ответе укажите номер, под которым расположено правильное значение.
1. 94,1, 2. 82, 3. 33,3, 4. 88,85, 5. 11,2.
Ответы см. на стр. 48.
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
http://zdamsam.ru/a20294.html
http://liveposts.ru/articles/education-articles/himiya/koeffitsienty-i-indeksy-v-himicheskih-uravneniyah