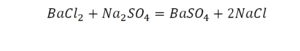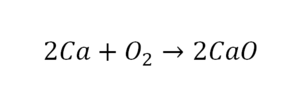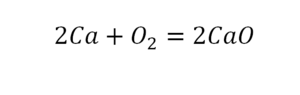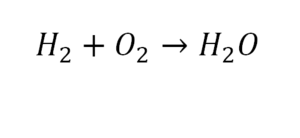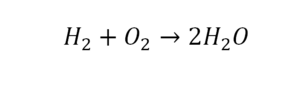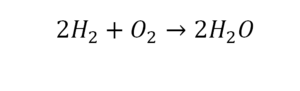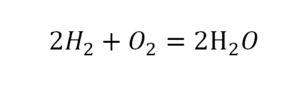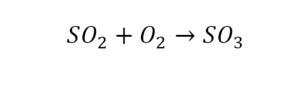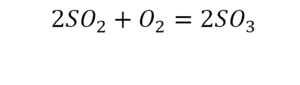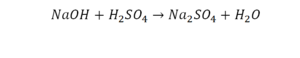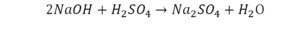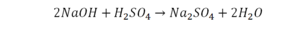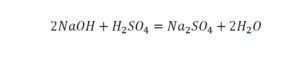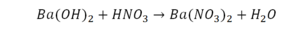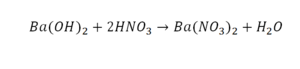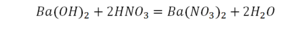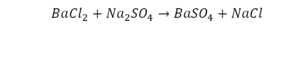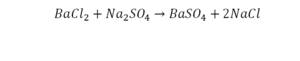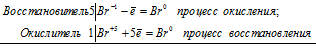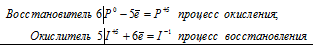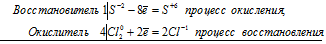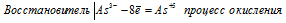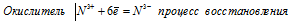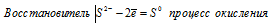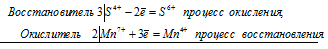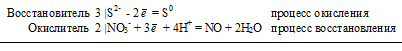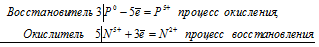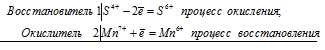Коэффициент перед хлором в уравнении реакций : P + CI2 = PCI5?
Химия | 5 — 9 классы
Коэффициент перед хлором в уравнении реакций : P + CI2 = PCI5.
2P + 5Cl2 = 2PCl5
Коэффициент перед хлором равен 5.
2P + 5CI2 = 2PCI5
Напиши уравнение реакции взаимодействия оксида хрома(III) с соляной кислотой?
Напиши уравнение реакции взаимодействия оксида хрома(III) с соляной кислотой.
Рассчитай, чему равна сумма коэффициентов в уравнении реакции и введи её в качестве ответа.
В уравнении реакции (CoOH)NO3 + HNO3 + средняя соль + ?
В уравнении реакции (CoOH)NO3 + HNO3 + средняя соль + .
Указать коэффициент перед формулой кислоты.
Расставьте коэффициенты в следующих уравнениях реакций(номер 1)?
Расставьте коэффициенты в следующих уравнениях реакций
Сумма коэффициентов в сокращенном ионном уравнении реакции hcl + k2s равна?
Сумма коэффициентов в сокращенном ионном уравнении реакции hcl + k2s равна.
Сумма коэффициентов в уравнении реакции WO3 + H2 = W + H2O?
Сумма коэффициентов в уравнении реакции WO3 + H2 = W + H2O?
На двух конкретных примерах объясните, как получают хлор в свободном состоянии?
На двух конкретных примерах объясните, как получают хлор в свободном состоянии.
Составьте уравнение соответствующих реакций.
Напишите уравнение реакции, в растворе ионные (коэффициенты в выходных веществах не изменяйтеH3PO4 + 2KOH = …?
Напишите уравнение реакции, в растворе ионные (коэффициенты в выходных веществах не изменяйте
Mg + P расставьте коэффициенты уравнении окислительно — восстановительной реакции методом электронного баланса?
Mg + P расставьте коэффициенты уравнении окислительно — восстановительной реакции методом электронного баланса.
Реакция соединение из нескольких веществ образуется одно?
Реакция соединение из нескольких веществ образуется одно.
Приведите уравнения реакций соединения, в которых сумма коэффициентов равна : а)5 б)7 в)9.
Напомни что коэффициенты должены быть целыми числоми.
Чему равна минимально возможная сумма коэффициентов в уравнении реакции соединения?
Может ли эта сумма быть чётным числом?
Если да , то приведите пример.
В реакциях соединения из нескольких веществ образуется одно ?
В реакциях соединения из нескольких веществ образуется одно .
Приведите уравнение реакций соединения в которых сумма коэффициентов равна 5 ; 7 ; 9 :
коэффициенты должны быть целыми.
Вы зашли на страницу вопроса Коэффициент перед хлором в уравнении реакций : P + CI2 = PCI5?, который относится к категории Химия. По уровню сложности вопрос соответствует учебной программе для учащихся 5 — 9 классов. В этой же категории вы найдете ответ и на другие, похожие вопросы по теме, найти который можно с помощью автоматической системы «умный поиск». Интересную информацию можно найти в комментариях-ответах пользователей, с которыми есть обратная связь для обсуждения темы. Если предложенные варианты ответов не удовлетворяют, создайте свой вариант запроса в верхней строке.
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Составление уравнений окислительно-восстановительных реакций
Решение задач на определение коэффициентов в уравнениях химических реакций
Задание 221.
Исходя из степени окисления хлора в соединениях НСI, НСIО3, НСlO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
КВг + КВгО3 + Н2SO4 → Вг2 + К2SO4 + Н2O
Решение:
Степень окисления хлора в указанных соединениях соответственно равна -1 (низшая), +5 (промежуточная), +7 (высшая). Отсюда следует, что HCl только восстановитель, HClO – окислитель и восстановитель, HClO4 – только окислитель. HCl – только восстановитель, потому что атом хлора в своей низшей степени окисления не может её понизить (принять электроны) и проявляет только восстановительные свойства. HClO может проявлять как восстановительные, так и окислительные свойства, потому что в своей промежуточной степени окисления может присоединять пять электронов и отдавать два электрона. HClO4 может быть только окислителем, потому что в своей высшей степени окисления не может её повысить (отдать электроны).
Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель с окислителем и отражаем это в электронных уравнениях:
5Br -1 + Br +5 = 6Br 0
Общее число электронов, отданных восстановителем должно быть равно числу электронов, которые присоединяет окислитель. Наименьшее кратное для принятых и отданных электронов в данном процессе равно 5. Тогда, разделив число 5 на 5, получим коэффициент 1 для восстановителя и продукта его окисления, а разделив 5 на 1 получаем коэффициент для окислителя и продуктов его восстановления. Коэффициент перед веществами, атомы которых не участвуют в процессе окисления-восстановления, т. е. не меняют свою степень окисления, находим методом подбора. Уравнение реакции будет иметь вид:
Задание 222.
Реакции выражаются схемами:
Р + НIО3 + Н2О → Н3РО4 + НI
Н2S + Сl2 +Н2O → Н2SO4 + НС1
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, отражаем это в электронных уравнениях. Далее учитываем: общее число электронов отданных восстановителем должно быть равно числу электронов, которые присоединяет окислитель. Коэффициенты для восстановителя и окислителя идентичны как для продуктов восстановления, так и для продуктов окисления реакции. Коэффициенты для веществ, атомы которых не меняют свою степень окисления, находят методом подбора.
6P 0 + 5I +5 = 6P +5 + I -1
В данной реакции: НIО3 – окислитель, который восстанавливается до НI, при этом степень окисления йода уменьшается от +5 до -1; Р – восстановитель, который окисляется до Н3РО4, при этом степень окисления фосфора увеличивается от 0 до +5.
уравнения электронного баланса
S -2 + 4Cl2 0 = S +6 + 8Cl -1
В данной реакции: Cl2 – окислитель, который восстанавливается до НCl, при этом степень окисления хлора уменьшается от 0 до -1; Н2S – восстановитель, который окисляется до Н2SO4, при этом степень окисления серы увеличивается от -2 до +6.
Задание 223.
Составьте электронные уравнения и укажите, какой процесс — окисление или восстановление — происходит при следующих превращениях: As 3- → As5 + ; N 3+ → N 3- ; S 2- → S 0 .
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
Na2SO3 + КМnO4 + Н2O → Na2SO4 + МnO2 + КОН
Решение:
а) Электронное уравнение:
При превращении As 3- → As5 + происходит процесс окисления (отдача электронов).
б) Электронное уравнение:
При превращении N 3+ → N 3- происходит процесс восстановления (присоединение электронов).
в) Электронное уравнение:
При превращении S 2- → S 0 происходит процесс окисления (отдача электронов).
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
3S 4+ + 2Mn 7+ = 3S 6+ + 2Mn 4+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Молекулярное уравнение реакции:
Задание 224.
Исходя из степени окисления фосфора в соединениях РН3, Н3РО4, Н3РО3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
РbS + HNO3 → S + Рb(NO3)2+ NО + Н2O
Решение:
а) Степень окисления фосфора в указанных соединениях соответственно равна: -3 (низшая), +5 (высшая), +3 (промежуточная). Отсюда: РН3 — только восстановитель; Н3РО4 -только окислитель; Н3РО3 — окислитель и восстановитель.
3S 2- + 2NO 3- + 8H + = 3S 0 + 2NO + 4H2O
Молекулярное уравнение реакции:
В данной реакции: РbS – восстановитель, HNO3 – окислитель; РbS окисляется до S, HNO3 – восстанавливается до NO.
Задание 225.
Реакции выражаются схемами:
Р + НNО3 + Н2О → Н3РО4 + NO;
KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO3 + Н2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3Р 0 + 5N 5+ = 3P 5+ + 5N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов пятнадцать. Разделив это число на 3, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 15 на 5 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Р – восстановитель, НNО 3 – окислитель; Р окисляется до Н 3 РО 4, НNО 3 – восстанавливается до NO.
б) KMnO 4 + Na 2 SO 3 + KOH = K 2 MnO 4 + Na 2 SO 4 + Н 2 O
Уравнения электронного баланса:
S 0 + 2Mn 7+ = S 6+ + 2Mn 6+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов два. Разделив это число на 1, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 2 на 2 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Na2SO3 – восстановитель, KMnO4 – окислитель; Na2SO3 окисляется до Na2SO4, KMnO4 – восстанавливается до K2MnO4.
http://liveposts.ru/articles/education-articles/himiya/koeffitsienty-i-indeksy-v-himicheskih-uravneniyah
http://buzani.ru/zadachi/khimiya-shimanovich/934-okislitelno-vosstanovitelnye-reaktsii-zadaniya