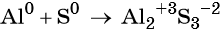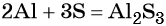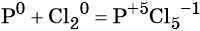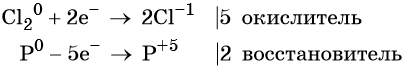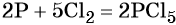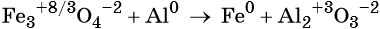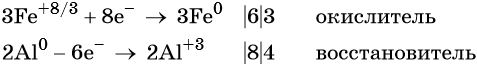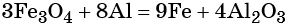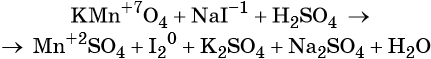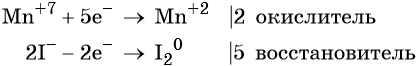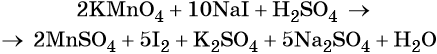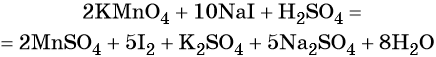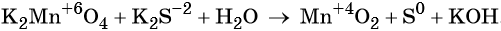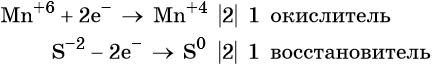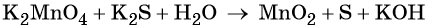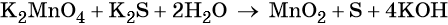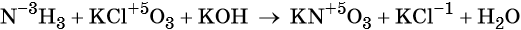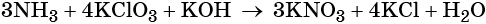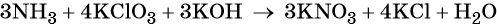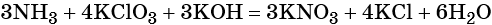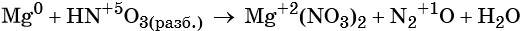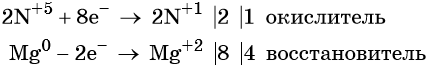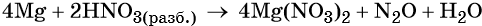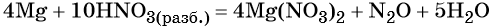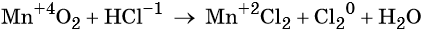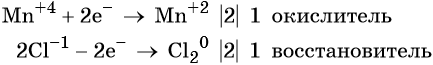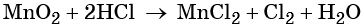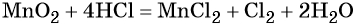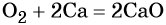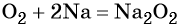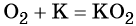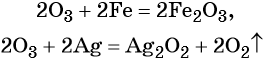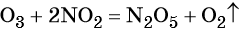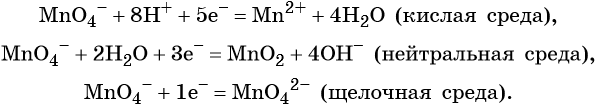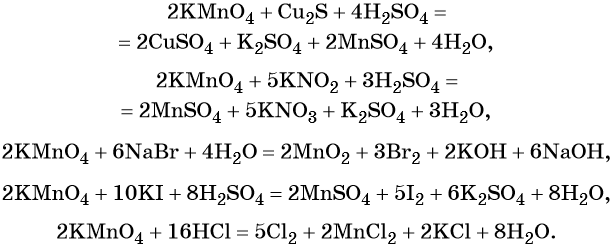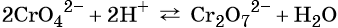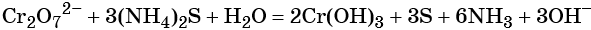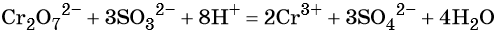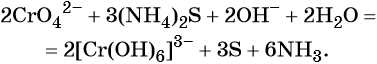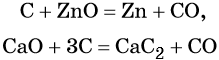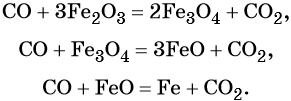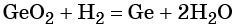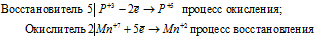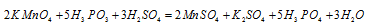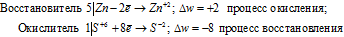Окислительно-восстановительные реакции. Окислитель и восстановитель
Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединённых и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I2 0 . Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Сульфид-ион отдаёт два электрона, образуя молекулу S 0 . Сульфид калия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Основные коэффициенты в уравнении реакции равны единице:
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:
Проставляем найденные основные коэффициенты в уравнение реакции:
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Два хлорид-иона отдают два электрона, образуя молекулу Cl2 0 , хлористый водород является восстановителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Реакции, иллюстрирующие окислительные свойства кислорода при его взаимодействии с различными неорганическими веществами, приведены в уроке 14.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn 2+ , в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO4 2– . Данные переходы описываются следующими уравнениями
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
В кислой среде образуются ионы Cr 3+ :
В щелочной — производные анионного комплекса [Cr(OH)6] 3– :
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:
Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.
Методы составления уравнений окислительно-восстановительных реакций (овр)
Окислительно-восстановительными (ОВР) называются реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ. Под степенью окисления (О) понимают стехиометрическую валентность со знаком (+) или (-). Знак (+) приписывают более электроположительному элементу (металлу), а (–) более электроотрицательному (неметаллу). Окисление-восстановление — это единый, взаимосвязанный процесс.
Окисление соответствует увеличению степени окисления элемента, а восстановление — ее уменьшению.
Степень окисления простых ионов совпадает с их зарядом: Fe 3+ , K + , Cl — и т. д. Степень окисления сложного нона совпадает с его зарядом (NH4 + ), (SO4 2— ), (PO4 3— ) и. т. д.
Степень окисления атома внутри сложного иона или молекулы прямо не связана с зарядом на этом атоме. Например, заряд атома Сr в молекулах CrCl2, CrCl3, K2CrO4 равен 1,9; 1,3 и 0,2 заряда электрона (со знаком ‘+‘), а степени окисления — +2, +3 и +6 соответственно. Нахождение степени окисления основывается на следующем правиле: сумма степеней окисления атомов в молекуле равна нулю, а в сложном ионе равна заряду этого иона. Атом, находящийся в высшей степени окисления, может быть только окислителем, если он находится в низшей степени окисления — только восстановителем, а если он обладает промежуточной степенью окисления, то может быть и окислителем и восстановителем. Например: N +5 (HNO3), S +6 (H2SO4) — проявляют только окислительные свойства (высшая степень окисления); N +4 (NO2), S +4 (SO2) — проявляют окислительные и восстановительные свойства (промежуточные степени окисления); N -3 (NH3), S -2 (H2S) — проявляют только восстановительные свойства (низшие степени окисления).
Для реакций окисления-восстановления применяют два метода составления уравнений: метод баланса степеней окисления и метод полуреакций.
Метод баланса степеней окисления
При этом методе для нахождения коэффициентов учитывают правило, согласно которому общее изменение степеней окисления в реакции равно нулю, то есть повышение степени окисления восстановителя равно ее понижению у окислителя.
Пример 1. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме: 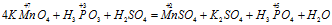
Решение.
Вычисляем, как изменяют свою степень окисления восстановитель и окислитель, и отражаем это в уравнениях:
Уравнения электронного баланса:
Изменение степеней окисления ( 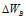
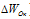
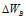
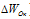
В данной реакции окислителем является KMnO 4 , в котором атом марганца уменьшает свою степень окисленности от +7 до +2, а восстановителем является Н 3 PO 3 , в котором фосфор увеличивает свою степень окисленности от +3 до +5. Таким образом, атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, данная реакция относится к реакциям межмолекулярного окисления-восстановления.
Пример 2. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, принимая максимальное восстановление последней.
Решение.
Цинк (как любой металл) проявляет только восстановительные свойства. В концентрированной серной кислоте окислительную функцию несет сера (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как р- элемента VI А группы равна -2. Цинк как металл II В группы имеет постоянную степень окисления +2. Отражаем сказанное в уравнениях:
Уравнения электронного баланса:
Составляем уравнение реакции :
Перед H2SO4 стоит коэффициент 5, а не 1, так как четыре молекулы кислоты идут на связывание четырех ионов Zn 2+ (то есть H2SO4 — и окислитель, и среда реакции).
При повышении степени окисления протекает процесс окисления, а само вещество является восстановителем. При понижении степени окисления протекает процесс восстановления, а само вещество является окислителем. Далее по балансу атомов водорода определяют число молей воды, Для проверки правильности подобранных коэффициентов подсчитывают баланс кислорода.
В данной реакции окислителем является H2SO4 , в котором атом серы уменьшает свою степень окисленности от +6 до -2, а восстановителем является Zn, в котором он увеличивает свою степень окисленности от 0 до +2. Таким образом, атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, данная реакция относится к реакциям межмолекулярного окисления-восстановления.
Метод полуреакций
В тех случаях, когда реакция протекает в водном растворе (расплаве), при составлении уравнений исходят не из изменения степени окисления атомов, входящих в состав реагирующих веществ, а учитывают форму существования веществ в растворе (простой или сложный ион, атом или молекула нерастворенного или слабодиссоциирующего в воде вещества). В этом случае при составлении ионных уравнений окислительно- восстановительных реакций следует придерживаться той же формы записи, которая принята для ионных уравнений обменного характера, а именно: малорастворимые, малодиссоциированные и газообразные соединения следует писать в молекулярной форме, а ноны, не изменяющие своего состояния, — исключать из уравнения.
Метод полуреакций точнее отражает истинные изменения веществ в процессе окислительно-восстановительных реакций и облегчает составление уравнений этих процессов в ионно-молекулярной форме. Поскольку из одних и тех же реагентов могут быть получены разные продукты в зависимости от характера среды (кислотного, щелочного, нейтрального) для таких реакций в ионной схеме кроме частиц, выполняющих функции окислителя и восстановителя, обязательно указывается частица, характеризующая реакцию среды (то есть ионы Н + или ион ОН — , или молекула Н20).
Пример 3. Используя метод полуреакций, расставьте коэффициенты в реакции:
КMnO4 + КNO2 + Н2SO4 → МnSO4 + KNO2 + K2SO4 + Н2O.
Решение.
Записываем реакцию в ионном виде:
K + и SO4 2— остаются без изменения, поэтому в ионной схеме их не указывают). Из ионной схемы видно, что перманганат-ион MnO4 — превращается в Мn 2+ и при этом освобождаются четыре частицы кислорода.
В кислой среде каждая освобождающаяся частица кислорода связывается с 2H + с образованием молекулы воды.
Отсюда следует: MnO4 — + 8Н + → Mn 2+ + 4Н20.
Находим разницу зарядов 
Для второго процесса, превращения NO2 — в NO3 — , недостающий кислород берется из воды, и в результате образуется избыток ионов H + :
NO2 — + Н20; 
Таким образом, получаем:
Уравнения ионно-молекулярного баланса:
Восстановитель 2 


Окислитель 5 


Умножая члены первого уравнения на 2. а второго — на 5 и складывая их, получим ионно-молекулярное уравнение данной реакции:
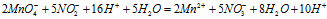
Сократив одинаковые частицы в левой и правой части уравнения, получаем окончательно ионно-молекулярное уравнение:
По ионному уравнению составляем молекулярное уравнение:
В щелочной и нейтральных средах можно руководствоваться следующими правилами.
В щелочной среде каждая освобождающаяся частица кислорода соединяется с одной молекулой воды, образуя два гидроксид-иона (2ОН — ), а каждая недостающая — берется из 2ОН — — ионов с образованием одной молекулы воды.
В нейтральной среде каждая освобождающаяся частица кислорода соединяется с одной молекулой Н20, образуя 2ОН — — нона, а каждая недостающая берется из воды с освобождением двух ионов водорода (2Н + ).
Если в окислительно-восстановительной реакции участвует перекись водорода (Н2О2), надо учитывать роль Н2О2 в конкретной реакции. В Н2О2 кислород находится в промежуточной степени окисления (-1), поэтому перекись водорода в окислительно-восстановительных реакциях проявляет окислительно-восстановительную двойственность. В тех случаях, когда Н2О2 является окислителем, полуреакции имеют следующий вид:
Н2О2 + 2H + —2 

Н2О2 —2 

Если перекись водорода является восстановителем:
Н2О2 + 2 

Н2О2 + 2ОН — + 2 

Типы окислительно-восстановительных реакций
Различают три типа окислительно-восстановительных реакций:
1. Межмолекулярные окислительно-восстановительные реакции, при которых изменяются степени окисления атомов элементов, входящих в состав разных веществ. Реакции, рассмотренные в примерах 1-3, относится к этому типу. Например:
Пример 4. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме: 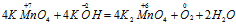
Решение.
Составляем уравнения ионно-молекулярного баланса, получим:
Восстановитель 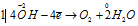
Окислитель 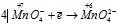
В данной реакции окислителем является KMnO4, в котором атом марганца уменьшает свою степень окисленности от +7 до +6, а восстановителем является КОН, в котором кислород увеличивает свою степень окисленности от -2 до 0. Таким образом, атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, данная реакция относится к реакциям межмолекулярного окисления-восстановления.
2. Реакции самоокисления-самовосстановления (диспропорционирования, дисмутации).
В этом случае степень окисления одного и того же элемента и повышается, и понижается. Реакции диспропорционировация характерны для соединений или элементов веществ, соответствующих одной из промежуточных степеней окисления элемента. Например:
Пример 5. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
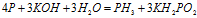
Решение.
Уравнения электронного баланса:
Восстановитель 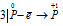
Окислитель 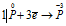
Данная реакция относится к реакции диспропорционирования, потому что сопровождается одновременным увеличением и уменьшением степени окисленности атомов одного и того же элемента (фосфора), находящегося в одном веществе (Р).
Пример 6. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме: 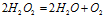
Решение.
Уравнения электронного баланса:
Восстановитель 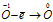
Окислитель 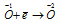
Данная реакция относится к реакции диспропорционирования, потому что сопровождается одновременным увеличением и уменьшением степени окисленности атомов одного и того же элемента (кислорода), находящегося в одном веществе (пероксид водорода Н2О2).
3. Реакции внутримолекулярного окисления-восстановления, при котором происходит выравнивание степеней окисленности атомов элемента, находящихся в одном и том же веществе, называется внутримолекулярным окислением-восстановлением (реакция конпропорционирования). Например:
Пример 7. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
NH4NO2 = N2 + H2O
Решение.
N -3 H4N +3 O2 = N2 0 + H2O
Уравнения ионно-молекулярного баланса:
Восстановитель 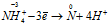
Окислитель 
Ионно-молекулярная форма процесса:
молекулярная форма процесса:
В данной реакции атомы азота, находящиеся в нитрите аммония NH4NO2, изменяют свои степени окисленности один с -3 до 0, другой с +3 до 0. Процесс, в результате которого происходит выравнивание степеней окисленности атомов элемента, находящихся в одном и том же веществе, называется внутримолекулярным окислением-восстановлением (реакция конпропорционирования).
Окислительно-восстановительные реакции


Процессы, протекающие в природе и осуществляемые человеком, в большинстве своём представляют ОВР. Такие важнейшие процессы, как дыхание, обмен веществ, фотосинтез (6CO2+H2O = C6H12O6 + 6O2), — всё это ОВР.
В промышленности с помощью ОВР получают аммиак, серную, соляную кислоты и многое другое.
Восстановление металлов из руд — фактически основа всей металлургической промышленности — тоже окислительно-восстановительные процессы. Например, реакция получения железа из гематита: 2Fe2O3 + 3С = 4Fe+3CO2.
Окислители и восстановители: характеристика

Говорят, что окислители, принимая электроны, восстанавливаются, а восстановители — окисляются в процессе отдачи электронов.
Важнейшие представители окислителей и восстановителей представлены в следующей таблице:
| Типичные окислители | Типичные восстановители |
| Простые вещества, состоящие из элементов с высокой электроотрицательностью (неметаллы): йод, фтор, хлор, бром, кислород, озон, сера и т. п. | Простые вещества, состоящие из атомов элементов с низкой электроотрицательностью (металлы или неметаллы): водород H2, углерод C (графит), цинк Zn, алюминий Al, кальций Ca, барий Ba, железо Fe, хром Cr и так далее. |
Молекулы или ионы, содержащие в составе атомы металлов или неметаллов с высокими степенями окисления:
| Молекулы или ионы, имеющие в своём составе атомы металлов или неметаллов с низкими степенями окисления:
|
| Ионные соединения, содержащие катионы некоторых металлов с высокими СО: Pb3+, Au3+, Ag+, Fe3+ и другие. | Органические соединения: спирты, кислоты, альдегиды, сахара. |

Как определить, является атом окислителем или восстановителем: достаточно записать СО и понять, какие атомы её увеличили впроцессе реакции (восстановители), а какие уменьшили (окислители).
Вещества с двойственной природой
Примером может быть пероксид водорода. Содержащийся в его составе кислород в СО -1 может как принять электрон, так и отдать его.
При взаимодействии с восстановителем пероксид проявляет окислительные свойства, а с окислителем — восстановительные.
Рассмотреть подробнее можно при помощи следующих примеров:
- восстановление (пероксид выступает как окислитель) при взаимодействии с восстановителем;
SO2 + H2O2 = H2SO4
- окисление (пероксид является в этом случае восстановителем) при взаимодействии с окислителем.
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5О2 + K2SO4 + 8H2O
Классификация ОВР: примеры
Различают следующие типы окислительно-восстановительных реакций:
- межмолекулярное окисление-восстановление (окислитель и восстановитель находятся в составе разных молекул);
- внутримолекулярное окисление-восстановление (окислитель находится в составе той же молекулы, что и восстановитель);
- диспропорционирование (окислителем и восстановителем является атом одного и того же элемента);
- репропорционирование (окислитель и восстановитель образуют в результате реакции один продукт).
Примеры химических превращений, относящихся к различным типам ОВР:
- Внутримолекулярные ОВР — это чаще всего реакции термического разложения вещества:
2KCLO3 = 2KCl + 3O2
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
2NaNO3 = 2NaNO2 + O2
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2Al + Fe2O3 = Al2O3 + 2Fe
3Br2 + 6KOH = 5KBr + KBrO3 + 6H2O
3HNO2 = HNO3 + 2NO + H2O
2NO2 + H2O = HNO3 + HNO2
4KClO3 = KCl + 3KClO4
2H2S + SO2 = 3S + 2H2O
HOCl + HCl = H2O + Cl2
Токовые и бестоковые ОВР

Первый случай — это получение электрической энергии за счёт химической реакции (такие источники энергии могут использоваться в двигателях машин, в радиотехнических устройствах, приборах управления), либо электролиз, то есть химическая реакция, наоборот, возникает за счёт электроэнергии (с помощью электролиза можно получать различные вещества, обрабатывать поверхности металлов и изделий из них).
Примерами бестоковых ОВР можно назвать процессы горения, коррозии металлов, дыхания и фотосинтеза и т.д.
Метод электронного баланса ОВР в химии
Основывается метод на том, что сумма принимаемых окислителем электронов и количество отдаваемых восстановителем приводится к равновесию.
Метод складывается из нескольких этапов:
- Записывается уравнение реакции.
- Определяются СО элементов.
- Определяются элементы, которые в результате реакции изменили свои степени окисления. Отдельно записываются полуреакции окисления и восстановления.
- Подбираются множители для уравнений полуреакций так, чтобы уравнять принятые в полуреакции восстановления и отданные в полуреакции окисления электроны.
- Подобранные коэффициенты проставляются в уравнение реакции.
- Подбираются остальные коэффициенты реакции.
На простом примере взаимодействия алюминия с кислородом удобно написать уравнивание поэтапно:
- Уравнение: Al + O2 = Al2О3
- СО у атомов в простых веществах алюминия и кислорода равны 0.
Al 0 + O2 0 = Al +3 2O -2 3
- Подбираем коэффициенты, при умножении на которые сравняется количество принятых и количество отданных электронов будет одинаковым:
Al 0 -3е = Al +3 коэффициент 4;
O2 0 +4e = 2O -2 коэффициент 3.
- Проставляем коэффициенты в схему реакции:
4Al + 3O2 = Al2O3
- Видно, что для уравнивания всей реакции достаточно поставить коэффициент перед продуктом реакции:
4Al + 3O2 = 2Al2O3
Примеры заданий на составление электронного баланса
Могут встречаться следующие задания на уравнивания ОВР:
- Взаимодействие перманганата калия с хлоридом калия в кислой среде с выделением газообразного хлора.
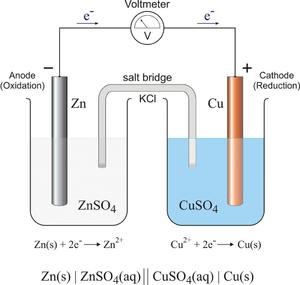
KCl + KMnO4 + H2SO4 = Cl2 + MnSO4 + K2SO4 + H2O
K +1 Cl -1 + K +1 Mn +7 O4 -2 + H2 +1 S +6 O4 -2 = Cl2 0 + Mn +2 S +6 O4 -2 + K2 +1 S +6 O4 -2 + H2 +1 O -2
Как видно после расстановки СО, атомы хлора отдают электроны, повышая свою СО до 0, а атомы марганца электроны принимают:
Mn +7 +5е = Mn +2 множитель два;
2Cl -1 -2е = Cl2 0 множитель пять.
Проставляем в уравнение коэффициенты в соответствии с подобранными множителями:
10K +1 Cl -1 + 2K +1 Mn +7 O4 -2 +H2SO4 = 5Cl2 0 + 2Mn +2 S +6 O4 -2 + K2SO4 + H2O
Уравниваем количество остальных элементов:
10KCl + 2KMnO4 + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4 + 8H2O
- Взаимодействие меди (Cu) с концентрированной азотной кислотой(HNO3) с выделением газообразного оксида азота (NO2):
Cu + HNO3(конц.) = NO2 + Cu(NO3)2 + 2H2O
Cu 0 + H +1 N +5 O3 -2 = N +4 O2 + Cu +2 (N +5 O3 -2 )2 + H2 +1 O -2
Как видно, атомы меди повышают свою СО с нуля до двух, а атомы азота — снижают с +5 до +4
Cu 0 -2е = Cu +2 множитель один;
N +5 +1е = N +4 множитель два.
Проставляем в уравнение коэффициенты:
Cu 0 + 4H +1 N +5 O3 -2 = 2N +4 O2 + Cu +2 (N +5 O3 -2 )2 + H2 +1 O -2
Уравниваем остальные элементы:
Cu + 4HNO3(конц.) = 2NO2 + Cu (NO3)2 + 2H2O
- Взаимодействие дихромата калия с Н2S в кислой среде:
Запишем схему реакции, расставим СО:
К2 +1 Сr2 +6 О7 -2 + Н2 +1 S -2 + Н2 +1 S +6 O4 -2 = S 0 + Сr2 +3 (S +6 O4 -2 )3 + K2 +1 S +6 O4 -2 + H2O
S -2 –2e = S 0 коэффициент 3;
2Cr +6 +6e = 2Cr +3 коэффициент 1.
К2Сr2О7 + 3Н2S + Н2SО4 = 3S + Сr2(SО4)3 + K2SO4 + Н2О
Уравниваем остальные элементы:
К2Сr2О7 + 3Н2S +4Н2SО4 = 3S + Сr2(SО4)3 + K2SO4 + 7Н2О
Влияние реакционной среды
Характер среды влияет на протекание тех или иных ОВР. Роль реакционной среды можно проследить на примере взаимодействия перманганата калия (KMnO4) и сульфита натрия (Na2SO3) при различных значениях рН:
- Na2SO3 + KMnO4 = Na2SO4 + MnSO4 + K2SO4 (pH 7 щелочная среда).
Видно, что изменение кислотности среды приводит к образованию разных продуктов взаимодействия одних и тех же веществ. При изменении кислотности среды они происходят и для других реагентов, вступающих в ОВР. Аналогично показанным выше примерам реакции с участием дихромат-иона Cr2O7 2- будут проходить с образованием разных продуктов реакции в различных средах:
в кислой среде продуктом будет Cr 3+ ;
в щелочной — CrO2 — , CrO3 3+ ;
в нейтральной — Cr2O3.
http://buzani.ru/raznoe/metodika/677-okislitelno-vosstanovitelnye-reaktsii
http://prostudenta.ru/article-1063.html