ПЕРЕНАПРЯЖЕНИЕ РАЗРЯДА ИОНОВ ВОДОРОДА
Термин «водородное перенапряжение» обычно означает катодную поляризацию, сопровождающую разряд ионов водорода из кислого раствора
2H + + 2е 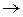
или электролиз нейтральных и щелочных растворов с выделением водорода
2Н2О + 2е 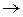
На том же основании под водородным перенапряжением можно подразумевать анодную поляризацию, наступающую вследствие задержки ионизации водорода по реакциям, обратным предыдущим.
Для различия величин перенапряжения их обозначают hк и hа – соответственно перенапряжения катодного и анодного процессов.
Разряд ионов водорода проходит несколько последовательных стадий. К их числу, прежде всего, относится диффузия ионов гидроксония H3O – из глубины раствора к поверхности катода. Далее следует собственно электрохимический акт разряда водородных ионов одновременно с их дегидратацией – это стадия разряда-ионизации
Образовавшийся атомарный водород адсорбируется на поверхности катода
H 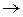
а затем превращается в молекулярный водород (реакция рекомбинации или молизации
Молекулярный водород в виде пузырьков удаляется с поверхности катода и затем из электролита. Стадия, имеющая наименьшую скорость, т.е. требующая для своего осуществления наибольших энергетических затрат, определяет скорость всего процесса и называется лимитирующей.
Общее катодное перенапряжение hо при выделении водорода определяется суммой перенапряжений, соответствующих каждой стадии электродного процесса
где hd – перенапряжение диффузии; hе – перенапряжение разряда; hа – перенапряжение адсорбции; hр – перенапряжение реакции рекомбинации; hд – перенапряжение десорбции молекулярного водорода.
Однако не все слагаемые этой суммы вносят равноценный вклад в общую величину катодной поляризации.
В кислых растворах (при рН
У металлов с высоким «сродством» к водороду (платина, палладий, никель, железо) степень заполнения поверхности электрода адсорбированными атомами водорода стремится к 1 и лимитирующей стадией является рекомбинация, а главной составляющей катодной поляризации – перенапряжение реакции рекомбинации, то есть hо = hр.
Анодный процесс ионизации водорода включает те же стадии, что и катодный, только они протекают в обратной последовательности и процессы и реакции в стадиях имеют противоположное направление.
В соответствии с применяемыми в работе электродами далее будут проанализированы закономерности только стадии разряда-ионизации.
Согласно теории электрохимических реакций на электроде, находящемся в состоянии равновесия, протекают частные (парциальные) реакции катодного и анодного направлений с равными скоростями, определяемые частными (парциальными) плотностями тока катодного i1 и анодного i2 процессов.
В этом случае можно написать i1 = i2 = iо, где iо – плотность тока обмена. Ток обмена определяется природой материала электрода и раствора электролита.
Общий или результирующий ток, протекающий через электрод, равен разности между частными (парциальными) токами катодного и анодного процесс`ов (или наоборот) и в состоянии равновесия равен нулю.
Скорость катодной стадии электродного процесса описывается уравнением
i1 = nFk1 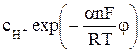
Скорость анодной стадии электродного процесса описывается уравнением
i2 = nFk2 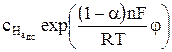
где k1 и k2 – константы скорости частных катодной и анодной реакций соответственно, м/с; φ – потенциал электрода, В ; n – число электронов, участвующих в электродной реакции; 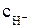
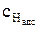
Коэффициент переноса изменяется в пределах от 0 до 1 и показывает долю энергии двойного электрического слоя, действующую на катодную реакцию. Доля энергии двойного электрического слоя, действующая на анодную реакцию равна (1–a).
В равновесных условиях при равновесном потенциале φр из уравнений (7) и (8) имеем:
k1 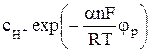
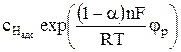
При потенциалах, значения которых отличаются от равновесной величины, то есть при потенциалах, когда электрод находится в условиях анодной или катодной поляризации результирующий ток не равен нулю.
nПри анодной поляризации при смещении потенциала электрода в положительную сторону от равновесного значения возникает результирующий ток анодного направления. Плотность результирующего анодного тока равна
Здесь величина ia принята положительной.
При катодной поляризации потенциал электрода смещается в отрицательную сторону и возникает результирующий ток катодного направления, плотность которого равна
Здесь величина iк принята положительной.
Разность между потенциалами электрода при пропускании тока φi и равновесным φр и есть перенапряжение. Таким образом, катодное перенапряжение равно
hк = 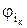
Для анодного перенапряжения имеем:
hа = 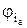
где 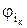
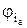
В уравнениях (12) и (13) катодное перенапряжение принято отрицательным, а анодное – положительным. Возможна и обратная система знаков.
В дальнейшем будем рассматривать только катодный процесс, принимая величины iк > 0, hк
Используя уравнения (7), (8), (11) и (12) выражение для плотности результирующего катодного тока можно представить в виде
iк = k1 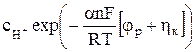
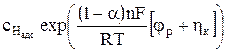
Уравнение (14) можно записать по-другому, принимая во внимание определение плотности тока обмена согласно выражению (9).
iк = io 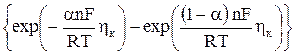
Выражение (15) представляет собой основное уравнение теории замедленного разряда. Основными характеристиками процесса разряда являются коэффициент переноса и плотность тока обмена.
Большое практическое значение имеют частные случаи уравнения (15).
Если величина перенапряжения |h|к 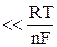
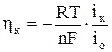
При значительной поляризации электрода, когда |h|к 

Обычно уравнение (17) используют в форме
где а = 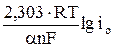
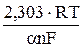
Уравнение (18) было получено И. Тафелем эмпирически при изучении кинетики разряда водородных ионов и называется уравнением Тафеля.
Зависимость hк = f(lg iк ) представляет собой прямую, из наклона b которой к оси lg iк легко рассчитать коэффициент переноса, а затем используя значение a – величину плотности тока обмена.
Цель работы: снять поляризационную зависимость при катодном восстановлении водорода на свинцовом электроде из водного раствора серной кислоты, рассчитать плотность тока обмена и коэффициент переноса.
Проверка выведенных соотношений для водородного перенапряжения затруднена действиями некоторых факторов:
1) наличием в электролите растворенного кислорода и следов поверхностно-активных веществ. Для удаления кислорода из системы электролит продувают в течение 20 минут инертным газом и подвергают очистке путем длительного электролиза. Для этой цели в электрохимическую ячейку вводят дополнительные электроды.
2) наложением перенапряжения диффузии на перенапряжение разряда. При этом экспериментально установленный наклон тафелевской прямой (то есть коэффициент b) будет принимать более высокие значения по сравнению с теоретическими. Такое расхождение более заметно с повышением плотности катодного тока и уменьшением концентрации ионов водорода в растворе.
Наиболее просто поляризационные кривые можно изучить гальваностатическим методом, задавая и поддерживая ток через электрод и измеряя, соответствующий заданному току потенциал электрода. Электрическая схема установки для получения поляризационных зависимостей показана на рис.1. Поляризацию осуществляют с применением вспомогательного свинцового электрода, опущенного в раствор серной кислоты той же концентрации, что и рабочий электрод, т.е электрический ток протекает в цепи рабочего и вспомогательного электродов. Потенциал рабочего электрода измеряют относительно электрода сравнения высокоомным милливольтметром. В цепи рабочий электрод – электрод сравнения электрический ток не протекает.
Порядок проведения опыта
1. Свинцовый катод, армированный в полиметилкрилат или в пластмассу на основе эпоксидной смолы, зачищают наждачной бумагой, промывают дистиллированной водой, а затем обезжиривают ацетоном и снова промывают водой. При полном обезжиривании поверхность металла должна хорошо смачиваться водой. В противном случае операцию обезжиривания следует повторить.
2. Готовят раствор серной кислоты, объем и концентрация которого указываются преподавателем.
3. Проверяют хлорсеребряный электрод сравнения на отсутствие вытекания из него электролита.
4. Измеряют диаметр рабочего электрода и рассчитывают площадь его геометрической поверхности. Обе величины приводят в отчете перед таблицами результатов.
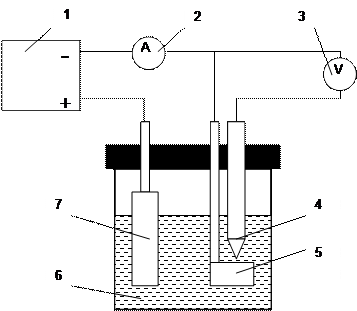 |
Рис. 1 . Принципиальная схема установки для снятия поляризационных кривых.
1 – источник питания (потенциостат или гальваностат) ; 2 – амперметр; 3 – высокоомный милливольтметр; 4 – электрод сравнения; 5 – рабочий электрод – свинцовый катод; 6 – электролит; 7 – вспомогательный электрод – свинцовый анод
5. В стакан с раствором серной кислоты опускают рабочий электрод и хлорсеребряный электрод сравнения, который подводят к поверхности катода на расстояние 0,1 – 0,2 мм.
6. Электроды соединяют медными проводами с источником питания, измерительными приборами и между собой согласно принципиальной электрической схеме (см. рис.1)
7. Измеряют ЭДС междурабочимсвинцовым электродом и хлорсеребряным электродом без наложения тока.
8. Выполняют поляризационные исследования гальваностатическим методом, изменяя ток от малых величин к большим, а затем в обратном направлении. Величины тока указывает преподаватель. При установлении заданного значения тока одновременно снимаются показания миллиамперметра – сила тока в цепи и милливольтметра – ЭДС между рабочим и вспомогательным электродами. Показания приборов заносят в таблицу. Необходимо иметь не менее 30 измерений.
Обработка результатов опыта
1. По измеренным значениям силы тока рассчитывают плотность тока iк путем деления величины силы тока на площадь свинцового электрода и выражают её в А/м 2 .
2. Находят десятичный логарифм плотности тока.
3. По измеренным значениям ЭДС Е между электродом сравнения и катодом рассчитывают потенциал рабочего электрода относительно водородного электрода сравнения в равновесных условиях и при поляризации, используя уравнение
и принимая во внимание, что Е> 0 и потенциал электрода сравнения φэл. ср положительнее потенциала свинцового электрода φк , погруженного в раствор серной кислоты. Потенциал выражают в вольтах. Потенциал электрода сравнения находят в справочниках.
4. Имея для каждой плотности тока значения потенциала катода, по уравнению (12) вычисляют перенапряжение разряда ионов Н3О + .
5. Находят значения перенапряжения, удовлетворяющие условию |h|к 
6. Обрабатывают график уравнением прямой и находят коэффициенты уравнения Тафеля а и b.
7. Рассчитывают коэффициент переноса и плотность тока обмена, используя выражения (19).
8. Полученные экспериментальные результаты и рассчитанные величины вносят в таблицы.
Таблица 1. Величины, связанные с плотностью поляризующего тока
| Сила тока, А | iк, А/м 2 | lg iк | ЭДС, В | φк, В | hк, В |
Таблица 2. Параметры процесса восстановления водорода.
| Коэффициенты уравнения Тафеля | Коэффициент переноса | Плотность тока обмена, А/м 2 |
| а | b |
По результатам работы делают выводы и вычисляют абсолютную и относительную ошибки.
1. Какие факторы влияют на поляризацию электрода?
2. Какие существуют теории водородного перенапряжения?
3. Написать уравнения реакций восстановления водорода в кислой и щелочной средах.
4. Из каких стадий состоит процесс восстановления водорода? Понятие лимитирующей стадии. Какая стадия является лимитирующей в данной работе?
5. От чего зависит смена лимитирующей стадии при разряде иона водорода?
6. Что такое поляризация и перенапряжение? Как рассчитать перенапряжение?
7. Как рассчитать плотность поляризующего тока по экспериментальным данным?
8. Какие факторы влияют на поляризацию электрода?
9. Объяснить понятие предельного диффузионного тока.
10. Объяснить понятие тока обмена. Что такое плотность тока обмена?
11. Физический смысл коэффициента переноса.
12. Вывести уравнение Тафеля из уравнения 15.
13. Вывести уравнение для расчета перенапряжение при его малых величинах.
14. Нарисовать электрическую схему установки для измерения ЭДС.
15. Написать схему электрохимической цепи используемой в работе.
16. Дать понятие энергии активации процесса.
17. Зависимость плотности тока обмена от температуры.
18. Зависимость перенапряжения от температуры.
Кинетика электродных процессов алюминия
КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ АЛЮМИНИЯ

Электрохимический процесс складывается из нескольких последовательных стадий: транспорта вещества к поверхности электрода, электрохимической реакции восстановления или окисления на электроде и отвода продуктов реакции. В некоторых случаях существенную роль играют химические реакции: гомогенная, протекающая в электролите вблизи поверхности электрода, и гетерогенная — на поверхности электрода. В первом случае в электрохимическую реакцию вступает не то вещество, которое транспортируется к электроду, а продукты его распада или взаимодействия с другими веществами, содержащимися в электролите. Такая реакция предшествует электрохимической стадии. Во втором случае в результате электрохимического разряда получается не конечное вещество, а некоторое промежуточное, адсорбированное электродом. Затем происходит гетерогенная реакция перехода этого вещества в конечный продукт. Иногда приходится учитывать скорости образования новой фазы, появляющейся в результате электрохимической реакции — кристаллов твердого вещества, капель металла и пузырьков газа.
В зависимости от того, какая из этих стадий является лимитирующей, т. е. самой медленной, различают следующие виды поляризации, или перенапряжения (по Феттеру).
Перенапряжение перехода вызвано замедленностью стадии разряда — ионизации. Связь между перенапряжением и плотностью тока описывается уравнением Тафеля:
где С — плотность тока, А/см 2 ; а и b — постоянные. Для анодного процесса
где k1, —константа скорости электрохимического процесса, 1/с; α — коэффициент переноса (кинетический коэффициент), доли. ед.
При электрохимическом процессе потенциальная энергия иона в электролите и конечного продукта на электроде различна. В энергию активации электродной реакции входит не вся разность этих энергий, а только часть ее. Коэффициент переноса й представляет собой отношение этой части энергии к полной энергии.
Для катодного процесса, в котором играет роль концентрация (активность) потенциал-определяющих ионов, константы уравнения Тафеля будут иметь значения:
где С — концентрация ионов, моль/см 3 ; β — коэффициент переноса для катодного процесса, доли ед.
Сумма коэффициентов переноса а и В равна единице и обычно принимается, что α = β =0,5.
Любой электрохимический (и химический) процесс идет как в прямом, так и в обратном направлениях. Чем дальше процесс от равновесного, тем больше прямой процесс преобладает над обратным, и наоборот. При равновесии скорости прямого и обратного процессов равны. Ток обмена и представляет собой скорость электрохимического процесса в прямом и обратном направлениях при равновесном потенциале. Как следует из соотношения , с увеличением тока обмена перенапряжение перехода уменьшается. Если i0»i, то перенапряжение близко к нулю, и процесс можно рассматривать как равновесный (обратимый).
Обычно токи обмена в расплавленных солях велики—от единиц до сотен ампер на квадратный сантиметр, что связано с ускорением процессов при высоких температурах.
Перенапряжение диффузии
Возникает вследствие замедленности переноса реагирующих веществ. Этот перенос может осуществляться молекулярной диффузией, миграцией (переносом под действием электрического поля заряженных частиц — катионов и анионов) и конвекцией (переносом потоком жидкости). Обычно конвекция вызвана выделяющимися на аноде газами. Эффект миграционного переноса удается в значительной степени снизить за счет создания фона, при котором перенос электричества осуществляется другими, неразряжающимися ионами. Именно такой перенос имеет место в алюминиевых электролизерах.
Основным лимитирующим процессом обычно является молекулярная диффузия как самый медленный процесс. Если диффузия происходит к плоскому электроду, то диффузионный, ток (для катодного процесса) можно подсчитать из выражения первого закона Фика:
, где С0 — концентрация ионов в глубине электролита; C8—концентрация ионов на поверхности электрода;-δ — толщина диффузионного слоя; D — коэффициент диффузии.
Толщина диффузионного слоя зависит от условий перемешивания электролита — чем выше скорость потоков, обтекающих электрод, тем меньше б. При электролизе расплавленных солей толщина, диффузионного слоя обычно составляет от 0,1 до 1 мм.
Для жидких электродов в расплавленных солях было отмечено (Поляков с сотр.), что толщина диффузионного слоя уменьшается за счет эффекта Марангони: межфазное натяжение на границе металл — электролит имеет разное значение на различных участках поверхности электрода, что вызывает течение жидкости от участков с меньшим межфазным натяжением к участкам с большим межфазным натяжением. Это дополнительное перемешивание может уменьшить δ на порядок.
При падении концентрации С, до нуля получается максимальный ток диффузии — так называемый предельный диффузионный ток: id=nFDC0/δ.
Связь между перенапряжением и диффузионным током дается выражением:
из которого следует, что в области предельного тока происходит резкий сдвиг потенциала в отрицательную сторону и на поляризационной кривой отмечается площадка предельного тока. Потенциал электрода при этом сдвигается настолько, что начинается разряд другого, более электроотрицательного катиона (например, катиона фона). Если строить поляризационную кривую до предельного тока, то в координатах ηd-1n (1 -i/id) получается прямая, наклон которой позволяет определить п — число электронов, участвующих в электрохимической реакции.
Если перенапряжение определяется замедленностью диффузии анионов в процессе анодного разряда, то соответствующее уравнение связи между током диффузии и перенапряжением будет
где id — предельный ток диффузии анионов, А/см 2 .
Перенапряжение реакции
Вызвано замедлением химических реакций на стадиях до или после разряда — ионизации. Рассмотрим гетерогенную реакцию, следующую после разряда, как наиболее важную для дальнейшего изложения.
Предположим, что электрохимический процесс состоит из двух последовательных стадий: окисления вещества R: R — ne ⇄ Oс образованием промежуточного окисленного вещества О, адсорбирующегося на поверхности электрода, и гетерогенной реакции O ⇄ A , при которой образуется конечный продукт А. Допустим, что стадия разряда протекает быстро, практически равновесно, в то время как последующая гетерогенная реакция — медленно. Скорость этой медленной стадии слагается из скорости прямого процесса, пропорциональной поверхностной концентрации вещества О в степени р (порядок реакции), и скорости обратного процесса υ = υ — υ = kC0 p —υ , где k — константа скорости реакции, см/с.
При равновесии скорости этих процессов равны: υ0=υ=υ =kC0 p при этом С0 — поверхностная концентрация вещества в равновесии, моль/см 2 . Если в процессе имеется большой избыток вещества А и его концентрация не зависит от потенциала, то независимой будет и C0 Перенапряжение реакции определяется выражением:
где С0—поверхностная концентрация вещества О при поляризации. Скорость процесса, или плотность тока
Ho nFυ0= i0 — плотность тока при равновесии (ток обмена), поэтому
Из выражений (34) и (35) вытекает связь между плотностью тока и перенапряжением:
Если i/io » 1, то получится уравнение Тафеля:
В координатах ηр — ln i эта зависимость выражается прямой линией, как и в случае перенапряжения перехода, но вместо коэффициента переноса здесь фигурирует порядок гетерогенной химической реакции р, и коэффициент b в уравнении Тафеля будет существенно меньшим.
Механизм катодного процесса алюминия
Катодный процесс включает в себя следующие последовательно идущие стадии: транспорт оксифторидных и фторидных комплексов, содержащих ионы алюминия, из глубины расплава к катоду; распад комплексов в двойном слое с образованием свободных ионов Аl 3+ . и разряд ионов Аl 3+ . Не исключено, что разряд происходит непосредственно из комплексных ионов, минуя стадию их распада. При восстановлении алюминия из криолито-глиноземных расплавов на индифферентном катоде (например, вольфрамовом) обнаруживаются на поляризационных кривых две площадки (Антипин), отвечающие двум процессам: Аl 3 +2е = Аl+, Аl + +е = Аl. Если катод — жидкий алюминий, процесса перезаряда нет, поскольку в присутствии алюминия быстро устанавливается равновесие между ионами Al 3+ , Аl + и металлом.
Импедансные измерения, т. е. исследование комплексного сопротивления электродной системы алюминий — криолито-глиноземный расплав в цепи переменного тока
в зависимости от частоты, позволили оценить величину тока обмена для этой системы. Оказалось, что ток обмена при температуре электролиза составляет около 20 А/ /см 2 , т. е. алюминиевый электрод является практически обратимым и перенапряжение перехода составляет всего несколько милливольт. Эти измерения указали на диффузионный характер перенапряжения.
Исследования поляризации алюминиевого электрода в лабораторной ячейке (Борисоглебский и др.) в условиях, когда анодный процесс сводился к растворению алюминия (т. е. анодных газов не выделялось) и перемешивание анолита и католита было минимальным, показало, что на поляризационных кривых имеются площадки предельного тока (рис. 17, кривая /).
С повышением температуры и при перемешивании расплава предельная плотность тока повышается. Катодный выход по току при достижении предельной плотности тока проходит через максимум (кривая 2) и содержание натрия в алюминии (кривая 3) скачкообразно повышается до предельной растворимости при данной температуре. Все эти факты несомненно указывают на диффузионный характер перенапряжения на алюминиевом катоде.
Рис. 17. Совместное выделение алюминия и натрия в условиях лабораторного эксперимента при 970 °С, К.О. = 3,0, концентрация Аl2O3 —5% (по массе) (Борисоглебский): 1—катодная поляризационная кривая; 2 — выход по току для алюминия; 3 — содержание натрия в алюминии
С ростом плотности тока в прикатодном слое уменьшается концентрация комплексных оксифторидных и фторидных ионов, содержащих катионы Аl 3+ , и увеличивается концентрация ионов Na + . Поскольку электрод обратимый (перенапряжение перехода отсутствует), рост концентрации ионов Na+ приводит к повышению содержания натрия в алюминии и сдвигу потенциала в отрицательную сторону. Следовательно, происходит совместный разряд ионов алюминия и натрия, только натрий не выделяется в виде отдельной фазы (пузырька при атмосферном давлении), а растворяется в алюминии и в солевом расплаве.
При предельной плотности тока потенциал достигает величины, при которой происходит выделение натрия в виде самостоятельной фазы, содержание натрия становится предельным при данной температуре. Дальнейшее повышение плотности тока приводит к уменьшению выхода по току для алюминия, поскольку все большие количества натрия разряжаются при неизменном количестве образующегося алюминия. Содержание натрия в алюминии не изменяется, так как достигнут предел его растворимости.
Таким образом, при -всех условиях электролиза имеет место совместный разряд алюминия и натрия, причем последний обычно выделяется в виде раствора в алюминии. Поскольку оба металла выделяются на одном электроде, их потенциалы должны быть одинаковы:
При поляризации католит обогащается фторидом натрия и обедняется фторидом алюминия по сравнению с равновесным составом. Поэтому величина поляризации катода равна э. д. с. концентрационной цепи:
Здесь в первом полуэлементе представлены состав электролита и сплава алюминий — натрий для равновесного электрода, во втором — для поляризованного,
Э. д. с. цепи равна
Диффузионный потенциал на границе раздела полуэлементов:
поскольку ток переносится только ионами натрия. Поэтому
Используя выражение для константы равновесия реакции
Катодное перенапряжение может быть определено, если известно содержание натрия в алюминии для равновесного электрода и для поляризованного. Поскольку концентрация натрия в растворе с алюминием мала, отношение активностей можно заменить отношением концентрации:
Многочисленные измерения концентрации натрия в алюминии на промышленных электролизерах показывают, что содержание натрия обычно меньше или равно его равновесному значению.
Электролит и металл в промышленных ваннах находятся в непрерывном движении, при этом на поверхности металла образуются волны. Движение электролита и металла способствует снятию перенапряжения диффузии, и алюминиевый электрод является практически равновесным.
Выделение натрия на алюминии определяется в основном криолитовым отношением и температурой: чем они выше, тем больше выделяется натрия. Натрий уходит из алюминия двумя путями: 1) растворяется в электролите, переносится к аноду и окисляется; 2) проходит через толщу алюминия и поглощается угольной футеровкой. Первый путь приводит к значительным потерям тока и к снижению выхода по току, второй — к преждевременному разрушению угольной футеровки электролизеров.
Статья на тему Кинетика электродных процессов алюминия
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Физическая химия: конспект лекций.
8. Факторы, влияющие на перенапряжение водорода. Перенапряжение кислорода.
Факторы, влияющие на ηН2:
1) ρтока (плотность тока). Зависимость от плотности тока описывается уравнением Тафеля;
2) природа материала катода – ряд по возрастанию η, η– перенапряжение.
В уравнении Тафеля соnst а характеризует зависимость ηот природы материала катода, а константа b отражает зависимость от плотности тока.
В классическом варианте b – 0,12В, а – меняется в широких пределах, из-за разных металлов и разных катодных взаимодействий с Н2.
а – 0,01…1,0 В, чем больше а, тем большеη Н2. Большим η Н2 обладают: Нg, Рb, Zn, низким ηН2 – Рt, средним ηН2 – Fе, Со, Ni;
3) состав раствора. Наибольшее ηв рН = 7, а в рН
http://znaesh-kak.com/q/a/%D0%BA%D0%B8%D0%BD%D0%B5%D1%82%D0%B8%D0%BA%D0%B0-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%B4%D0%BD%D1%8B%D1%85-%D0%BF%D1%80%D0%BE%D1%86%D0%B5%D1%81%D1%81%D0%BE%D0%B2
http://ur-consul.ru/Bibli/Fizichyeskaya-khimiya-konspyekt-lyektsiyi.74.html
















