Коэффициенты в уравнении дебая хюккеля
Дебай и Хюккель, предложив модель, которая легла в основу теории сильных электролитов, постулировали:
Электролит полностью диссоциирует, но в сравнительно разбавленных растворах ().
Каждый ион окружен оболочкой из ионов противоположного знака. В свою очередь, каждый из этих ионов сольватирован. Это окружение называется ионной атмосферой.
Очевидно, что при электростатическом взаимодействии ионов противоположных знаков необходимо учитывать влияние ионной атмосферы. При движении катиона в электростатическом поле ионная атмосфера деформируется; она сгущается перед ним и разрежается позади него. Эта асимметрия ионной атмосферы оказывает тем более тормозящее действие движению катиона, чем выше концентрация электролитов и чем больше заряд ионов. В этих системах само понятие концентрации становится неоднозначиным и должно заменяться активностью. Для бинарного одно-однозарядного электролита активности катиона () и аниона () соответственно равны
 |
где и – аналитические концентрации соответственно катиона и аниона, γ+ и γ– – их коэффициенты активности.
Определить активности каждого иона в отдельности невозможно, поэтому для одно-однозарядных электролитов пользуются средними геометрическими значений активностей и коэффициентов активностей:
  |
Коэффициент активности по Дебаю–Хюккелю зависит по крайней мере от температуры, диэлектрической проницаемости растворителя (ε) и ионной силы (); последняя служит мерой интенсивности электрического поля, создаваемого ионами в растворе.
Для данного электролита ионная сила выражается уравнением Дебая–Хюккеля:
|
Ионная сила в свою очередь равна
|
Здесь – аналитическая концентрация, – заряд катиона или аниона. Для одно-однозарядного электролита ионная сила совпадает с концентрацией. Таким образом, NaCl и Na2SO4 при одинаковых концентрациях будут иметь разные ионные силы. Сопоставление свойств растворов сильных электролитов можно проводить только тогда, когда ионные силы одинаковы; даже небольшие примеси резко изменяют свойства электролита.
На рис. 6.6 сопоставляются вычисленные и экспериментальные значения lg γ± при различных ионных силах. Из него видно, что уравнение Дебая–Хюккеля выполняется только для разбавленных растворов.
 1 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рисунок 6.6 Пунктирные прямые рассчитаны по уравнению Дебая–Хюккеля. Знание коэффициентов активностей позволяет оценить реальные свойства сильных электролитов. ИЗМЕРЕНИЕ УДЕЛЬНОЙ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРОВ СЛАБЫХ ЭЛЕКТРОЛИТОВЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Измерения электрической проводимости растворов производят с помощью приборов, называемых кондуктометрами. Методика выполнения измерений описана в инструкции, прилагаемой к используемому прибору. Любые исследования, основанные на измерении электрической проводимости, объединяются под названием кондуктометрии. Кондуктометрические методы применяются для изучения свойств как сильных, так и слабых электролитов. РАБОТА № 1 ИЗМЕРЕНИЕ УДЕЛЬНОЙ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ Цель работы:определение предельной молярной проводимости и коэффициентов проводимости сильных электролитов. Электролит: CH3COONa
1. Постройте график 2. Рассчитайте эквивалентную электрическую проводимость каждого раствора: 3. Постройте график 4. Рассчитайте значение 5. Сравните Λ0 найденное графически, с теоретическим. 6. Рассчитайте коэффициент проводимости для каждого раствора fΛ=Λ/Λ0 7. Сделайте вывод о влиянии концентрации на взаимодействие между ионами. В растворах слабых электролитов, чем выше концентрация, тем ниже коэффициент проводимости. По теории Дебая — Онзагера снижение эквивалентной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций связано с уменьшением скоростей движения ионов. Это объясняется появлением эффектов торможения движения ионов, возникающих за счет сил электростатического взаимодействия между ионом и его ионной атмосферой. 8. Установите область концентрации, для которой применимо уравнение Кольрауша. Уравнение Кольрауша, в соответствии с графиком, применимо к области концентраций от 0,01 моль/м 3 до 0,1 моль/м 3 9. Найдите значение предельной электропроводности электролита и коэффициента А по уравнению Кольрауша. y = -0,0005x + 0,0079 10. Результаты измерений занесите в таблицу. 11. Рассчитайте значение углового коэффициента в уравнении Дебая-Хюккеля-Онзагера, если ε=78,25; η=0,894*10 -3 Па*с; Уравнение Дебая-Хюккеля-Онзагера (1,1 – электролит) Подставив значения, получим (q = 1/2, так как электролит симметричен): 12. Сравните значения полученных угловых коэффициентов: A (графическая) = 0,0005 А (аналитическая) = 0,008097 13. Определите подвижность катиона и аниона, если число переноса аниона дано в таблице. 14. Предельную электрическую подвижность катиона в водном растворе. 15. Скорость движения катиона при градиенте поля 100 В/м. 16. Стоксов радиус иона (для воды η = 0,894 * 17. Подвижность катиона при бесконечном разведении в ацетоне и нитрометане, вязкости которых при этой температуре соответственно равны 0,310∙ Работа №2 ИЗМЕРЕНИЕ УДЕЛЬНОЙ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРОВ СЛАБЫХ ЭЛЕКТРОЛИТОВ Цель работы:определение степени диссоциации слабых электролитов при разных концентрациях и константы диссоциации. Электролит: CH3COOH
1. Рассчитать эквивалентную проводимость растворов. 2. Построить графики зависимости 3. Пользуясь величинами предельных подвижностей ионов, по закону независимого движения ионов рассчитайте предельную молярную проводимость электролита. 4. Рассчитайте степень диссоциации слабого электролита в каждом исследуемом растворе. 5. Постройте график зависимости α от концентрации раствора. 6. По закону разбавления Оствальда рассчитайте константу диссоциации для каждого раствора и найдите ее среднее значение. 7. По графикам в координатах 8. Сравните найденное значение константы диссоциации с табличным значением. К(найденное) = 2,24*10 -7 К(табличное) = 1,8*10 -5 9. Сделайте вывод о влиянии концентрации раствора на величины α и Ка У слабых электролитов степень и константа диссоциации понижаются с повышением концентрации раствора. источники: http://poisk-ru.ru/s23046t19.html |


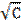

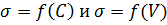 .
. 


 . Путем экстраполяции определите Λ0.
. Путем экстраполяции определите Λ0.
 0,0079
0,0079 по закону независимого движения ионов исходя из предельных подвижностей.
по закону независимого движения ионов исходя из предельных подвижностей.



 где А = 0,0005;
где А = 0,0005;




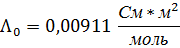
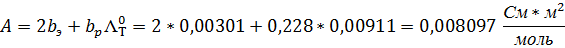





 Па*с).
Па*с).





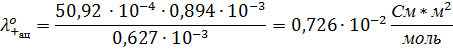
 и
и 



 или
или  из угла наклона прямых найдите Λ0 и Ка
из угла наклона прямых найдите Λ0 и Ка



