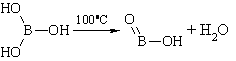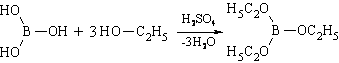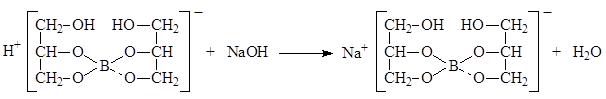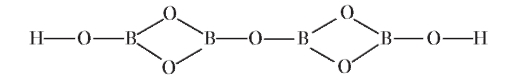Количественное определение борной кислотой уравнение реакции
ЛП неорганической природы
SHAPE \* MERGEFORMAT
Acidum boricum – Кислота борная
Описание. Белые блестящие, слегка жирные на ощупь чешуйки или мелкий кристаллический порошок без запаха. Летуч с парами воды и спирта. При продолжительном нагревании (до 100°С) теряет часть воды, переходя в метаборную кислоту ( HBO 2 ), при более сильном нагревании образуется стекловидная масса ( H 2 B 4 O 7 ), которая при дальнейшем нагревании, вспучиваясь, теряет всю воду и переходит в борный ангидрид ( B 2 O 3 ) бурого цвета. Водный раствор имеет слабокислую реакцию.
Растворимость. Растворим в 25 ч. воды, в 4 ч. кипящей воды, в 25ч. спирта, медленно в 7 частях глицерина.
Получение. Из природных минералов: ашарит ( Mg 2 B 2 O 5 ∙ H 2 O ), сассолин ( H 3 BO 3 ), бура ( Na 2 B 4 O 7 ∙10 H 2 O ), борокальций ( CaB 4 O 7 ∙10 H 2 O ):
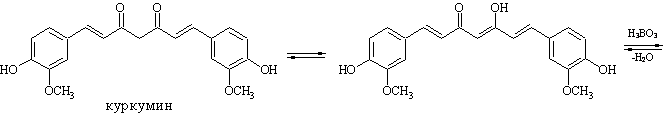
1. Реакция с куркумином (ГФ Х). Куркумовая бумага, смоченная раствором препарата и раствором соляной кислоты, окрашивается при высушивании в розовый или буровато-красный цвет, переходящий от смачивания раствором аммиака в зеленовато-черный:
SHAPE \* MERGEFORMAT
SHAPE \* MERGEFORMAT
Недопустимо присутствие Fe , Mo , W (образуют комплексы подобного цвета).
2. Образование борноэтилового эфира (ГФ Х) , горящего пламенем с зеленой каймой:
Примеси. Допустимые: мышьяк, хлориды, сульфаты, железо, тяжелые металлы, кальций.
Количественное определение (ГФ Х). Прямая алкалиметрия.
Титрант – NaOH , индикатор – фенолфталеин, среда – глицерин.
f экв ( H 3 BO 3 )=1, 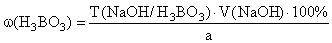
Количественное определение. Кислота борная определяется алкалиметрическим методом нейтрализации в присутствии глицерина (нейтрализованного по фенолфталеину)
Кислота борная определяется алкалиметрическим методом нейтрализации в присутствии глицерина (нейтрализованного по фенолфталеину). Метод основан на кислотных свойствах кислоты глицеринборной. Индикатор – фенолфталеин.
f экв.(кислоты борной) = 1,
так как из одной молекулы кислоты борной образуется одна молекула одноосновной кислоты глицеринборной.
Образующаяся при титровании натриевая соль кислоты глицеринборной частично может гидролизоваться. В этом случае розовое окрашивание по фенолфталеину может появиться раньше точки эквивалентности. Поэтому после появления розового окрашивания добавляют еще порцию глицерина и, если окраска исчезла, продолжают титровать.
Оттитровать кислоту борную раствором натрия гидроксида без добавления глицерина невозможно, так как при этом будут образовываться сильно гидролизующиеся соли.
Натрия тетраборат определяют ацидиметрическим методом вытеснения. Метод основан на вытеснении слабой борной кислоты из соли при действии сильной минеральной кислоты. Проводят прямое титрование раствором кислоты хлороводородной, индикатор – метиловый оранжевый.
f экв.(натрия тетрабората) = 1/2
Хранение
В хорошо укупоренной таре. Кислота борная устойчива при хранении, натрия тетраборат может выветриваться.
Применение
Наружно как антисептические средства в виде водных, спиртовых и глицериновых растворов, мазей, присыпок
Формы выпуска
Кислота борная – субстанция; 1-2-3% спиртовые растворы, 10% раствор в глицерине, 5% мазь.
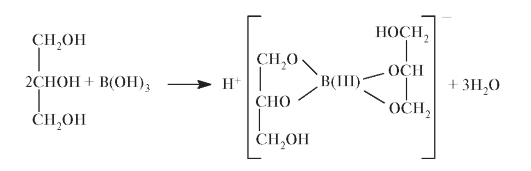
Количественное определение. Для количественного определения борной кислоты применяют метод нейтрализации, основанный на титровании щелочью комплексных соединений борной кислоты с
Для количественного определения борной кислоты применяют метод нейтрализации, основанный на титровании щелочью комплексных соединений борной кислоты с многоатомными спиртами (глицерин) или углеводами (маннит, дульцит, сорбити др.).
При этом образуются комплексные соединения с более выраженными, чем у борной кислоты, кислотными свойствами: глицерин-борная, маннит-борная и другие кислоты. К примеру, при взаимодействии ортоборной кислоты с глицерином образуется кислота в виде диглицератного комплекса:
Комплексная кислота титруется щелочью в присутствии фенолфталеина:
1 мл 1 моль/л раствора NaOH эквивалентен 61,8 мг H3BO3.
Чтобы избежать распада образующейся комплексной кислоты и сместить равновесие вправо, в конце титрования в реакционную смесь добавляют глицерин.
При количественном определении борной кислоты следует брать для растворения навески прокипяченную воду, не содержащую СО2, так как угольная кислота может вытеснять более слабую борную кислоту из ее солей. Раствор едкой щелочи, применяемый для титрования Н3ВО3, также должен быть свободен от карбонатов.
Натрия тетраборат
Строение и свойства
Тетраборная кислота H2B4O7 в свободном виде не существует. Ее строение может быть представлено структурой:
Соли этой кислоты — тетрабораты — широко распространены, к ним, например, относится бура Na2B4O7 • 10 H2O, которую используют в качестве антисептика.
Получение
Натрия тетраборат образуется при нейтрализации тетрагидроксобората водорода водными растворами щелочей:
Известен также способ получения натрия тетрабората из борокальцитов:
Механизм действия
Применение натрия тетрабората в медицине основано на его антисептическом и вяжущем действии. В виде 1-2% раствора назначают для спринцевания, полоскания, смазывания. Входит в состав таблетированной лекарственной формы бикарминт — средства для полосканий, промываний, ингаляций при воспалительных процессах верхних дыхательных путей.
Контроль качества
Определение подлинности
Идентификацию фармацевтической субстанции Sodium tetraborate выполняют, определяя присутствие тетраборат-иона, иона натрия и рН раствора.
Бура дает все реакции, характерные для борной кислоты. Бура в присутствии концентрированной серной кислоты образует эфиры с метанолом, этанолом, глицерином, фенолами, которые при сгорании окрашивают пламя в зеленый цвет.
Отличительной реакцией является окрашивание пламени в желтый цвет — качественная реакция на ион Na+. В отличие от Н3ВО3, водный раствор буры имеет щелочную реакцию: рН 4% водного раствора составляет 9,0-9,6.
Если к водному раствору натрия тетрабората, имеющему в присутствии фенолфталеина красную окраску, добавить глицерин, то окраска исчезает.
Неофицинальной реакцией идентификации буры является вытеснение борной кислоты из соли сильной кислотой, например хлороводородной. После охлаждения раствора борная кислота выпадает в осадок:
Испытание на чистоту
Водный раствор буры (4%) должен быть прозрачным и бесцветным. Допустимые примеси: сульфаты — ≤50 мкг/г; аммиак — ≤10 мкг/г; мышьяк — ≤5 мкг/г; кальций — ≤10 мкг/г; тяжелые металлы —
http://helpiks.org/7-47922.html
http://lektsii.org/8-54427.html