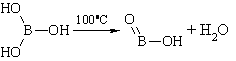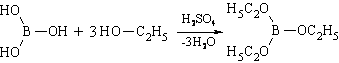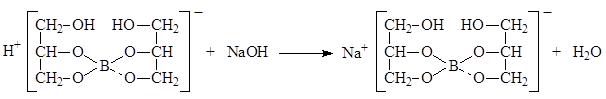Количественное определение борной кислоты уравнение реакции
ЛП неорганической природы
SHAPE \* MERGEFORMAT
Acidum boricum – Кислота борная
Описание. Белые блестящие, слегка жирные на ощупь чешуйки или мелкий кристаллический порошок без запаха. Летуч с парами воды и спирта. При продолжительном нагревании (до 100°С) теряет часть воды, переходя в метаборную кислоту ( HBO 2 ), при более сильном нагревании образуется стекловидная масса ( H 2 B 4 O 7 ), которая при дальнейшем нагревании, вспучиваясь, теряет всю воду и переходит в борный ангидрид ( B 2 O 3 ) бурого цвета. Водный раствор имеет слабокислую реакцию.
Растворимость. Растворим в 25 ч. воды, в 4 ч. кипящей воды, в 25ч. спирта, медленно в 7 частях глицерина.
Получение. Из природных минералов: ашарит ( Mg 2 B 2 O 5 ∙ H 2 O ), сассолин ( H 3 BO 3 ), бура ( Na 2 B 4 O 7 ∙10 H 2 O ), борокальций ( CaB 4 O 7 ∙10 H 2 O ):
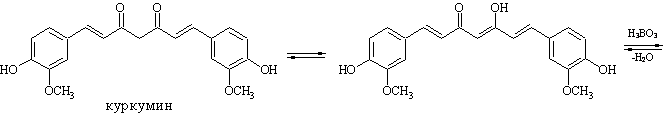
1. Реакция с куркумином (ГФ Х). Куркумовая бумага, смоченная раствором препарата и раствором соляной кислоты, окрашивается при высушивании в розовый или буровато-красный цвет, переходящий от смачивания раствором аммиака в зеленовато-черный:
SHAPE \* MERGEFORMAT
SHAPE \* MERGEFORMAT
Недопустимо присутствие Fe , Mo , W (образуют комплексы подобного цвета).
2. Образование борноэтилового эфира (ГФ Х) , горящего пламенем с зеленой каймой:
Примеси. Допустимые: мышьяк, хлориды, сульфаты, железо, тяжелые металлы, кальций.
Количественное определение (ГФ Х). Прямая алкалиметрия.
Титрант – NaOH , индикатор – фенолфталеин, среда – глицерин.
f экв ( H 3 BO 3 )=1, 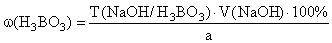
Количественное определение. Кислота борная определяется алкалиметрическим методом нейтрализации в присутствии глицерина (нейтрализованного по фенолфталеину)
Кислота борная определяется алкалиметрическим методом нейтрализации в присутствии глицерина (нейтрализованного по фенолфталеину). Метод основан на кислотных свойствах кислоты глицеринборной. Индикатор – фенолфталеин.
f экв.(кислоты борной) = 1,
так как из одной молекулы кислоты борной образуется одна молекула одноосновной кислоты глицеринборной.
Образующаяся при титровании натриевая соль кислоты глицеринборной частично может гидролизоваться. В этом случае розовое окрашивание по фенолфталеину может появиться раньше точки эквивалентности. Поэтому после появления розового окрашивания добавляют еще порцию глицерина и, если окраска исчезла, продолжают титровать.
Оттитровать кислоту борную раствором натрия гидроксида без добавления глицерина невозможно, так как при этом будут образовываться сильно гидролизующиеся соли.
Натрия тетраборат определяют ацидиметрическим методом вытеснения. Метод основан на вытеснении слабой борной кислоты из соли при действии сильной минеральной кислоты. Проводят прямое титрование раствором кислоты хлороводородной, индикатор – метиловый оранжевый.
f экв.(натрия тетрабората) = 1/2
Хранение
В хорошо укупоренной таре. Кислота борная устойчива при хранении, натрия тетраборат может выветриваться.
Применение
Наружно как антисептические средства в виде водных, спиртовых и глицериновых растворов, мазей, присыпок
Формы выпуска
Кислота борная – субстанция; 1-2-3% спиртовые растворы, 10% раствор в глицерине, 5% мазь.
Конспект по химии по теме «Методика количественного определения борной кислоты»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Методика количественного определения борной кислоты
В основе количественного определения борной кислоты лежит метод кислотно-основного титрования и, в частности, метод алкалиметрии.
Борная кислота – слабая, ее нельзя титровать щелочью непосредственно, так как продуктом такого титрования будет являться соль метаборной кислоты, в водном растворе подвергающаяся гидролизу, вследствие чего затруднительным является определение точки эквивалентности.
Чтобы усилить кислотные свойства борной кислоты, следует использовать ее способность реагировать с многоатомными спиртами с образованием комплексных соединений с более сильными кислотными свойствами.
При этом использовано будет заместительное титрование рабочим раствором щелочи.
Реакцию, лежащую в основе количественного определения борной кислоты, можно представить следующим образом:
n ( H 3 BO 3) = 2 n ( C 3 H 8 O 3) = n (комплексной кислоты) = n ( NaOH )
Таким образом титрованию рабочим раствором гидроксида натрия подвергается глицеринборная кислота.
Индикатором при титровании будет являться фенолфталеин, так как его интервал перехода составляет 8,0 – 10,0, а показатель титрования – 9,0 — индикатор меняет цвет в щелочной области, что является оптимальным условием при титровании слабой кислоты сильным основанием.
Определим титр рабочего раствора гидроксида натрия по борной кислоте
T H3BO3/NaOH = = = 0,0062 г/мл.
(1мл. 0,1н раствора гидроксида натрия реагирует с 0,0062 г. борной кислоты, фактор эквивалентности борной кислоты в данном случае равен 1)
Расход титранта должен составить около 20 мл., так что масса оттитрованной борной кислоты составит
m( т ) = T H3BO3/NaOH * 20 ≈ 0,124 г .
Таким образом, мы получили значение массы теоретической навески борной кислоты, содержащейся в аликвоте ее раствора. Значение массы навески необходимо для приготовления титруемого раствора борной кислоты нужного объема и концентрации.
В ходе титрования точную навеску борной кислоты растворяем в горячей воде, охлаждаем, взвешиваем раствор, прибавляем к нему раствор глицерина, предварительно нейтрализованный по фенолфталеину. Титруем 0,1н раствором едкого натра до розового окрашивания. Затем к раствору прибавляем еще нейтрализованного глицерина и, если розовая окраска раствора при этом исчезает, снова титруем до появления розовой окраски раствора. Добавление глицерина и титрование едким натром продолжаем до тех пор, пока от последних порций нейтрализованного глицерина розовая окраска раствора не перестанет исчезать. Отмечаем объем NaOH , израсходованный на титрование. Титрование повторяем до 3-х воспроизводимых результатов.
По завершении титрования процентная концентрация раствора борной кислоты может быть определена по формуле
V ср. р-ра ( NaOH ) – средний объем израсходованного титранта, определяемый по формуле
http://helpiks.org/7-47922.html
http://infourok.ru/konspekt-po-himii-po-teme-metodika-kolichestvennogo-opredeleniya-bornoj-kisloty-4379909.html