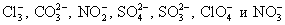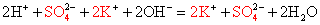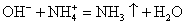Конспект по химии ионные уравнения
Ключевые слова конспекта: свойства ионов, определение ионов, реакции ионного обмена, ионное уравнение, реакции в растворах электролитов.
Свойства ионов
Число электронов в атоме равно числу протонов. Протоны и нейтроны прочно связаны друг с другом и образуют ядро атома. Ион – атом или часть молекулы, где есть неравное количество электронов и протонов. Если электронов больше, чем протонов, то ион называют отрицательным. Иначе ион называют положительным.
Ионы отличаются от атомов строением и свойствами. Некоторые ионы бесцветны, а другие имеют определенный цвет. Для каждого из ионов характерны специфические химические свойства.
Таблица 1. Определение ионов
Определяемый ион
Результат реакции
* При определении галогенид-ионов с помощью серной кислоты используют твердую соль.
Ионное уравнение
В водных растворах все электролиты в той или иной степени распадаются на ионы и реакции происходят между ионами.
Сущность реакций в растворах электролитов отражается ионным уравнением. В ионном уравнении учитывается то, что сильный электролит в растворе находится в диссоциированном виде. Формулы слабых электролитов и нерастворимых в воде веществ в ионных уравнениях принято записывать в недиссоциированной на ионы форме. Растворимость электролита в воде нельзя считать критерием его силы. Многие нерастворимые в воде соли являются сильными электролитами, однако концентрация ионов в растворе оказывается низкой вследствие низкой растворимости. Именно поэтому в уравнениях их формулы записывают в недиссоциированной форме.
При составлении ионных уравнений реакций с участием сильных кислот часто для упрощения записывают формулу иона Н + , а не H3O + .
Реакции в растворах электролитов происходят в направлении связывания ионов. Существует несколько форм связывания ионов: образование осадков, выделение газообразных веществ, образование слабых электролитов. Рассмотрим конкретные примеры:
- Образование осадков.
Уравнение в молекулярном виде: Ca(NO3)2 + Na2CO3 = СаСO3↓ + 2NaNO3
Полное ионное уравнение:
Сокращенное ионное уравнение:
- Образование слабых электролитов (например, воды, слабых кислот):
а) КОН + НCl = КCl + H2O
К + + OH – + Н + + Cl – = К + + Cl – + H2O
OH – + Н + = H2O
б) HNO2 – азотистая кислота (слабая):
NaNO2 + НCl = NaCl + HNO2
Na + + NO2 + Н + + Cl – = Na + + Cl – + HNO2
NO2 – + Н + = HNO2
Иногда реакции в растворах электролитов осуществляются с участием нерастворимых веществ или слабых электролитов в направлении более полного связывания ионов. Например, мрамор растворяется в соляной кислоте с образованием углекислого газа:
Таблица 2. Уравнения ионных реакций
Реакции ионного обмена
Для ионных реакций выражение «в молекулярном виде», как и сама запись, является условным. При анализе приведенных в Таблице 2 уравнений реакций выясняется, что реакции ионного обмена протекают до конца в следующих случаях:
- если выпадает осадок;
- если выделяется газ;
- если образуется малодиссоциирующее вещество, например вода.
Если в растворе нет таких ионов, которые могут связываться между собой, реакция обмена не протекает до конца, т. е. является обратимой. При составлении уравнений таких реакций, как и при составлении уравнений диссоциации слабых электролитов, ставится знак обратимости.
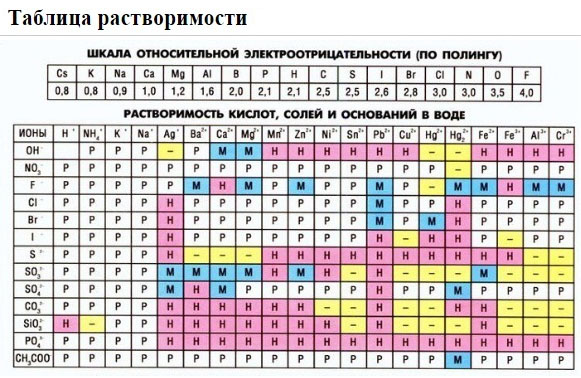
Чтобы сделать вывод о протекании реакции ионного обмена до конца, надо использовать данные таблицы растворимости солей, оснований и кислот в воде.
Чтобы составить уравнения всех возможных реакций, в которых участвуют хлорид магния и другие растворимые в воде вещества, рассуждают так:
- Убеждаются, растворимо ли в воде взятое вещество, в данном случае хлорид магния MgCl2.
- Приходят к выводу, что хлорид магния MgCl2 будет реагировать только с такими растворимыми в воде веществами, которые способны осадить либо ионы Mg 2+ , либо хлорид-ионы Сl – .
- Ионы Mg 2+ можно осадить: а) ионами ОН – , т. е. нужно подействовать любой щелочью, что приведет к образованию малорастворимого гидроксида магния Mg(OH)2; б) при действии растворимыми в воде солями, содержащими один из следующих анионов:
. Для этого можно воспользоваться солями натрия, калия и аммония, содержащими указанные анионы, так как эти соли растворимы в воде.
- Хлорид-ионы Сl – можно осадить катионами Ag + + и Pb 2+ . Поэтому для проведения реакции нужно выбрать растворимые соли, содержащие эти катионы.
При составлении уравнений реакций ионного обмена, в которых образуются газообразные вещества, следует учесть, что анионы 
В свете представлений об электролитической диссоциации кислот, оснований и солей общие свойства этих веществ определяются наличием общих ионов, которые входят в их состав
Конспект урока «Реакции ионного обмена. Ионное уравнение». Выберите дальнейшее действие:
Конспект урока по химии » Ионные уравнения»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
МБОУ СОШ №2 им.В.В. Дагаева г.о Лосино- Петровский Московской области
Пырлик Ирина Валерьевна
учитель химии МБОУ СОШ № 2 им. В.В.Дагаева
РАЗРАБОТКА УРОКА ХИМИИ В 8 КЛАССЕ
ПО ТЕМЕ «ИОННЫЕ УРАВНЕНИЯ»
Д анный урок проводится в теме «Растворение. Растворы. Свойства растворов электролитов», по УМК О. С. Габриеляна.
Тип учебного занятия: урок изучения нового материала.
— закрепить знания об «ионах»;
— сформировать понятия: «ионные реакции», «ионные уравнения»;
— научить составлять полные и сокращенные ионные уравнения реакций, используя алгоритм.
на основе усвоенных понятий о реакциях обмена и электролитической диссоциации веществ разных классов сформировать понятие «реакции ионного обмена», закрепить понятие «реакции нейтрализации»;
экспериментально доказать, что реакции в растворах электролитов являются реакциями между ионами; выявить условия, при которых они идут практически до конца
научить составлять молекулярные, полные и сокращённые ионные уравнения; по сокращённому ионному уравнению определять продукты реакции.
совершенствовать учебные умения школьников при составлении химических уравнений, при выполнении лабораторных опытов;
воспитывать чувство ответственности, уверенности в себе, требовательности к себе; умение работать в парах.
Оборудование и реактивы: растворы ВаС l 2 и Na 2 S0 4 , Na 2 СО 3 и H 2 S0 4 , NaOH и H 2 S0 4 , CuS0 пипетка, пробирки, фенолфталеин, таблица растворимости солей, кислот и оснований.
1. Организационный момент
2. Проверка домашнего задания
Сформулируйте основные положения теории электролитической диссоциации . Какие вещества называются электролитами? Какие вещества к ним относятся?
Выберите из предложенных веществ неэлектролиты.
Презентация. (Слайд 1)
Что такое электролитическая диссоциация?
Какие ионы образуются при диссоциации оснований? (Слайд 2)
Какие ионы образуются при диссоциации кислот? (Слайд 3)
Какие ионы образуются при диссоциации солей? (Слайд 4)
8.Какие реакции называют реакциями обмена? (Слайд 5)
3. Актуализация опорных знаний.( Слайд 6)
Сформулировать тему урока с помощью лабиринта
Итак, опираясь на знания о реакциях обмена и условиях их протекания до конца, а также электролитической диссоциации кислот, солей, оснований при растворении в воде, на сегодняшнем уроке мы узнаем, какие реакции называются реакциями ионного обмена и научимся составлять ионные уравнения .
Тема сегодняшнего урока: Ионные уравнения .
Чему мы научимся сегодня на уроке?
4. Изучение нового материала
а) определение ионного уравнения № 1 с. 121
Найдите в учебнике определение ионных реакций и запишите его в тетрадях. (Затем один из учащихся читает это определение).
Реакции, осуществляемые в растворах между ионами, называются ионными, а уравнения таких реакций — ионными уравнениями
Теория электролитической диссоциации признает, что все реакции в водных растворах электролитов являются реакциями между ионами. Реакции в водных растворах электролитов изображаются в виде ионных уравнений. С помощью данных уравнений можно определить, какие ионы из смеси связаны в молекулу неустойчивого слабого электролита или малодиссоциирующего вещества.
Основные правила составления ионных уравнений реакций:
б) Правила составления ионных уравнений:
1. Формулы малодиссоциирующих, газообразных веществ и неэлектролитов изображают в молекулярном виде.
2. С помощью знака (↑ — газ, ↓ — осадок) отмечают «путь удаления» вещества из сферы реакции (раствора).
3. Формулы сильных электролитов записываются в виде ионов.
4. Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в виде ионов.
5. Если малорастворимое вещество образуется в результате реакции, то оно выпадает в осадок, и в ионном уравнении его записывают в виде молекулы.
6. Сумма зарядов ионов в левой части уравнения должна быть равна сумме зарядов ионов в правой части.
Ионные уравнения могут быть полными и сокращенными.
Рассмотрим пример взаимодействия сульфата меди и гидроксида натрия.
в) Алгоритм составления ионных уравнений
2. С помощью таблицы растворимости определить растворимость каждого вещества
3. Решить, уравнения диссоциации каких исходных веществ и продуктов реакции нужно записывать
Cu(OH) 2 — малодиссоциирующее
4. Составить полное ионное уравнение (коэффициенты перед молекулами равны коэффициентам перед ионами)
Cu 2+ +SO 4 2- +2Na + +2OH — =Cu(OH) 2 ↓ + 2Na + +SO 4 2-
5. Найти одинаковые ионы и сократить их
Cu 2+ +SO 4 2- +2Na + +2OH — =Cu(OH) 2 ↓ + 2Na + +SO 4 2-
6. Записать сокращенное ионное уравнение
Cu 2+ + 2 OH — = Cu ( OH ) 2 ↓
В чем сущность данной реакции?
Что образовалось в результате реакции? ( Сущность данной реакции сводится к взаимодействию ионов Cu 2+ и 2 OH — ; в результате этого взаимодействия образуется осадок Cu ( OH ) 2 )
Данные ионы могли входить в состав любого электролита и наблюдалась бы аналогичная реакция.
В каком случае реакции протекают до конца?
Реакции ионного обмена в растворах электролитов практически осуществимы (протекают до конца) только в тех случаях, когда в результате реакции образуется осадок, газ, или малодиссоциирующее вещество, а так же вода.
1.Проводим опыт №1.
Оборудование и реактивы: растворы ВаС l 2 и Na 2 SО4, пипетка, чистые пробирки.
В пробирку с растворомВ аС L 2, закреплённую в пробиркодержателе, добавляем раствор Н2 SO 4 .
Что наблюдаем? Запишите молекулярное уравнение химической реакции
Сливая растворы BaCL 2, и Na 2 SO 4, наблюдаем образование осадка BaSO 4 в растворе остаётся NaCL .
Как обозначается осадок в реакции?
BaCl 2 + Na 2 SO 4 = 2 NaCL + BaSO 4↓
Какой тип реакции?
Запись уравнения сильным учеником у доски
— Исходные соли — сильные электролиты, полностью диссоциирующие в воде
Ba2 + + 2CL — →2Na + + SO42 — = 2Na + + 2CL — + BaSO4 ↓
Полное ионное уравнение
Одна из полученных солей также остаётся в растворе диссоциированной на ионы 2 Na + и 2 CL — , а вот BaSO 4- нерастворимое соединение, не диссоциирующее в воде, поэтому его переписываем в молекулярном виде.
Ионы Ba 2 + и SO 42 — — соединились и образовали BaSO 4, выпавший в осадок.
Ионы же 2 Na + и 2 CL — в реакции не участвовали, они остались такими, какими были и до сливания растворов, следовательно, мы можем исключить их обозначение из левой и правой частей полного ионного уравнения. Что осталось?
Ba 2 + + SO 42 — = BaSO 4↓
Сокращённое ионное уравнение
Это уравнение показывает, что данная реакция сводится к взаимодействию ионов Ba 2 + и SO 42 — , в результате которого образуется осадок BaSO 4. Важно знать, в состав каких электролитов входили эти ионы до реакции: аналогичное взаимодействие можно наблюдать между растворами солей содержащих хлорид – ион с Na 2 SO 4. Поэтому, суть всех этих реакций будет сводиться к взаимодействию Ba 2 + и SO 42 — с образованием BaSO 4.
Оборудование и реактивы: растворы карбоната натрия Na 2 CO 3 , серной кислоты H 2 SO 4 , штатив с пробирками.
Налейте в чистую пробирку ≈1 мл раствора карбоната натрия Na 2 CO 3 и к нему прилейте аккуратно ≈1 мл серной кислоты H 2 SO 4 . Какие признаки реакции вы наблюдали? (Выделение газа.)
Записываем уравнение реакции в молекулярном и ионном виде по этапам (Слайд 15)
Итак, второе условия протекания реакций ионного обмена – это выпадение газа (Слайд 15)
К взаимодействию, каких ионов сводится эта химическая реакция? (ионов водорода и карбонат-ионов) (Слайд 16)
Проводим опыт № 3.
Лабораторный опыт № 3 “Реакции, идущие с образованием слабого электролита – воды”.
Оборудование и реактивы: растворы гидроксида натрия NaОН, серной кислоты H 2 SO 4 , фенолфталеина, штатив с пробирками.
Налейте в чистую пробирку ≈1 мл раствора гидроксида натрия NaОН и к нему прилейте по каплям фенолфталеин. Какие признаки реакции вы наблюдали? (изменение цвета), затем прилейте аккуратно ≈1 мл серной кислоты H 2 SO 4 . Какие признаки реакции вы наблюдали? (исчезновение цвета)
Записываем уравнение реакции в молекулярном и ионном виде по этапам (Слайд 17)
К взаимодействию, каких ионов сводится эта химическая реакция? (ионов водорода и гидроксид-ионов)
Итак, третье условия протекания реакций ионного обмена – это образование слабого электролита – воды. (Слайд 17)
Реакции между кислотой и основанием называются реакциями нейтрализации.
4. KOH + NaNO 3 = KNO 3 + NaOH
K + + OH — + Na + + NO 3 — = K + + NO 3 — + Na + + ОН —
Можем ли мы здесь написать сокращенное ионное уравнение? Почему? (с окращенного ионного уравнения нет, так как в растворе присутствует смесь ионов и, следовательно, реакция обратима)
Какова сущность сокращенного ионного уравнения? (с окращенные ионные уравнения показывают сущность процесса, протекающего между растворами электролитов)
5. Проверка первичного усвоения материала
1. Реакции ионного обмена – это реакции:
А. Разложения. В . Обмена
Б. Замещения. Д. Соединения
2. Укажите уравнение реакции ионного обмена:
3. Реакцией нейтрализации является реакция между парой веществ:
5. Формулы веществ, при взаимодействии которых образуется вода:
А.Fe(OH) 2 иHNO 3
Б .КOHиHNO 3
В.КOHиZn(NO 3 ) 2
Д.MgCO 3 и Ba(NO 3 ) 2
6. Закрепление изученного материала
§37, вопросы № 2 с. 155, в тетради № 4 с. 123 (в-ж)
Что мы изучили сегодня на уроке?
Что такое «реакции ионного обмена» ?
Мы рассмотрели реакции, протекающие в растворах электролитов с образованием осадка, газа или малодиссоциирующего вещества: растворы электролитов содержат ионы, поэтому, реакции в растворах электролитов происходят между ионами. Сформулируем определение понятия «реакции ионного обмена» — реакции между ионами в растворах электролитов, протекающие с выделением осадка, газа или воды.
Какая часть урока показалась вам наиболее интересной и познавательной?
С каким настроением вы уходите с урока?
Что вам понравилось на уроке? Не понравилось?
Что в уроке вызвало затруднения?
Урок окончен. Спасибо за урок!
Для того чтобы проверить степень усвоения данного материала, на следующем уроке я провела такую работу:
Каждый ученик класса получил карточку с заданиями как теоретическими, так и практическими.
1. Закончить уравнение реакции:
Запишите реакцию в полной и сокращенной ионной форме.
2. Выберите из списка на доске пару веществ, при взаимодействии которых образуется осадок. Запишите ее в молекулярной, полной и сокращенной ионной форме.
1. Закончить уравнение реакции:
Запишите реакцию в полной и сокращенной ионной форме.
2. Выберите из списка на доске пару веществ, при взаимодействии которых образуется осадок. Запишите ее в молекулярной, полной и сокращенной ионной форме.
Некоторых ребят вызываю к доске провести эксперимент.
Данный урок способствует усвоению знаний об ионных уравнениях, учащиеся на уроке совершенствуют умение составлять молекулярные, полные и сокращённые ионные уравнения; по сокращённому ионному уравнению определять продукты реакции.
Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

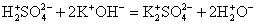
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.
АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
Записываем молекулярное уравнение химического процесса.
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
- растворимые соли;
- сильные кислоты (H2SO4, HNO3, HCl и др.);
- растворимые в воде основания.
Записываем в виде молекул:
- нерастворимые соли;
- слабые кислоты, щелочи, вода;
- оксиды;
- газы;
- простые вещества;
- большинство органических соединений.
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
Записываем молекулярное уравнение, проверяем коэффициенты.
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.
http://infourok.ru/konspekt-uroka-po-himii-ionnie-uravneniya-3384089.html
http://rosuchebnik.ru/material/ionnye-uravneniya/





 . Для этого можно воспользоваться солями натрия, калия и аммония, содержащими указанные анионы, так как эти соли растворимы в воде.
. Для этого можно воспользоваться солями натрия, калия и аммония, содержащими указанные анионы, так как эти соли растворимы в воде.