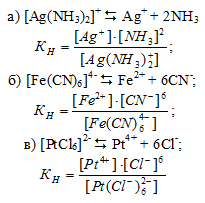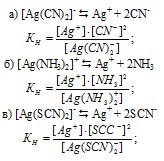Выражения для констант нестойкости комплексных ионов
Решение задач по химии на константу нестойкости комплексных соединений
Задание 312
Напишите выражения для констант нестойкости комплексных ионов [Аg(NH3)2] + , [Fe(CN)6] 4- , [РtCl6] 2- . Чему равны степень окисления и координационное число комплексообразователей в этих ионах?
Решение:
Комплексная соль в водном растворе диссоциирует по типу сильного электролита, т. е. практически полностью до комплексного иона (внутренняя сфера) и иона внешней сферы. Обратимый распад внутренней сферы комплексного соединения называют вторичной диссоциацией. В результате вторичной диссоциация и устанавливается равновесие между комплексной частицей (комплексным ионом), центральным ионом и лигандами. Константа равновесия диссоциации комплексного иона называется константой нестойкости комплексного иона . Чем меньше численное значение константы нестойкости (КН), тем более прочен данный комплексный ион.
Выражения для констант нестойкости комплексных ионов :
2. Степень окисления комплексообразователя определяется так же как и степень окисления элемента в любом химическом соединении исходя из того, что сумма степеней окисления всех атомов элементов в молекуле вещества равна нулю. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него.
Степень окисл. Координ. Число
Задание 314
Напишите выражения для констант нестойкости следующих комплексных ионов: [Аg(CN)2] — , [Аg(NH3)2] + , [Аg(SCN)2] — . Зная, что они соответственно равны 1,0 . 10 -21 ; 6,8 . 10 -8 ; 2,0 . 10 -11 , укажите, в каком растворе, содержащем эти ноны, при равной молярной концентрации ионов Аg + больше.
Решение:
Известно, что чем устойчивее комплексный ион, тем меньшее численное значение имеет константа нестойкости данного комплексного иона и наоборот – чем большее численное значение имеет константа нестойкости комплексного иона, тем мене он устойчив. Так как константа нестойкости комплексного иона [Аg(NH3)2] + (6,8 . 10 -8 ) имеет наибольшее значение, чем ионов [Аg(CN)2] – (1,0 . 10 -21 ) и [Аg(SCN)2] – (2,0 . 10 -11 ), то при равной молярной концентрации ионов Ag + больше в растворе [Аg(NH3)2] + .
Обратимый распад внутренней сферы комплексного соединения называют вторичной диссоциацией. В результате вторичной диссоциация и устанавливается равновесие между комплексной частицей (комплексным ионом), центральным ионом и лигандами. Константа равновесия диссоциации комплексного иона называется константой нестойкости комплексного иона. Чем меньше численное значение константы нестойкости (КН), тем более прочен данный комплексный ион.
Задание 320
Константы нестойкости комплексных ионов [Со(NH3)6] 3+ , [Fe(CN)6] 4– , [Fe(CN)6] 3– соответственно равны 6,2 . 10 -36 ; 1,0 . 10 -37 ; 1,0 . 10 -44 . Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ноны.
Решение:
Известно, что чем устойчивее комплексный ион, тем меньшее численное значение имеет константа нестойкости данного комплексного иона и наоборот – чем большее численное значение имеет константа нестойкости комплексного иона, тем мене он устойчив. Так как константа нестойкости комплексного иона [Fe(CN)6] 3- (1,0 . 10 -44 ) имеет наименьшее значение, чем ионов [Со(NH3)6] 3+ (6,2 . 10 -36 ) и [Fe(CN)6] 4- (1,0 . 10-37), то более прочным ионом будет [Fe(CN)6] 3-.
Обратимый распад внутренней сферы комплексного соединения называют вторичной диссоциацией. В результате вторичной диссоциации и устанавливается равновесие между комплексной частицей (комплексным ионом), центральным ионом и лигандами. Константа равновесия диссоциации комплексного иона называется константой нестойкости комплексного иона. Чем меньше численное значение константы нестойкости (КН), тем более прочен данный комплексный ион.
Выражения для констант нестойкости комплексных ионов:
Устойчивость комплексных соединений в растворе
При получении растворов комплексных соединений, происходит их диссоциация на ионы внутренней и внешней сферы. После отщепления внешней сферы (первичная диссоциация), обратимой диссоциации подвергается внутренняя сфера (вторичная диссоциация):
[MLn] ↔ M + nL
Заряды для упрощения опущены, а ионы представлены в негидрированном виде.
Диссоциация комплекса протекает ступенчато, т.е. лиганды удаляются из внутренней сферы последовательно один за другим.
Константа устойчивости и константа нестойкости комплекса
При смешивании двух растворов, содержащих ионы металла и лиганд, произойдет ступенчатое комплексообразование, т.е. последовательное присоединение лиганда к металлу:
| M + L↔[ML] | K1 = [ML]/([M]·[L]) |
| ML + L↔[ML2] | K2 = [ML2]/([ML]·[L]) |
| ……………… | ……………….. |
| MLn-1 + L↔[MLn] | Kn = [MLn]/([MLn-1]·[L]) |
Присоединение лиганда к металлу будет происходить до тех пор, пока количество лигандов не станет равным координационному числу комплексообразователя. Устанавливается динамическое равновесие, при котором происходит как образование комплекса, так и его распад.
Каждой ступени также соответствует свое состояние равновесия, которое характеризуется соответствующей константой равновесия. Константы K1, K2…Kn называют ступенчатыми константами устойчивости (образования) комплексов.
Процесс комплексообразования можно выразить и через так называемые суммарные (кумулятивные) константы устойчивости – βi(обр):
| M + L↔[ML] | β1 = K1 = [ML]/([M]·[L]) |
| M + 2L↔[ML2] | β2 = K1· K2 = [ML2]/([M]·[L] 2 ) |
| ……………… | ……………….. |
| M + nL↔[MLn] | βn = K1· K2·…· Kn = [MLn]/([M]·[L] n ) |
Константа βn – общая константа образования комплекса.
Константы устойчивости характеризуют прочность комплекса в растворе, которая увеличивается с ростом их значения.
Процесс диссоциации также можно охарактеризовать с помощью констант, называемых константами нестойкости комплексов:
| [MLn] ↔ MLn-1 + L | Kн1 = 1/Kn = ([MLn-1]·[L])/[MLn] |
| [MLn-1] ↔ MLn-2 + L | Kн2 = 1/Kn-1 = ([MLn-2 ]·[L])/[MLn-1] |
| ……………… | ……………….. |
| [ML] ↔ M + L | Kнn = 1/K1 = ([M]·[L])/[ML] |
Константы Kн1, Kн2… Kнn называют ступенчатыми константами нестойкости (неустойчивости) комплексов. Понятно, что ступенчатые константы нестойкости это обратные величины соответствующих ступенчатых констант устойчивости.
Процесс диссоциации комплекса, также как и процесс комплексообразования, можно охарактеризовать с помощью суммарных равновесий. В этом случае они называются суммарными (кумулятивными) константами нестойкости:
| [MLn] ↔ MLn-1 + L | βн1 = Kн1= ([MLn-1]·[L])/[MLn] |
| [MLn] ↔ MLn-2 + 2L | βнn2 = Kн1· Kн2 = ([MLn-2]·[L] 2 )/[MLn] |
| ……………… | ……………….. |
| [MLn] ↔ M + nL | βнn = Kн1· Kн2·…· Kнn = ([M]·[L] n )/[MLn] |
Суммарная константа βнn для комплекса MLn называется общей константой нестойкости (неустойчивости) комплекса. Общая константа нестойкости является обратной величиной общей константы устойчивости:
Как и константа устойчивости, константа нестойкости является количественным показателем устойчивости комплексного соединения в растворе. Прочность комплекса тем больше, чем меньше значение константы нестойкости.
Факторы, влияющие на устойчивость комплекса:
- Внешние факторы: температура, природа растворителя, ионная сила и состав раствора.
- Фундаментальные факторы:
- Природа комплексообразователя, например, устойчивость комплекса [Cu(NH3)2] + выше, чем устойчивость комплекса [Ag(NH3)2] + , т.е. β2([Cu(NH3)2] + ) = 7,2 ·10 10 > β2([Ag(NH3)2] + ) = 1,7· 10 7 . По результатам многих исследований составлен ряд комплексообразователей, в котором устойчивость комплексных соединений, содержащих эти металлы, растет в ряду:
Mn(II) – Fe(II) – Co(II) – Ni(II) – Cu(II).
Природа лиганда и координационное число здесь никакого влияния не оказывают. Данный ряд называют “естественный порядок устойчивости”.
- Природа лигандов, например, устойчивость комплекса [Ag(CN)2] + выше, чем устойчивость комплекса [Ag(NH3)2] + , т.е. > β2([Ag(NH3)2] + ) = 7,1·10 19 > β2([Ag(NH3)2] + ) = 1,7·10 7 .
- Cтерические факторы: хелатный эффект – за счет образования хелатных циклов, полидентантные лиганды образуют более устойчивые комплексы, нежели их монодентантные аналоги.
Стерический эффект — пространственное окружение донорных атомов лиганда, также влияет на устойчивость комплекса.
Комплексные соединения
Материалы портала onx.distant.ru
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами . Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F — — фторо, Cl — -хлоро, ОН — — гидроксо, CN — — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование комплексных солей.
Если комплексообразователем является Fe 2+ или Fe 3+ , то координационные числа в обоих случаях равны шести:
Координационные числа ртути и меди, как правило, равны четырем:
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
- образования малорастворимого соединения с комплексообразователем:
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например , в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
Для комплексного иона [Ni(NH3)6] 2+ , диссоциирующего по уравнению
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni 2+ ]·[NH3] 6 / [[Ni(NH3)6] 2+ ] (1)
Величина, обратная Кн, называется константой устойчивости:
Она представляет собой константу равновесия процесса образования комплексного иона:
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGT о = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3 — в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag + в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2] + = 5,7× 10 — 8 при 298 К.
3) Величину ΔG o 298 процесса диссоциации комплексного иона.
[NO3 — ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag + и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2] + составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
Следовательно, [Ag + ] = 1,43× 10 — 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2] + уравнением:
Значит, при Т = 298 К получаем:
ΔG о 298 = — 8,314× 298× ln5,7× 10 — 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10 — 10 , Кн.[Ag(NH3)2] + = 5,7× 10 — 8 .
Решение. Осадок выпадет при условии: [Ag + ][Сl — ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag + и Сl — в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10 -3 , 1 и 0,25 М соответственно.
Найдем концентрацию [Ag + ] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10 — 10 .
Значит, [Ag + ] = 2,85× 10 — 10 моль/л, а [Сl — ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag + ][Сl — ] = 2,85× 10 — 10 × 0,25 = 7,1× 10 — 11 (моль/л) 2 .
Поскольку [Ag + ][Сl — ] = 7,1× 10 — 11 — 10 , то осадок не выпадет.
Задача 3. При какой концентрации ионов S 2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10 — 27 , Кн[Cd(CN)4] 2- = 7,8× 10 — 18 .
Решение. Осадок выпадет при условии: [Cd 2+ ][S 2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd 2+ и S 2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S 2- ] > ПР(CdS):[Cd 2+ ].
Комплексный ион диссоциирует незначительно:
[Cd(CN)4] 2- → Cd 2+ + 4CN —
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd 2+ и 4x моль/л ионов CN — . Суммарная концентрация ионов CN — равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4] 2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4] 2- = [Cd 2+ ] · [CN — ] 4 / [[Cd(CN)4] 2- ]
Следовательно, [Cd 2+ ] = 1,8·10 — 12 моль/л.
Выпадение осадка начнется при [S 2- ] > 7,9·10 — 27 : 1,8·10 — 12 > 4,39·10 — 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия;
2. Назовите следующие комплексные соединения
[Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II).
3. Составьте уравнение химической реакции:
4. Составьте уравнение химической реакции:
5 . Составьте уравнение химической реакции:
6. Составьте уравнение химической реакции:
7. Составьте уравнение химической реакции:
http://zadachi-po-khimii.ru/obshaya-himiya/ustojchivost-kompleksnyx-soedinenij-v-rastvore.html
http://chemege.ru/complex/