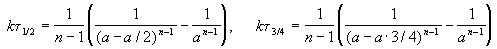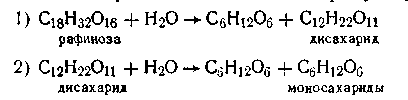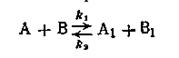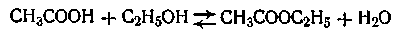Константа скорости второго порядка уравнение
Константа скорости химической реакции. Энергия активации
И.М. Эммануэль, Д.Г. Кнорре.
Источник:И.М. Эммануэль, Д.Г. Кнорре. Курс химической кинетики, изд. «Высшая школа», 1979, с.73-76.
При заданных внешних условиях (температура, давление, среда, в которой происходит процесс) скорость химического превращения является функцией только концентраций компонентов реакционной смеси. Уравнение, описывающее зависимость скорости химического процесса от концентрации компонентов реакционной смеси, называется кинетическим уравнением химического процесса.
Очень часто в химической кинетике приходится иметь дело с процессами, скорость которых оказывается пропорциональной произведению концентраций реагирующих веществ в соответствующих степенях.
Если зависимость скорости реакции от концентрации реагирующих веществ записывается в виде

то величины ni (i = I, 2, . I) принято называть порядком реакции по веществу Аi.
Сумму порядков реакции по всем реагирующим веществам называют порядком реакции. Множитель и в кинетическом уравнении (1), показывающий, с какой скоростью идет химический процесс при концентрациях реагирующих веществ, равных единице, называется константой скорости химического процесса. Наряду со скоростью константа скорости химического процесса является основной величиной в химической кинетике.
Степенная зависимость скорости реакции от концентраций реагирующих веществ (1) практически всегда выполняется для скорости отдельных стадий химического процесса. При этом как порядок по отдельному компоненту, так и суммарный порядок реакции являются целыми положительными числами. Для отдельной стадии порядок реакции никогда не превышает трех. Поэтому особо важное значение в химической кинетике имеют реакции первого, второго и третьего порядка.
Константы скорости реакций различного порядка имеют разную размерность. Поскольку размерность скорости реакции независимо от кинетического уравнении этой реакции есть [С] [t] -1 , то из (1) следует, что размерность константы скорости для реакции первого порядка [t] -1 , второго порядка [С] -1 [t] -1 , третьего порядка [С] -2 [t] -2 .
В соответствии с этим единицами измерения констант скорости являются:
- для реакции первого порядка: с -1
- для реакции второго порядка: м 3 /молекула · с (м 3 · с -1 ) или М -1 · с -1 [л/(моль · с)]
- для реакции третьего порядка: м 6 /молекула 2 · с (м 6 · с -1 ) или М -2 · с -1 [л 2 /(моль · с)]
При использовании молярных единиц для выражения концентрации при расчетах в системе единиц СИ следует помнить, что это эквивалентно использованию единиц кмоль/м 3 , и поэтому все остальные величины, относимые к определенному количеству вещества (универсальная газовая постоянная, число Авогадро), должны также браться в расчете на 1 киломоль.
Следует подчеркнуть, что константы скорости реакций разных порядков являются разными физическими величинами и сопоставление их абсолютных значений лишено какого бы то ни было смысла. При переходе от одной единицы измерения концентрации к другой константа скорости реакции первого порядка не изменяется, константа скорости реакции второго порядка изменяется в 6,02 · 1026 раз, а константа скорости реакции третьего порядка — в 3,6 · 1053 раз.
Константа скорости химической реакции, как правило, резко растет с повышением температуры. Зависимость константы скорости реакции от температуры в большом числе случаев может быть описана уравнением Аррениуса

где Т — абсолютная температура; k0 и Е — постоянные параметры.
Поскольку концентрация реагирующих веществ практически не зависит от температуры, то такое же соотношение получается и для скорости процесса

где
Относительное увеличение скорости реакции с температурой характеризуется логарифмической производной υ по Т:

Таким образом, чем больше Е, тем быстрее растет скорость реакции с температурой. Для простых реакций параметр Е показывает, какой минимальной энергией (в расчете на один моль) должны обладать реагирующие частицы, чтобы они могли вступить в химическую реакцию. Частицы, энергия которых больше или равна Е, называются активными, а параметр Е в связи с этим называют энергией активации.
Для сложных реакций, состоящих из нескольких стадий, параметр Е в уравнении (2), как правило, не имеет такого простого физического смысла и является некоторой функцией энергии активации отдельных стадий. Тем не менее и в этом случае параметр. Е принято называть энергией активации, хотя правильнее было бы называть его эффективной или эмпирической энергией активации.
Параметр k0 называется предэкспоненциальным множителем.
Параметры Е и k0 могут быть определены из зависимости константы скорости реакции от температуры с помощью уравнения (2), записанного в виде

Константа скорости второго порядка уравнение
1. Основные понятия и постулаты химической кинетики
Химическая кинетика — раздел физической химии, изучающий скорости химических реакций. Основные задачи химической кинетики: 1) расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача); 2) определение механизмов реакций по кинетическим кривым (обратная задача).
Скорость химической реакции описывает изменение концентраций реагирующих веществ в единицу времени. Для реакции
aA + bB + . 
скорость реакции определяется следующим образом:
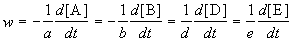
где квадратные скобки обозначают концентрацию вещества (обычно измеряется в моль/л), t — время; a, b, d, e — стехиометрические коэффициенты в уравнении реакции.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики — законом действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в некоторые степени:
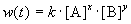
где k — константа скорости (не зависящая от концентрации); x, y — некоторые числа, которые называют порядком реакции по веществам A и B, соответственно. Эти числа в общем случае никак не связаны с коэффициентами a и b в уравнении реакции. Сумма показателей степеней x + y называется общим порядком реакции. Порядок реакции может быть положительным или отрицательным, целым или дробным.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. Элементарные реакции бывают только трех типов: мономолекулярные (A 


ПРИМЕРЫ
Пример 1-1. Скорость образования NO в реакции 2NOBr(г) 
Решение. По определению, скорость реакции равна:
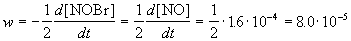
Из этого же определения следует, что скорость расходования NOBr равна скорости образования NO с обратным знаком:
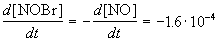
Пример 1-2. В реакции 2-го порядка A + B 
Решение. По закону действующих масс, в любой момент времени скорость реакции равна:
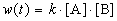
К моменту времени, когда [A] = 1.5 моль/л, прореагировало по 0.5 моль/л веществ A и B, поэтому [B] = 3 – 0.5 = 2.5 моль/л. Константа скорости равна:
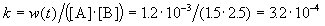
К моменту времени, когда [B] = 1.5 моль/л, прореагировало по 1.5 моль/л веществ A и B, поэтому [A] = 2 – 1.5 = 0.5 моль/л. Скорость реакции равна:
ЗАДАЧИ
1-1. Как выражается скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3 через концентрации азота и водорода? (ответ)
1-2. Как изменится скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3, если уравнение реакции записать в виде N2 + 3H2 = 2NH3? (ответ)
1-3. Чему равен порядок элементарных реакций: а) Сl + H2 = HCl + H; б) 2NO + Cl2 = 2NOCl? (ответ)
1-4. Какие из перечисленных величин могут принимать а) отрицательные; б) дробные значения: скорость реакции, порядок реакции, молекулярность реакции, константа скорости, стехиометрический коэффициент? (ответ)
1-5. Зависит ли скорость реакции от концентрации продуктов реакции? (ответ)
1-6. Во сколько раз увеличится скорость газофазной элементарной реакции A = 2D при увеличении давления в 3 раза?(ответ)
1-7. Определите порядок реакции, если константа скорости имеет размерность л 2 /(моль 2 . с). (ответ)
1-8. Константа скорости газовой реакции 2-го порядка при 25 о С равна 10 3 л/(моль . с). Чему равна эта константа, если кинетическое уравнение выражено через давление в атмосферах?(ответ)
1-9. Для газофазной реакции n-го порядка nA 
1-10. Константы скорости прямой и обратной реакции равны 2.2 и 3.8 л/(моль . с). По какому из перечисленных ниже механизмов могут протекать эти реакции: а) A + B = D; б) A + B = 2D; в) A = B + D; г) 2A = B.(ответ)
1-11. Реакция разложения 2HI 
1-12. Скорость реакции 2-го порядка A + B 
1-13. В реакции 2-го порядка A + B 
1-14. В реакции 2-го порядка A + B 
1-15. Скорость газофазной реакции описывается уравнением w = k . [A] 2 . [B]. При каком соотношении между концентрациями А и В начальная скорость реакции будет максимальна при фиксированном суммарном давлении? (ответ)
2. Кинетика простых реакций
В данном разделе мы составим на основе закона действующих масс и решим кинетические уравнения для необратимых реакций целого порядка.
Реакции 0-го порядка. Скорость этих реакций не зависит от концентрации:
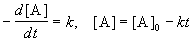
где [A] — концентрация исходного вещества. Нулевой порядок встречается в гетерогенных и фотохимических реакциях.
Реакции 1-го порядка. В реакциях типа A 
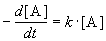
При решении кинетических уравнений часто используют следующие обозначения: начальная концентрация [A]0 = a, текущая концентрация [A] = a — x(t), где x(t) — концентрация прореагировавшего вещества A. В этих обозначениях кинетическое уравнение для реакции 1-го порядка и его решение имеют вид:
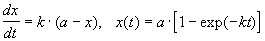
Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции:
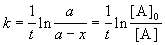
Время, за которое распадается половина вещества A, называют периодом полураспада t 1/2. Он определяется уравнением x(t 1/2) = a/2 и равен
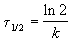
Реакции 2-го порядка. В реакциях типа A + B 
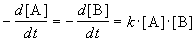
При решении этого уравнения различают два случая.
1) одинаковые начальные концентрации веществ A и B: a = b. Кинетическое уравнение имеет вид:
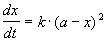
Решение этого уравнения записывают в различных формах:
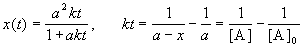
Период полураспада веществ A и B одинаков и равен:
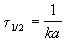
2) Начальные концентрации веществ A и B различны: a 
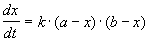
Решение этого уравнения можно записать следующим образом:
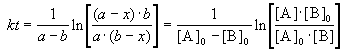
Периоды полураспада веществ A и B различны: 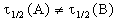
Реакции n-го порядка nA 
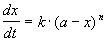
Решение кинетического уравнения:
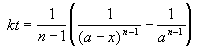
Период полураспада вещества A обратно пропорционален (n-1)-й степени начальной концентрации:
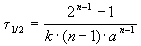
Пример 2-1. Период полураспада радиоактивного изотопа 14 C — 5730 лет. При археологических раскопках было найдено дерево, содержание 14 C в котором составляет 72% от нормального. Каков возраст дерева?
Решение. Радиоактивный распад — реакция 1-го порядка. Константа скорости равна:
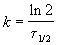
Время жизни дерева можно найти из решения кинетического уравнения с учетом того, что [A] = 0.72 . [A]0:
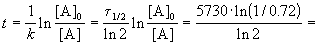
Пример 2-2. Установлено, что реакция 2-го порядка (один реагент) завершается на 75% за 92 мин при исходной концентрации реагента 0.24 М. Какое время потребуется, чтобы при тех же условиях концентрация реагента достигла 0.16 М?
Решение. Запишем два раза решение кинетического уравнения для реакции 2-го порядка с одним реагентом:
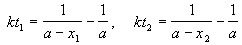
где, по условию, a = 0.24 M, t1 = 92 мин, x1 = 0.75 . 0.24 = 0.18 M, x2 = 0.24 — 0.16 = 0.08 M. Поделим одно уравнение на другое:
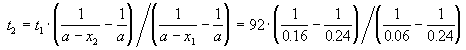
Пример 2-3. Для элементарной реакции nA 
и поделим одно выражение на другое. Постоянные величины k и a из обоих выражений сократятся, и мы получим:
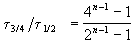
Этот результат можно обобщить, доказав, что отношение времен, за которые степень превращения составит a и b , зависит только от порядка реакции:
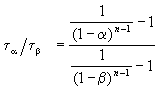
ЗАДАЧИ
2-1. Пользуясь решением кинетического уравнения, докажите, что для реакций 1-го порядка время t x, за которое степень превращения исходного вещества достигает x, не зависит от начальной концентрации. (ответ)
2-2. Реакция первого порядка протекает на 30% за 7 мин. Через какое время реакция завершится на 99%? (ответ)
2-3. Период полураспада радиоактивного изотопа 137 Cs, который попал в атмосферу в результате Чернобыльской аварии, — 29.7 лет. Через какое время количество этого изотопа составит менее 1% от исходного? (ответ)
2-4. Период полураспада радиоактивного изотопа 90 Sr, который попадает в атмосферу при ядерных испытаниях, — 28.1 лет. Предположим, что организм новорожденного ребенка поглотил 1.00 мг этого изотопа. Сколько стронция останется в организме через а) 18 лет, б) 70 лет, если считать, что он не выводится из организма?(ответ)
2-5. Константа скорости для реакции первого порядка SO2Cl2 = SO2 + Cl2 равна 2.2 . 10 -5 с -1 при 320 о С. Какой процент SO2Cl2 разложится при выдерживании его в течение 2 ч при этой температуре?(ответ)
2-6. Константа скорости реакции 1-го порядка
2N2O5(г) 
при 25 о С равна 3.38 . 10 -5 с -1 . Чему равен период полураспада N2O5? Чему будет равно давление в системе через а) 10 с, б) 10 мин, если начальное давление было равно 500 мм рт. ст. (ответ)
2-7. Реакцию первого порядка проводят с различными количествами исходного вещества. Пересекутся ли в одной точке на оси абсцисс касательные к начальным участкам кинетических кривых? Ответ поясните.(ответ)
2-8. Реакция первого порядка A 
2-9. Реакция второго порядка 2A 
2-10. Вещество A смешали с веществами B и C в равных концентрациях 1 моль/л. Через 1000 с осталось 50% вещества А. Сколько вещества А останется через 2000 с, если реакция имеет: а) нулевой, б) первый, в) второй, в) третий общий порядок?(ответ)
2-11. Какая из реакций — первого, второго или третьего порядка — закончится быстрее, если начальные концентрации веществ равны 1 моль/л и все константы скорости, выраженные через моль/л и с, равны 1? (ответ)
CH3CH2NO2 + OH — 
имеет второй порядок и константу скорости k = 39.1 л/(моль . мин) при 0 о С. Был приготовлен раствор, содержащий 0.004 М нитроэтана и 0.005 М NaOH. Через какое время прореагирует 90% нитроэтана? (ответ)
2-13. Константа скорости рекомбинации ионов H + и ФГ — (фенилглиоксинат) в молекулу НФГ при 298 К равна k = 10 11.59 л/(моль . с). Рассчитайте время, в течение которого реакция прошла на 99.999%, если исходные концентрации обоих ионов равны 0.001 моль/л. (ответ)
2-14. Скорость окисления бутанола-1 хлорноватистой кислотой не зависит от концентрации спирта и пропорциональна [HClO] 2 . За какое время реакция окисления при 298 К пройдет на 90%, если исходный раствор содержал 0.1 моль/л HClO и 1 моль/л спирта? Константа скорости реакции равна k = 24 л/(моль . мин). (ответ)
2-15. При определенной температуре 0.01 М раствор этилацетата омыляется 0.002 М раствором NaOH на 10% за 23 мин. Через сколько минут он будет омылен до такой же степени 0.005 М раствором KOH? Считайте, что данная реакция имеет второй порядок, а щелочи диссоциированы полностью.(ответ)
2-16. Реакция второго порядка A + B 
*2-17. Скорость автокаталитической реакции A 
*2-18. Автокаталитическая реакция A 
*2-19. Автокаталитическая реакция A 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Реакции второго порядка.
К реакциям второго порядка относятся реакции соединения типа A + B→C, реакции обмена A + B = C + D, а также реакции разложения и др. Скорость реакции второго порядка определяется уравнением
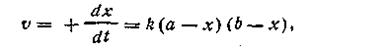 | 2.13 |
где k — константа скорости реакции; а — число молей вещества А в начале реакции; b — число молей вещества В в начале реакции; х—число прореагировавших молей.
Здесь возможны два случая. Первый случай — это когда какое-то количество вещества А вступает в реакцию с эквивалентным количеством вещества В, т. е. когда а = b. И второй случай более сложный — это когда а ≠ b. Рассмотрим оба эти случая.
Первый случай (а= b).Поскольку исходные концентрации реагирующих веществ равны между собой, уравнение (2.13) примет вид
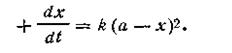 | 2.14 |
Разделяя переменные и производя интегрирование, получим
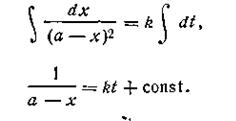 | 2.15 |
При t = 0 x = 0, откуда const =1/а. После подстановки этой величины в уравнение (2.15) получим
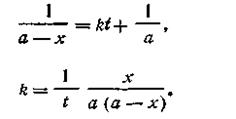 | 2.16 |
Размерность константы скорости реакции второго порядка t -1 C -1 . Поэтому в отличие от константы скорости первого порядка численное значение k зависит от того, в каких единицах выражены t и С. Если последняя выражена в кмоль/м 3 , а время в с, то k имеет размерность [с -1 ·(кмоль/м 3 ) -1 ].
Для реакций второго порядка большую роль играет число столкновений, которые происходят в единицу времени между молекулами реагирующих веществ. Число столкновений, в свою очередь, пропорционально числу молекул в единице объема, т. е. концентрации. Таким образом, константа скорости, а следовательно, и скорость реакции второго порядка зависят от разбавления раствора.
Второй случай (а ≠ b). Если для реакции взяты неэквивалентные количества реагирующих веществ, скорость реакции выразится так:
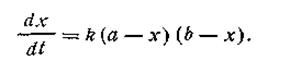 | 2.17 |
После разделения переменных получим это уравнение в другом виде:
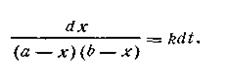 | 2.18 |
Выражение, стоящее в левой части уравнения (2.18), можно представить как
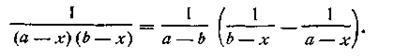 | 2.19 |
Поcле подстановки этого выражения в уравнение (2.13) получим
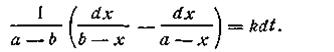 | 2.20 |
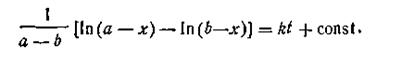 | 2.21 |
Поскольку при t = 0 х = 0, постоянная интегрирования
 | 2.22 |
Подставляя это выражение в уравнение (2.16), найдем
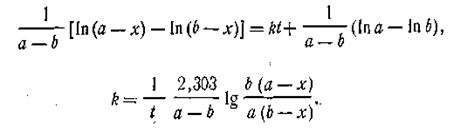 | 2.23 |
Это и есть кинетическое уравнение реакции второго порядка. Примером подобной реакции может служить омыление эфиров щелочами:
Кинетика реакций второго порядка была детально изучена С. Г. Крапивиным еще в 1915 г.
Реакции третьего порядка встречаются очень редко и потому не имеет смысла рассматривать математический вывод их кинетического уравнения.
Существуют экспериментальные способы определения порядка реакции, основные из них:
подстановки в кинетическое уравнение реакций,
определение полупериода реакций,
Сложные реакции.
Сложными называются реакции, общее кинетическое уравнение которых в отличие от кинетического уравнения простых реакций содержит несколько констант скоростей. К сложным реакциям относятся обратимые, параллельные, последовательные, сопряженные, цепные и другие реакции. Теория всех этих реакций основана на положении, что при протекании в системе одновременно нескольких реакций каждая из них проходит самостоятельно и к каждой из них в отдельности применимы уравнения кинетики простых реакций.
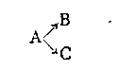
Параллельными реакциями называются реакции вида
т. е. при которых одни и те же исходные вещества, одновременно реагируя, образуют разные продукты. Примером подобного типа реакций является реакция разложения бертолетовой соли КСlO3, которая может идти в двух направлениях:
Примером последовательных реакций может служить гидролиз рафинозы трисахарида, который происходит через стадии образования дисахарида, а последний образует уже моносахариды:
Расчет кинетики последовательных реакций в общем виде очень сложен и здесь не рассматривается. Отметим только, что если одна из ступеней обладает значительно меньшей скоростью, чем остальные, то общая скорость реакции определяется скоростью именно этой ступени.
Сопряженными реакциями называются реакции, которые протекают по следующей схеме:
Реакция 1 может протекать самостоятельно, в то время как реакция 2 проходит при наличии реакции 1. Так, сульфат железа окисляется пероксидом водорода независимо от присутствия йодистого водорода. Последний же в чистом виде пероксидом водорода не окисляется, но при окислении сульфата железа окисляется одновременно с ним.
Обратимыми называются такие реакции, скорость которых равна разности между скоростями прямой и обратной реакции:
Примером обратимой реакции, может служить реакция образования сложного эфира
В этом случае скорость прямой реакции с течением времени убывает, а скорость обратной реакции возрастает до тех пор, пока обе скорости не выравняются и не наступит так называемое состояние динамического равновесия. Константа равновесия данной реакции равна отношению констант скоростей прямой и обратной реакции.
Наряду с рассмотренными выше реакциями, механизм которых сравнительно прост, существуют также реакции, в которых взаимодействие осуществляется более сложным путем. Примером подобных реакций являются цепные реакции, которые имеют исключительно большое значение в химической технологии, так как на них основаны такие процессы, как полимеризация, крекинг нефти, деление атомного ядра.
К цепным реакциям относится большая группа реакций, протекающих путем образования цепи следующих друг за другом реакций, в которых участвуют активные частицы с ненасыщенными свободными валентностями — так называемые свободные радикалы. Свободные радикалы образуются за счет дополнительного поглощения энергии при разрыве связей в молекуле, при электрическом разряде, при поглощении электромагнитных колебаний, а также за счет других внешних источников энергии.
Сущность цепного механизма реакции заключается в том, что активная молекула, реагируя, порождает новую активную молекулу или реакционноспособную частицу (валентно-ненасыщенные свободные атомы или радикалы). Процесс исчезновения и регенерации каждой активной частицы в дальнейшем циклически повторяется много раз и создает цепь превращений, совершающихся частью последовательно, а частью параллельно.
Впервые определение цепного механизма реакций через образование активных центров было дано Н. А. Шиловым (1904). Чрезвычайно большой вклад в дело изучения цепных реакций внес Н. Н. Семенов, которому за эти исследования была присуждена Нобелевская премия.
В настоящее время цепные реакции изучены настолько хорошо, что стало осуществимо регулирование скорости этих реакций. Добавляя вещество, легко вступающее во взаимодействие с активными центрами, можно значительно увеличить число обрывов цепей и тем самым затормозить (или же прекратить вовсе) цепную реакцию.
Например, добавление всего лишь 0,01% NС1з (треххлористого азота) к смеси водорода и хлора (Н2 и С2), которые реагируют по типу цепных нарастающих реакций, уменьшает скорость образования хлористого водорода в десятки тысяч раз.
Некоторые добавки увеличивают скорость цепных реакций. Так, добавление сравнительно малых количеств N0 в значительной степени ускоряет цепные реакции окисления углеводородов. При этом удается значительно понизить температуру процесса окисления, что очень важно, так как сохраняются от сгорания ценные промежуточные продукты — уксусный и муравьиный альдегиды.
На цепных химических реакциях основаны многие технологические процессы — синтез спиртов, кетонов, формалина, уксусной кислоты.
В последнее время исследования показали, что некоторые биологические процессы также протекают по типу цепных реакций, в частности процессы биологического окисления.
http://www.chem.msu.su/rus/teaching/eremin/1-2.html
http://helpiks.org/7-15341.html