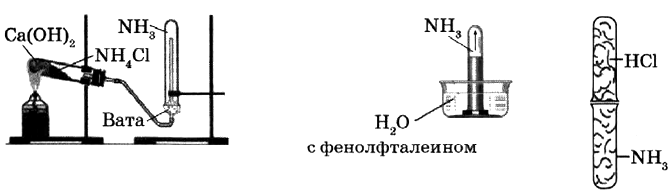Контрольная работа по химии «Уравнения химических реакций»
Представлен текст контрольной работы по химим для 8 класса (4 вариант)
Просмотр содержимого документа
«Контрольная работа по химии «Уравнения химических реакций»»
Контрольная работа №3
1. (1 балл) Сумма всех коэффициентов в уравнении реакции, схема которой
Al + Cl2 → AlCl3 равна:
2. (2 балла) Соотнесите уравнения реакций с их типом:
3. (2 балла) Расставьте коэффициенты в схемах:
4. Составьте уравнения реакций, расставьте коэффициенты, назовите продукты реакций:
2) цинк + соляная кислота → (2 балла)
3) гидроксид натрия + сульфат алюминия → (2 балла)
5. (3 балла) Рассчитайте объем водорода, который образуется при взаимодействии 20 г магния с соляной кислотой.
6. (4 балла) К раствору серной кислоты прибавили 62,4 г раствора хлорида бария. Определите массу соли, которая образовалась в ходе реакции.
Итого за работу 17 баллов.
8 – 11 баллов – оценка «3»
12 – 15 баллов – оценка «4»
16 – 17 баллов – оценка «5»
1. (1 балл) Сумма всех коэффициентов в уравнении реакции, схема которой
Ca + HCl → CaCl2 + H2 равна:
2. (2 балла) Соотнесите уравнения реакций с их типом:
3. (2 балла) Расставьте коэффициенты в схемах:
6. Составьте уравнения реакций, расставьте коэффициенты, назовите продукты реакций:
2) цинк + хлорид железа (III) → (2 балла)
3) оксид алюминия + серная кислота → (2 балла)
5. (3 балла) Рассчитайте объем кислорода, собранный при разложении 108,5 г оксида ртути (II)
6. (4 балла) К раствору силиката натрия прибавили раствор соляной кислоты. Масса полученной соли составила 11,7 г. Вычислите массу силиката натрия, взятого для реакции.
Итого за работу 17 баллов.
8 – 11 баллов – оценка «3»
12 – 15 баллов – оценка «4»
16 – 17 баллов – оценка «5»
1. (1 балл) Физическое явление – это:
А. горение угля В. горение керосина
Б. испарение воды Г. скисание молока
2. (1 балл) Сумма всех коэффициентов в уравнении реакции, схема которой Al + O2 → Al2O3 равна:
3. (1 балл) Реакции, протекающие с поглощением теплоты, называются:
А. атермические В. экзотермические
Б. эндотермические Г. тепловые
4. (2 балла) Соотнесите уравнения реакций с их типом:
5. (2 балла) Расставьте коэффициенты в схемах:
6. Составьте уравнения реакций, расставьте коэффициенты, назовите продукты реакций:
2) магний + хлорид алюминия → (2 балла)
3) гидроксид натрия + фосфорная кислота → (2 балла)
7. (3 балла) Решите задачу. Вычислите массу водорода, образующегося при взаимодействии
50 г цинка с серной кислотой.
8. (4 балла) Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
9. (4 балла) К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите массовую долю соли в исходном растворе.
Итого за работу 23 балла.
12-15 баллов – оценка «3»
16—19 баллов – оценка «4»
20-23 баллов – оценка «5»
1. (1 балл) Химическое явление – это:
А. плавление олова В. замерзание воды
Б. горение магния Г. испарение воды
2. (1 балл) Сумма всех коэффициентов в уравнении реакции, схема которой N2 + H2 → NH3 равна:
3. (1 балл) Реакции, протекающие с выделением теплоты, называются:
А. атермические В. экзотермические
Б. эндотермические Г. тепловые
4. (2 балла) Соотнесите уравнения реакций с их типом:
5. (2 балла) Расставьте коэффициенты в схемах:
6. Составьте уравнения реакций, расставьте коэффициенты, назовите продукты реакций:
2) магний + соляная кислота → (2 балла)
3) нитрат бария + сульфат натрия → (2 балла)
7. (3 балла) Решите задачу. Вычислите массу осадка, образующегося при взаимодействии 50 г гидроксида калия с хлоридом алюминия.
8. (4 балла) Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
9. (4 балла) К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите массовую долю соли в исходном растворе.
Контрольная работа 8 класс Химические уравнения. Расчеты по химическим уравнениям
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Контрольная работа для 8 класса по теме
«Химические уравнения. Расчеты по химическим уравнениям»
Расставьте коэффициенты в уравнениях реакций. Укажите тип реакции:
2. Составьте уравнения реакций, расставьте коэффициенты:
а) Хлорид алюминия + гидроксид калия=
б) нитрат серебра + хлорид кальция=
3. C колько граммов оксида алюминия образуется при взаимодействии 54г алюминия с кислородом?
4. Напишите уравнение реакции по схеме:
Кислота + оксид меди = соль + вода
1. Расставьте коэффициенты в уравнениях реакций. Укажите тип реакции:
2. Составьте уравнения реакций, расставьте коэффициенты:
а) сульфат калия + гидроксид бария=
б) нитрат серебра + хлорид магния=
3. C колько граммов фосфора необходимо для получения 71 г оксида фосфора (5)?
4. Напишите уравнение реакции по схеме:
Кислота + основание = соль + вода
1. Расставьте коэффициенты в уравнениях реакций. Укажите тип реакции:
2. составьте уравнения реакций, расставьте коэффициенты:
а) оксид серы (4)+вода = сернистая кислота
б) серная кислота+цинк = сульфат цинка+водород
в) гидроксид железа(2)= оксид железа(2)+вода
3. C колько граммов цинка необходимо для получения 56г оксида цинка?
Краткое описание документа:
Контрольная работа для 8 класса по теме
«Химические уравнения. Расчеты по химическим уравнениям»
- Расставьте коэффициенты в уравнениях реакций. Укажите тип реакции:
2. Составьте уравнения реакций, расставьте коэффициенты:
а) Хлорид алюминия + гидроксид калия=
б) нитрат серебра + хлорид кальция=
в) Fe +……= FeCl 2+ Cu
3. C колько граммов оксида алюминия образуется при взаимодействии 54г алюминия с кислородом?
4. Напишите уравнение реакции по схеме:
Кислота + оксид меди = соль + вода
1. Расставьте коэффициенты в уравнениях реакций. Укажите тип реакции:
2. Составьте уравнения реакций, расставьте коэффициенты:
а) сульфат калия + гидроксид бария=
б) нитрат серебра + хлорид магния=
3. C колько граммов фосфора необходимо для получения 71 г оксида фосфора (5)?
4. Напишите уравнение реакции по схеме:
Кислота + основание = соль + вода
1. Расставьте коэффициенты в уравнениях реакций. Укажите тип реакции:
2. составьте уравнения реакций, расставьте коэффициенты:
а) оксид серы (4)+вода = сернистая кислота
б) серная кислота+цинк = сульфат цинка+водород
в) гидроксид железа(2)= оксид железа(2)+вода
3. C колько граммов цинка необходимо для получения 56г оксида цинка?
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 929 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 22 человека из 13 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 38 человек из 23 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 585 341 материал в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
«Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников»
Свидетельство и скидка на обучение каждому участнику
Другие материалы
- 30.09.2020
- 972
- 56
- 30.09.2020
- 805
- 16
- 30.09.2020
- 666
- 3
- 30.09.2020
- 590
- 0
- 30.09.2020
- 517
- 0
- 30.09.2020
- 818
- 3
- 30.09.2020
- 1133
- 24
- 30.09.2020
- 707
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 09.01.2015 18743
- DOCX 26.5 кбайт
- 199 скачиваний
- Рейтинг: 5 из 5
- Оцените материал:
Настоящий материал опубликован пользователем КАЛИНИНА ОЛЬГА АНАТОЛЬЕВНА. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 7 лет и 1 месяц
- Подписчики: 10
- Всего просмотров: 241115
- Всего материалов: 57
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В России действуют более 3,5 тысячи студенческих отрядов
Время чтения: 2 минуты
В Забайкалье в 2022 году обеспечат интернетом 83 школы
Время чтения: 1 минута
Минпросвещения подключит студотряды к обновлению школьной инфраструктуры
Время чтения: 1 минута
Школьник из Сочи выиграл международный турнир по шахматам в Сербии
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
В Ростовской и Воронежской областях организуют обучение эвакуированных из Донбасса детей
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Получите новую специальность со скидкой 10%
Цена от 4900 740 руб. Промокод (до 23 февраля): Промокод скопирован в буфер обмена ПП2302 Выбрать курс Все курсы профессиональной переподготовки
Контрольная работа 5 составьте уравнения реакций
Контрольная работа № 5 по химии в 9 классе «Азот и фосфор» с ответами для УМК Рудзитис, Фельдман. Автор работы: Т.А.Боровских. Цитаты из пособия использованы в учебных целях. Химия 9 Рудзитис Контрольная работа 5.
Контрольная работа № 5
«Азот и фосфор» (9 класс)
КР-5. Вариант 1
- 1) Составьте электронную формулу и схему распределения электронов по орбиталям атома азота
2) Какие степени окисления азот проявляет в соединениях?
3) Почему валентность азота не может быть равна номеру группы? Ответ обоснуйте.
4) Расположите символы химических элементов (Bi, N, Sb, As, Р) в порядке:
а) возрастания атомного радиуса
б) возрастания электроотрицательности. - 1) Из данного перечня веществ выберите те, которые реагируют с азотом, запишите уравнения реакций: кремний, калий, вода, водород, кислород.
2) Из данного перечня веществ выберите те, которые реагируют с аммиаком, запишите уравнения реакций: гидроксид меди(II), соляная кислота, вода, гидроксид кальция, кислород (в отсутствии катализатора), аргон.
3) Из данного перечня веществ выберите те, которые реагируют с карбонатом аммония, запишите уравнения реакций: азотная кислота, гидроксид натрия, хлорид магния, Нитрат калия, карбонат кальция. - 1) Как экспериментально проверить, содержит ли азот примесь аммиака? Опишите эксперимент и предполагаемые наблюдения.
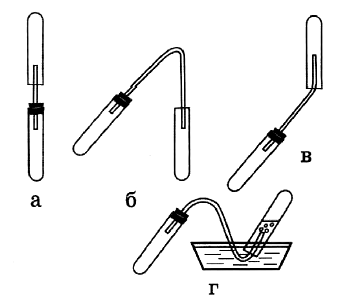
2) В трёх цилиндрах находятся кислород, водород и азот. Как различить эти газы? Опишите эксперимент и предполагаемые наблюдения. - Рассмотрите рисунки. Составьте инструкцию к проведению опытов. Сформулируйте цель опытов. Какие физические и химические свойства аммиака здесь можно изучить?
- Запишите уравнения реакций по следующим данным:
1) В лаборатории азот можно получить смешиванием горячих растворов нитрита натрия и хлорида аммония.
2) Гидрокарбонат аммония применяется при выпечке некоторых хлебных изделий, так как при нагревании он разлагается с образованием газообразных веществ, вспучивающих тесто и делающих его рыхлым.
3) При получении сульфата аммония гипсовым способом гипс взмучивают в воде и через смесь пропускают аммиак с углекислым газом, при этом выпадает осадок. - Какими из приборов, изображённых на рисунке, нельзя воспользоваться, чтобы собрать оксид азота(IV)? Почему?
- Составьте уравнения реакций:
1) Смесь газов, полученную при прокаливании нитрата меди(II), поглотили водой, при этом образовалась кислота. Нитрид кальция обработали водой, при этом выделился аммиак, который пропустили через раствор полученной кислоты.
2) Фосфор → Оксид фосфора(V) → Ортофосфорная кислота → Фосфат калия → Фосфат кальция - Закончите уравнение окислительно-восстановительных реакций, расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
1) Hg + HNO3 → NO + _____ + _____
2) АlР + HNO3 → NO2 + Al(NO3)3 + H3PO4 + H2O - Закончите уравнения реакций:
1) Р + O2 → _______
2) Р2О5 + H2О(холод.) → _______
3) Р2O5 + NaOH → _______
4) Н3РO4 + 2NaOH → _______
5) Са3(РO4)2 + С + SiO2 → _______
6) Na3PO4 + AgNO3 → _______ - 1) Вычислите массу нитрида кальция, который можно получить при взаимодействии 4 г кальция с азотом. Чему при н. у. равен объём израсходованного азота?
2) Вычислите массу концентрированного раствора азотной кислоты с массовой долей вещества 85%, требуемого для растворения меди массой 19,2 г.
3) Навеску фосфора массой 4,65 г сожгли в избытке кислорода. Продукт реакции растворили в горячей воде массой 87,35 г. Вычислите массовую долю кислоты в образовавшемся растворе.
4) Смешали раствор, содержащий 0,3 моль ортофосфорной кислоты, и раствор, содержащий 0,6 моль гидроксида калия. Какая соль при этом образуется? Какова её масса?
Ответы на задания Варианта 1:
№ 1. 1) 2; 5; 2) все от –3 до +5; 3) сравните особенности строения внешнего уровня атома азота; 4) a) N, Р, As, Sb, Bi, б) Bi, Sb, As, P, N.
№ 2. 1) 245; 2) 125; 3) 123.
№ 3. 1) Вспомните, что аммиак — основание, как отличить основание; 2) горящая лучина.
№ 4. Плотность, растворимость в воде, основные свойства.
№ 5. 1) NaNO2 + NH4Cl = N2 + NaCl + 2H2O; 2) NH4HCO3 = NH3 + CO2 + H2O; 3) CaSO4 + 2NH3 + CO2 + H2O = (NH4)2SO4 + CaCO3.
№ 6. а), в), r).
№ 7. 1) 2Cu(NO3)2 = 2CuO + 4NO2 + O2; 2H2O + 4NO2 + O2 = 4HNO3; Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3; NH3 + HNO3 = NH4NO3;
2) +O2; +H2O; +KOH; CaCl2.
№ 8. 1) 3Hg + 8HNO3 → 2NO + 3Hg(NO3)2 + 4H2O (Hg — восстановитель);
2) HNO3 окислитель, коэффициент перед окислителем 11.
№ 9. 2) Р2O5 + H2O(холод) → 2НРO3; 4) Н3РO4 + 2NaOH → Na2HPO4 + 2H2O.
№ 10. 1) 4,93 г; 2) 88,95 г; 3) 15%; 4) К2НРO4, 52,2 г.
http://infourok.ru/kontrolnaya-rabota-klass-himicheskie-uravneniya-rascheti-po-himicheskim-uravneniyam-334033.html
http://uchitel.pro/%D1%85%D0%B8%D0%BC%D0%B8%D1%8F-9-%D1%80%D1%83%D0%B4%D0%B7%D0%B8%D1%82%D0%B8%D1%81-%D0%BA%D0%BE%D0%BD%D1%82%D1%80%D0%BE%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F-%D1%80%D0%B0%D0%B1%D0%BE%D1%82%D0%B0-5/