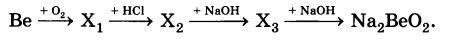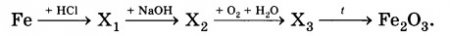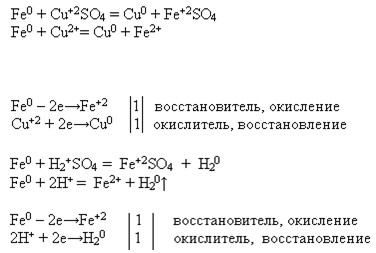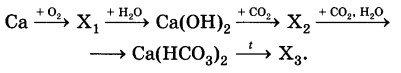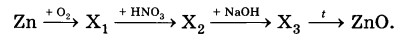Контрольная работа по химии «Уравнения химических реакций»
Представлен текст контрольной работы по химим для 8 класса (4 вариант)
Просмотр содержимого документа
«Контрольная работа по химии «Уравнения химических реакций»»
Контрольная работа №3
1. (1 балл) Сумма всех коэффициентов в уравнении реакции, схема которой
Al + Cl2 → AlCl3 равна:
2. (2 балла) Соотнесите уравнения реакций с их типом:
3. (2 балла) Расставьте коэффициенты в схемах:
4. Составьте уравнения реакций, расставьте коэффициенты, назовите продукты реакций:
2) цинк + соляная кислота → (2 балла)
3) гидроксид натрия + сульфат алюминия → (2 балла)
5. (3 балла) Рассчитайте объем водорода, который образуется при взаимодействии 20 г магния с соляной кислотой.
6. (4 балла) К раствору серной кислоты прибавили 62,4 г раствора хлорида бария. Определите массу соли, которая образовалась в ходе реакции.
Итого за работу 17 баллов.
8 – 11 баллов – оценка «3»
12 – 15 баллов – оценка «4»
16 – 17 баллов – оценка «5»
1. (1 балл) Сумма всех коэффициентов в уравнении реакции, схема которой
Ca + HCl → CaCl2 + H2 равна:
2. (2 балла) Соотнесите уравнения реакций с их типом:
3. (2 балла) Расставьте коэффициенты в схемах:
6. Составьте уравнения реакций, расставьте коэффициенты, назовите продукты реакций:
2) цинк + хлорид железа (III) → (2 балла)
3) оксид алюминия + серная кислота → (2 балла)
5. (3 балла) Рассчитайте объем кислорода, собранный при разложении 108,5 г оксида ртути (II)
6. (4 балла) К раствору силиката натрия прибавили раствор соляной кислоты. Масса полученной соли составила 11,7 г. Вычислите массу силиката натрия, взятого для реакции.
Итого за работу 17 баллов.
8 – 11 баллов – оценка «3»
12 – 15 баллов – оценка «4»
16 – 17 баллов – оценка «5»
1. (1 балл) Физическое явление – это:
А. горение угля В. горение керосина
Б. испарение воды Г. скисание молока
2. (1 балл) Сумма всех коэффициентов в уравнении реакции, схема которой Al + O2 → Al2O3 равна:
3. (1 балл) Реакции, протекающие с поглощением теплоты, называются:
А. атермические В. экзотермические
Б. эндотермические Г. тепловые
4. (2 балла) Соотнесите уравнения реакций с их типом:
5. (2 балла) Расставьте коэффициенты в схемах:
6. Составьте уравнения реакций, расставьте коэффициенты, назовите продукты реакций:
2) магний + хлорид алюминия → (2 балла)
3) гидроксид натрия + фосфорная кислота → (2 балла)
7. (3 балла) Решите задачу. Вычислите массу водорода, образующегося при взаимодействии
50 г цинка с серной кислотой.
8. (4 балла) Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
9. (4 балла) К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите массовую долю соли в исходном растворе.
Итого за работу 23 балла.
12-15 баллов – оценка «3»
16—19 баллов – оценка «4»
20-23 баллов – оценка «5»
1. (1 балл) Химическое явление – это:
А. плавление олова В. замерзание воды
Б. горение магния Г. испарение воды
2. (1 балл) Сумма всех коэффициентов в уравнении реакции, схема которой N2 + H2 → NH3 равна:
3. (1 балл) Реакции, протекающие с выделением теплоты, называются:
А. атермические В. экзотермические
Б. эндотермические Г. тепловые
4. (2 балла) Соотнесите уравнения реакций с их типом:
5. (2 балла) Расставьте коэффициенты в схемах:
6. Составьте уравнения реакций, расставьте коэффициенты, назовите продукты реакций:
2) магний + соляная кислота → (2 балла)
3) нитрат бария + сульфат натрия → (2 балла)
7. (3 балла) Решите задачу. Вычислите массу осадка, образующегося при взаимодействии 50 г гидроксида калия с хлоридом алюминия.
8. (4 балла) Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
9. (4 балла) К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите массовую долю соли в исходном растворе.
Ответы на контрольную работу по теме «Металлы»(Габриелян)
ЗАДАНИЕ 1
Напишите уравнения возможных реакций взаимодействия натрия и цинка с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Nа + 2Н2О = 2NаОН + Н2
2Nа + 2НСl = 2NаСl + Н2
2Nа + Cl2 = 2NаСl
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + H2O = ZnO + H2.
Zn + 2HCl = ZnCl2 + H2
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Fe →FeCl2 →Fe(N03)2 →Fe(OH)2 →FeO.
Превращение 3 рассмотрите в свете ТЭД.
Fe + 2HCl = FeCl2 + H2
FeCl2 + 2AgNO3 = 2AgCl + Fe(NO3)2
Fe(NO3)2 + 2NaOH = Fe(OH)2 + 2NaNO3
Fе2++ 2NO3-+ 2Na++2OH- =2Na++2NO3-+ Fе(ОН)2
Fе2++ 2OH- = Fе(ОН)2
Fе(ОН)2= FеО+ Н2О
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + H2
n (Mg) = 12/24 = 0,5 моль
V (H2) = 10/22,4 = 0,446 моль
n (Mg) = n (H2) по уравнению (теор.)
выход = 0,446 /0,5 = 0,89 = 89 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития и меди с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Li + Cl2 = 2LiCl
2Li + 2H2O = 2LiOH + H2
2Li + 2HCl = 2LiCl + H2
Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
2Li+CL2= 2LiCL
Li- e—> Li+ восстановитель
CL2+2e—-> 2CL- окислитель
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Са →CaO →Са(ОН)2 →Ca(N03)2 → Са3(Р04)2.
Превращение 3 рассмотрите в свете ТЭД.
2Ca+O2=2CaO
CaO+2NaOH=Ca(OH)2+Na2O
2HNO3 + Ca(OH)2 =Ca(NO3)2 + 2H2O
2H+ +2NO3- + Ca(OH)2 =Ca2+ +2NO3- + 2H2O
2H+ + Ca(OH)2 =Ca2+ +2H2O
3Ca(NO3)2 + 2Н3PO4 = Ca3(PO4)2 + 6HNO3
ЗАДАНИЕ 3
При термическом разложении 10 г известняка было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 = CaO+CO2
n (CaCO3) = 10/100 = 0,1 моль
V (CO2) = 1,68/22,4 = 0,075 моль
n (CaCO3) = n (CO2) по уравнению (теор.)
выход = 0,075/0,1 = 0,75 = 75 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция и железа с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
Са + Cl2 = CaCl2
Ca + 2HCl = CaCl2 + H2
Ca + 2H2O = Ca(OH)2 + H2
2Fe + 3Cl2 = 2FeCl3
Fe + 2HCl = FeCl2 + H2
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Аl →Аl203 →АlСl3 →Аl(ОН)3 →Al(N03)3.
Превращение 3 рассмотрите в свете ТЭД.
4Al + 3O2 = 2 Al2O3
Al2O3 + 6HCl = 2AlCl3 + 3H2O
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
Al3+ +3Cl- + 3NH3 + 3H2O = Al(OH)3 + 3NH4+ +Cl-
Al3+ + 3NH3 + 3H2O = Al(OH)3 + 3NH4+
Аl(ОН)3+3НNО3=Аl(NО3)3+3Н2О.
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
2Na + 2H2O = 2NaOH + H2 ↑
n (Na) = 23/23= 1 моль
V (H2) = 8,96/22,4 = 0,4 моль
n (Na) : n (H2) = 2:1
n (H2) = 1/ 2 = 0,5 моль по уравнению (теор.)
выход = 0,4/0,5 = 0,8 = 80 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций металлов калия и магния с хлором, водой, соляной кислотой.
Рассмотрите одну из этих реакций в свете ОВР.
2K + 2H2O = 2KOH + H2.
2К + CI2 = 2КCI
2К + 2HCI = 2КCI + H2
Mg + 2HCl = MgCl2 + H2
Mg + Cl2 = MgCl2
Mg 0 -2e→ Mg 2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Mg+2H2O=Mg(OH)2+H2
ЗАДАНИЕ 2
Напишите уравнения реакций для данных переходов:
Li →Li20 →LiOH →Li2S04.
Превращение 3 рассмотрите в свете ТЭД.
4Li + O2 = 2Li2O
Li2O + H2O = 2LiOH
2LiOH + Н2SO4 = Li2SO4 + 2Н2О
2Li+ +2OH- + 2Н+ +SO42- = 2Li+ +SO42- + 2Н2О
2OH- + 2Н+ — = 2Н2О
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
Са + 2Н2О = Са(ОН)2 + Н2
n (Са) = 60/40= 1,5 моль
V (H2) = 30/22,4 = 1,34 моль
n (Са) = n (H2) = по уравнению (теор.)
выход = 1,34/1,5 = 0,89 = 89 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций магния и алюминия с веществами: кислородом, бромом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Br 2 = Мg Br2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
4Al + 3O2 = 2Al2O3,
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
2Al + 3Br2 = 2AlBr3
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Са →Х1 →Са(ОН)2 →Х2 →Са(НС03)2.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции (в %).
Mg + 2НСl = MgCl2 + Н2
n (Mg) = 12/24= 0,5 моль
n (H2) = n (Mg) по уравнению (теор.)
n (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,5 = 0,89 = 89%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций меди и магния с веществами: кислородом, иодом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2Cu + O2 = 2CuO
2Cu + I2 = 2CuI
Cu + H2SO4 = не идет
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
Мg + I 2 = Мg I 2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
I 20+2e→2 I — восстанавливается, окислитель
ЗАДАНИЕ 2
Определите формулы веществ X1 и Х2 в цепочке превращений:
Zn →Х1→ ZnS04 →Х2 →ZnO.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Zn + O2 = 2ZnO
ZnO+H2SO4 —>ZnSO4 + H2O
ZnSO4 + 2NaOH (разб.) = Zn(OH)2↓ + Na2SO4
Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3
При термическом разложении 10 г карбоната кальция было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 → CaO + CO2
n (CaCO3) = 10/100= 0,1 моль
n (CO2) = n (CaCO3) по уравнению (теор.)
n (CO2) = 1,68/22,4 = 0,075 моль (пр.)
ŋ = V (CO2) (пр.)/ V (CO2) (теор.) = n (CO2) (пр.)/ n (CO2) (теор.) = 0,075/0,1 = 0,75 = 75%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций железа и цинка с веществами: кислородом, хлором, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
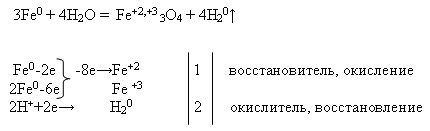
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Cl2 = 2FeCl3
2Zn + O2 = 2ZnO
Zn 0 -2e→ Zn 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + H2SO4 = ZnSO4 + H2
Zn + 2Н+ = Zn 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe →Х1 →Fe(OH)2 →Х2 →Fe.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe — 1 —> FeCl2 — 2 —> Fe (OH)2 — 3 —> FeO -4-> Fe
1. Fe + 2HCl —> FeCl2 + H2
2. FeCl2 + 2NaOH —> Fe(OH)2 + 2NaCl
Fe2+ + 2OH- —> Fe (OH)2
3. Fe (OH)2 — t —> FeO + H2O
4. FeO + C = Fe + CO
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
2Na + 2H2O = 2NaOH + H2 ↑
n (Na) = 23/23= 1 моль
2n (H2) = n (Na) по уравнению (теор.)
n (H2) = 0,5 моль теор.
n (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
ЗАДАНИЕ 1
Напишите уравнения возможных химических реакций бериллия и железа с веществами: кислородом, бромом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Br 2 = 2Fe Br3
2 Ве + O2 = 2 ВеО
Ве0 -2e→ Ве 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Ве + Br 2 = Ве Br2
Ве 0 -2e→ Ве 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Ве + Н2SO4 = Ве SО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe → Х1 →Fe(OH)3 →Х2 →Fe.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe 1→FeCl3 2→Fe(OH)3 3→Fe2O3 4→ Fe
1. 2Fe + 3Cl2 t →2FeCl3
2. FeCl3+ 3NaOH → Fe(OH)3 ↓ + 3NaCl
3. 2Fe(OH)3 t → Fe2O3 + H2O
4. 2Fe2O3 + 3C t → 4 Fe + 3CO2
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
Ca + 2H2О = Ca(OH)2 + Н2
n (Ca) = 60/40= 1,5 моль
n (H2) = n (Ca) по уравнению (теор.)
n (H2) = 30/22,4 = 1,34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,5 = 0,89 = 89%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций магния, алюминия и серебра с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Mg + 2HCl = MgCl2 + H2
Mg + 2H+ = Mg2+ + H2
Mg0 — 2e = Mg2+ восстановитель
2H+ + 2e= H2 окислитель
Mg + Cl2 = MgCl2
Mg+2H2O=Mg(OH)2+H2
Mg + CuCl2 = MgCl2 + Cu
Mg0 + Cu2+ = Mg2+ + Cu0
Mg0 — 2e = Mg2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= H2 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6H2O = 2Al(OH)3 + 3H2
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ag + 2HCl = не реагирует
2Ag + S = Ag2S
Ag+ H2O = не реагирует
Ag + FeCl3 = AgCl + FeCl2
Ag0 + Fe3+= Ag++ Fe2+
Ag0 — 1е= Ag+ восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ве + О2 = 2ВеО
ВеО +2HCl = BeCl2 + H2O
BeCl2 + 2NaOH = Be(OH)2 + 2NaCl
Be(OH)2 + 2NaOH= Na2BeO2 + 2H2O
ЗАДАНИЕ 3
При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + H2
n(Mg) = 12-12*0,05/24 = 11,4 /24= 0,475 моль
n (H2) (теор.) = n(Mg) =0,475 моль
n (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,475 = 0,92 = 92%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития, меди, бария, алюминия с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2Li + Сl2 = 2LiСl
2Li + 2H2O = 2LiOH + H2
2Li + 2НСl = 2LiСl + Н2
2Li0 + 2Н+ = 2Li+ + Н02
Li0 – 1e = Li+ восстановитель
2Н+ + 2e= Н02 окислитель
2Li + CuСl 2= 2LiС1 + Cu
2Li0 + Cu2+ = 2Li+ + Cu0
Li0 – 1e = Li+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= H2 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6H2O = 2Al(OH)3 + 3H2
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ва + 2HCl = ВаCl2 + H2
Ва + 2H+ = Ва 2+ + H2
Ва 0 — 2e = Ва 2+ восстановитель
2H+ + 2e= H2 окислитель
Ва + Cl2 = ВаCl2
Ва +2H2O= Ва(OH)2+H2
Ва + CuCl2 = ВаCl2 + Cu
Ва + Cu2+ = Ва 2+ + Cu0
Ва 0 — 2e = Ва 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
4. Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe + 2HСl → FeCl2 + H2↑
FeCl2+ 2NaOH → Fe(OH)2 + 2NaCl
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓
2Fe(OH)3 = Fe2O3 + 3H2O
ЗАДАНИЕ 3
При термическом разложении 20 г известняка, содержащего 10% некарбонатных примесей, было получено 3,23 л углекислого газа (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
CaCO3 = CaO+CO2
n (CaCO3) = 20-20*0,1/100= 18/100=0,18 моль
V (CO2) = 3,23/22,4 = 0,145 моль (практ.)
n (CaCO3) = n (CO2) по уравнению (теор.)= 0,18 моль
выход = 0,145/0,18 = 0,801 = 80,1 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция, железа и цинка с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Са + 2HCl = СаCl2 + H2
Са0 + 2H+ = Са 2+ + H2
Са 0 — 2e = Са 2+ восстановитель
2H+ + 2e= H2 окислитель
Са + Cl2 = СаCl2
Са +2H2O= Са(OH)2+H2
Са + CuCl2 = СаCl2 + Cu
Са + Cu2+ = Са 2+ + Cu0
Са 0 — 2e = Са 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2.
2Fe + 3Cl2 t →2FeCl3
3. 2Zn + O2 = 2ZnO
Zn + H2O = ZnO + H2
Zn + H2SO4 = ZnSO4 + H2
Zn + 2Н+ = Zn 2+ + Н2
Zn 0 + 2H+ = Zn 2+ + H02
Zn 0 — 2e = Zn 2+ восстановитель
2H+ + 2e= H2 окислитель
Zn + CuSO4 = Cu + ZnSO4
Zn 0 + Cu2+ = Zn 2+ + Cu0
Zn 0 — 2e = Zn 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ca+O2=2CaO
CaО+H2O=Ca(OH)2
Ca(OH)2+H2CO3=CaCO3+2H2O
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
Ca(HCO3)2 t →CaCO3↓ + CO2 + H2O
ЗАДАНИЕ 3
Прй взаимодействии 24,15 г технического натрия, содержащего 5% примесей, было получено 8,96 л водорода (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
2Na + 2H2O = 2NaOH + H2
n(Na) = 24,15-24,15*0,05/23 =23 /23= 1 моль
n (H2) (теор.) = 0,5 n(Mg) =0,5 моль
n (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций бериллия, железа и меди с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2 Ве + O2 = 2 ВеО
Ве + Н2SO4 = ВеSО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
2. Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
3. 2Fe + 3Cl2 t →2FeCl3
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Zn + O2 = 2ZnO
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(NO3)2 + 2NaOH = 2NaNO3 + Zn(OH)2
Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3
При взаимодействии 60 г технического кальция, содержащего 2% примесей, с водой было получено 30 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Ca + 2H2О = Ca(OH)2 + Н2
n(Ca) = 60-60*0,02/40 =58,8 /40= 1,47 моль
n (H2) (теор.) = n(Ca) =1,47 моль
n (H2) = 30/22,4 = 1.34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,47 = 0,91 = 91%
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6deab0256b801616 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://9class.ru/38-otvety-na-kontrolnuyu-rabotu-po-teme-metallygabrielyan.html
http://gomolog.ru/reshebniki/9-klass/zadachnik-kuznecova-2020/4-variant-1.html