Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1600f77e0d1604 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Электрохимические процессы на электродах при коррозии металла
Схема развития коррозии поверхности корпуса судна
Задача 139.
На окрашенной поверхности корпуса судна, имеющий дефекты в покрытии, коррозионный ток сосредоточен на поврежденных участках. Составьте схему развития коррозии, а так же рассчитайте потерю металла за месяц если сила коррозионого тока, с учетом зоны действия составила 0,05 А.
Решение:
Анодный процесс:
Fe 0 — 2 
Катодный процесс в нейтральной среде:
1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксид-ионами OH – образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2. Воздух окисляет его и образуется ржавчина, гидратированный оксид железа(III):
По формуле объединенного закона электролиза:
m = Э . I . t/F = М . I . t/n.F = K . I . t, где
Э – эквивалентная масса вещества (молярная масса эквивалента); F– постоянная Фарадея, равная 96500 Кл/моль или 96500 А.с/моль;. I – сила тока, А; t – время проведения электролиза, с; М – молярная масса вещества; n – число отданных или принятых электронов; К – электрохимический эквивалент вещества.
Рассчитаем потерю металла, получим:
mпотери(Fe) = (55,845 . 0,05 . 2592000)/(2 . 96500) = 7237512/193000 = 37,5 г.
Металлы, которые применяются дла катодного покрытия стали
Задача 140.
Какие металлы могут выполнять для стальных изделий роль катодных покрытий: Ni, Cr, Mn, Sn, Cu? Запишите схему коррозии никелированного железа и определите продукт коррозии во влажном воздухе?
Решение:
К катодным покрытиям относятся те металлы, у которых потенциал выше потенциала защищаемого металла. Анодными покрытиями являются металлы, у которых электродный потенциал в данных условиях более отрицателен, чем потенциал защищаемого металла.
По таблицам найдем стандартные электродные потенциалы: Fe (-0,441 В); Ni (-0,234 B), Cr (-0,74 B), Mn (-1,18 B), Sn (-0,141 B), Cu (+0,338 B).
Так как у никеля, олова и меди электродные потенциалы выше чем у железа, то эти металлы могут выполнять для стальных изделий роль катодных покрытий.
Схема коррозии никелированного железа
При покрытии железа никелем возникает коррозионная пара, в которой никель является катодом, а железо – анодом, так как железо имеет более отрицательный потенциал (-0,441 В), чем никель (0,234 В). При этом будут протекать следующие электрохимические процессы:
а) Во влажном воздухе:
Анодный процесс: Fe 0 -2 
Катодный процесс: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом атмосферной коррозии железа будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
б) В растворе кислоты:
Анодный процесс: Fe 0 -2 
Катодный процесс: 2Н + + 2 
Водород будет выделяться во внешнюю среду, а ионы железа Fe 2+ с кислотными ионами будут образовывать соль, т. е. железо будет разрушаться с образованием ионов железа Fe 2+ .
Таким образом, при покрытии железа никелем при повреждении или при образовании пор разрушается основной металл – железо. Это пример катодного покрытия металла.
Коррозия железа в кислой среде
Задача 141.
В раствор хлороводородной (соляной) кислоты опустили железную пластинку и железную пластинку, частично покрытую никелем. В каком случае процесс коррозии железа протекает интенсивно? Составьте схемы коррозионных гальванических элементов и напишите электронные уравнения электродных процессов. Рассчитайте ЭДС гальванических элементов.
Решение:
Стандартные электродные потенциалы железа и никеля равны соответственно -0,44 В, -0,24 В.
а) Коррозия железной пластинки в растворе соляной кислоты
Окисляться, т.е. подвергаться коррозии, будет железо. Железо имеет более электроотрицательный стандартный электродный потенциал (-0,44 В), чем водород (0,00 В), поэтому оно является анодом.
Электронные уравнения электродных процессов будут иметь вид:
Анод: Fе 0 – 2 
Катод: 2Н + + 2 
Fe 0 + 2H + = Fe 2+ + H2↑
Так как ионы Fe 2+ с ионами Cl – образуют растворимую соль, придающую светло-бурую окраску раствора, то продуктом коррозии будет FeCl2:
Fe 2+ + 2Cl¯ = FeCl2 (ионная форма);
Fe + 2HCl = FeCl2 + Н2↑ (молекулярная форма).
Образуется хлорид железа и при этом выделяется газообразный водород. Происходит интенсивное разрушение железной пластинки.
Схема коррозионного гальванического элемента будет иметь вид:
или в ионном виде:
б) Коррозия никелированного железа в растворе соляной кислоты
Окисляться, т.е. подвергаться коррозии, будет железо. Железо имеет более электроотрицательный стандартный электродный потенциал (-0,44 В), чем никель (-0,24 В), поэтому оно является анодом, а никель — катодом.
Электронные уравнения электродных процессов будут иметь вид:
Анод: Fе 0 – 2 
Катод: 2Н+ + 2 
Fe 0 + 2H + = Fe 2+ + H2↑
Так как ионы Fe 2+ с ионами Cl¯образуют растворимую соль, придающую светло-бурую окраску раствора, то продуктом коррозии будет FeCl2:
Fe 2+ + 2Cl¯ = FeCl2 (ионная форма);
Fe + 2HCl = FeCl2 + Н2↑ (молекулярная форма).
Образуется хлорид железа и при этом выделяется газообразный водород. Происходит интенсивное разрушение железной пластинки. Ni менее активный металл, чем Fe — катодное покрытие.
Схема коррозионного гальванического элемента:
При нарушении целостности катодного покрытия, между никелем и железом возникает гальваническая пара, и железо, являющееся более активным металлом, под воздействием гальванического тока начнет корродировать.
Выводы:
Разрушение (коррозия) железной пластинки, частично покрытой никелем будет протекать более интенсивно, чем обычной железной пластинки.
Коррозия металлических изделий в различных средах
Пример 1.С какой деполяризацией будет протекать коррозия никеля во влажном воздухе (рН = 7) при Т = 298 К. Напишите уравнения электродных процессов и суммарной реакции коррозии. Составьте схему коррозионного гальванического элемента.
Решение.Рассчитаем потенциалы водородного и кислородного электродов:



Сравним потенциалы этих электродов со стандартным потенциалом никеля 
Так как потенциал 

Электродные процессы, протекающие на поверхности никеля:
А(–): Ni: Ni — 2е 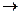
К(+): Ni: O2 + 2Н2O + 4е 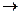

Суммарная реакция: 2Ni + O2 +2Н2О 
Побочная реакция: 2 Ni 2+ + 4ОН 

Побочные реакции протекают в тех случаях, когда продукты анодной (Ме z+ ) и катодной реакций образуют труднорастворимые соединения, в основном, гидроксиды металлов.
(A) Ni 
В cплавах или при контакте металловсначаланеобходимо определить, какой из металлов будет анодом, для чего сравниваем 
Например, в cплаве Fе–Со 
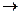
К(+): «Сu»: 2Н + + 2е – 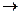

Схема коррозионного гальванического элемента: НС1, рН = 3
(А)Zn 
Основные методы защиты металлов от коррозии
Одним из основных способов является нанесение защитных покрытий на изделия. Защитные покрытия — слои, искусственно создаваемые на поверхности металлических изделий для предохранения их от коррозии.
Защитные покрытия делятся на неметаллические неорганические (оксидные, фосфатные, хроматные), неметаллические органические (лакокрасочные и полимерные) и металлические покрытия. Покрытия неметаллические неорганические и органические механически защищают металлы от коррозии, изолируя их от контакта с внешней средой.
Металлические покрытия по характеру защитного действия делятся на анодные и катодные.
Анодным, называется покрытие, стандартный потенциал которого меньше, чем у защищаемого металла. При нарушении слоя анодного покрытия возникают коррозионные гальванопары, в которых металл покрытия играет роль анода и корродирует, а на защищаемом металле — катоде — восстанавливается окислитель.
Например, для железа 
цинк 

Катодным называется покрытие, стандартный потенциал которого больше, чем у защищаемого металла. При нарушении катодного покрытия образуется гальванический элемент, в котором металлическое покрытие будет катодом, а защищаемый металл — анодом.
Например, катодными покрытиями для меди 
серебро 

Протекторная защита. К изделию присоединяют металл или сплав, потенциал которого значительно меньше потенциала изделия. Такие металлы или сплавы называются протекторами, чаще всего это А1, Мg, Zn. В коррозионной среде металл протектора растворяется, а на защищаемом металле протекают катодные процессы.
Пример 3.Подберите протектор для защиты изделия из сплава Sn-Рb от коррозии в водном растворе (рН = 1). Составьте уравнения процессов коррозии.
Решение.Поскольку 
Рассчитаем потенциалы водородного и кислородного электродов:




Поскольку 
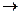
К(+): «Sn-Рb»: 2Н + + 2е – 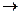
O2 + 4Н + +4е – 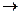
Суммарный процесс: 3 Мn + 6Н + + O2 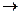
http://buzani.ru/zadachi/obshchaya-khimiya/1746-elektrokhimicheskie-protsessy-pri-korrozii-zheleza-zadachi-139-141
http://poisk-ru.ru/s47906t6.html
