Процессы коррозии различных металлов. Интенсивность коррозии
Решение задач по химии на коррозию металлов
Задание 296
Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
Решение:
Если цинковую или медную пластинки опустить в раствор сульфата меди, то в обоих случаях будет наблюдаться выпадение осадка меди. Происходит вытеснение меди цинком и железом, потому что стандартные электродные потенциалы цинка (-0,763 В) и железа (-0,44 В) значительно электроотрицательнее, чем потенциал меди (+0,34 В). Поэтому цинк и железо будут окисляться, а ионы меди Cu 2+ — восстанавливаться до металлической меди:
а) Электрохимические процессы при реакции цинка и сульфата меди
Zn 0 + Сu 2+ = Zn 2+ + Cu 0
б) Электрохимические процессы при реакции железа и сульфата меди
Fe 0 + Сu 2+ = Fe 2+ + Cu 0
Если соединить цинковую и железную пластинки, опущенные в раствор сульфата меди (II) проводником, то будет наблюдаться растворение цинковой пластинки и осаждение меди на железной пластинке. Объясняется это тем, что цинк имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому цинк будет окисляться. На железной пластинке будут восстанавливаться ионы меди, так как стандартный электродный потенциал меди имеет большее численное значение, чем потенциал железа.
Анодный процесс: Zn 0 -2 
Катодный процесс: Cu 2+ + 2 
Задание 297
Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
Решение:
Стандартные электродные потенциалы железа и цинка равны соответственно -0,44 В и -0,763 В. Потенциал, отвечающий электродному процесс:
2Н + + 2 
В нейтральной среде, равен приблизительно -0,41 В. Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислять только те металлы, потенциал которых меньше, чем -0,41 В, — это могут быть железо и цинк. Однако, эти металлы в нейтральных растворах, содержащих растворённый кислород, образуют защитную оксидную плёнку, препятствующую дальнейшему разрушению металла. Поэтому железо и цинк не могут быть окислены ионами водорода в нейтральных средах. Атмосферная коррозия – коррозия во влажном воздухе при комнатной температуре. Поверхность металла, находящегося во влажном воздухе, бывает покрыта плёнкой воды, содержащей различные газы, и в первую очередь – кислород. Скорость атмосферной коррозии зависит от рН среды. При понижении рН среды концентрация ионов водорода Н+ возрастает, что приводит к увеличению скорости коррозии металла, увеличивается восстановительный процесс на аноде:
2Н + + 2 
При повышении рН раствора уменьшается концентрация ионов водорода Н + и, соответственно, увеличивается концентрация ионов ОН-, что, согласно принципу Ле Шателье, смещает равновесие в системах: 2Н + + 2 

Электрохимические процессы, протекающие при контакте железа и цинка при контакте с водой с поглощением кислорода (атмосферная коррозия):
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Задание 298
В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Если цинковую пластинку опустить в раствор электролита, содержащего растворенный кислород, то будет наблюдаться коррозия цинка, характеризующаяся окислением его до ионов Zn 2+ :
Zn 0 -2 
Чрез некоторое время скорость реакции заметно замедляется, потому что чистый цинк окисляется кислородом, растворённым в воде, с образованием оксидной плёнки, которая, покрывая пластинку тонким слоем, пассивирует её. При этом протекает реакция:
Zn + 1/2 O2 = Zn 0
б) Если в раствор электролита опустить цинковую пластинку частично покрытую медью, процесс коррозии будет происходить значительно интенсивнее, так как образуется гальваническая пара Zn — Cu. Цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (0,34 В), поэтому цинк является анодом, а медь – катодом.
Анодный процесс: Zn 0 -2 
Катодный процесс: в кислой среде: 2Н + + 2 

В нейтральной среде или в щелочной ионы цинка Zn 2+ с гидроксид-ионами ОН- образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2. В кислой среде ионы цинка Zn 2+ с ионами кислотного остатка будут образовывать соль и при этом выделяется газообразный водород. Происходит интенсивное разрушение цинковой пластинки частично покрытой медью.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de20520185e9781 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Коррозия цинка и сплавов на его основе
 |
 |
Современный научно-технический прогресс обеспечивает высокие темпы развития цветной металлургии. Цинку в общем объеме производства цветных металлов промышленного назначения принадлежит четвертое место. Цинк и сплавы на его основе, различные цинковые соединения получили широкое применение для конструкционных и неконструкционных целей благодаря специфическим свойствам. Наиболее широко цинк используется для покрытия им металлических листов, изготовления полуфабрикатов и фасонных отливок. В последние годы сплаву на основе цинка находят применение для изготовления литых протекторов, предназначенных для защиты морских судов и металлических сооружений от коррозии.
Расширение номенклатуры цинковых изделий выдвигает новые требования к их свойствам и ставит технологические задачи перед специалистами, занимающимися производством и применением цинка и цинковых сплавов. Однако цинк — единственный из широко применяемых металлов промышленного назначения, сведения о свойствах, технологии и областях применения которого имеют ограниченный характер и разбросаны по различным отечественным, зарубежным журналам и научным трудам.
Общие сведения о коррозионной стойкости цинка
Цинк применяется практически во всех отраслях промышленности и эксплуатируется в условиях воздействия как природных, так и искусственных сред (рис.43).
Их агрессивность определяется целым рядом факторов. В атмосфере и газах решающую роль играют влажность, температура, содержание кислорода и других окислительных компонентов. Агрессивность растворов зависит от химического состава, концентрации, температуры, электропроводности и скорости потока. Для водных растворов, а также в атмосфере и газах в условиях конденсации влаги наиболее общее представление о коррозии дает диаграмма, связывающая скорость растворения цинка с рН (рис. 44 выше).
Из представленных на рис. 43 и 44 данных следует, что высокая коррозионная стойкость цинка обеспечивается в интервале рН = 6 — 12 (участок II на рис. 44). Этой области отвечает состояние цинка, при котором на его поверхности образуется стабильный гидроксид Z п (ОН),.
В кислых средах при рН 12 (участок III) скорость коррозии резко возрастает в результате нестойкости пассивирующей пленки Zn(OH)2, растворения ее и цинка с образованием ионов Zn 2+ и ZnO 2- 2.
Следует отметить, что границы областей рН, характеризующих механизм процесса разрушения цинка, изменяются в зависимости от многочисленных факторов: состава среды, температуры, скорости потока. Так, в природных средах, содержащих анионы, например Cl — , SO 2- 4 др., пассивирующая роль пленки Zn(OH) 2 проявляется незначительно или в более узком интервале рН.
Коррозионная стойкость цинка в природных средах
Скорость коррозии цинка и цинковых покрытий в незагрязненной воздушной атмосфере невысока, так как процесс осуществляется периодически — в период нахождения на поверхности цинка влаги, представляющей собой нейтральный электролит. Очевидно, скорость коррозии в этом случае зависит от длительности и цикличности нахождения цинка в условиях конденсации паров воды, от толщины пленки влаги, температуры воздуха, скорости высыхания пленки и в конечном счете от насыщения ее кислородом воздуха.
Достаточно высокая стойкость цинка во всех перечисленных случаях связана с образованием на его поверхности основных карбонатных пленок ZnCО3 • 3Zn (ОН) 2 . Н2О, создающих барьер для диффузии воды с О2 и СО2 к металлу.
В загрязненной атмосфере (промышленной и морской) механизм процесса коррозии цинка и ее скорость зависят от состава воздуха. Наиболее агрессивны атмосферы, содержащие S03 и соли хлоридов. Попадая на поверхность цинка, они преобразуют основной карбонат в растворимый сульфат ZnS04, и получаются смеси Zn(OH)2 с сульфатом и сульфитом (ZnS03) или с хлоридом (ZnCl2). Соотношение соединений в продуктах коррозии изменяется в зависимости от концентрации SO2 и хлоридов в воздухе. Однако во всех случаях образующийся осадок солей не препятствует проникновению окислительных компонентов воздуха к поверхности металла и не обладает защитными свойствами.
Известны атмосферы, загрязненные сероводородом или сульфидными соединениями. При их попадании на поверхность цинка образуется нерастворимый сульфид цинка (ZnS). Соотношение его с Zn(OH), изменяется в зависимости от концентрации H,S в воздухе и длительности контакта цинка с такой атмосферой. Образовавшийся сульфид создает электрохимическую гетерогенность поверхности и приводит к усилению коррозии цинка на участках, контактирующих с ZnS. При избытке конденсирующейся влаги и кислорода на поверхности могут образоваться также сульфиды и сульфаты и механизм процесса коррозии будет идти аналогично описанному выше.
Следует отметить, что основной карбонат цинка создает на поверхности щелочную среду. Поэтому при небольшой концентрации в воздухе примесей SO2, S 2- , С1 — , образующих с конденсированной пленкой влаги кислую среду, происходит ее нейтрализация щелочью и процесс коррозии цинка возрастает не столь существенно.
На практике скорость коррозии цинка определяется комплексом факторов, которые должны рассматриваться при оценке возможности его использования. Влажность воздуха играет определяющую роль, так как концентрации кислорода и СО, практически постоянны. При температуре 18-25 °С с ростом влажности чистого воздуха скорость коррозии повышается до 0,5-1,1 мкм/год (рис. 45).
Продукты коррозии цинка неполностью экранируют поверхность, поэтому с увеличением продолжительности убыль массы металла постоянно возрастает, достигая примерно 3-20 мкм/год при относительной влажности 75-99 % соответственно.
Промышленные атмосферы вызывают более усиленную коррозию с изменением влажности. Так, при содержании SO2 всего 0,01 % уже при относительной влажности более 15 % скорость коррозии цинка начинает возрастать и достигает 17 мкм/год при 100 % относительной влажности. С ростом концентрации SO2 скорость коррозии цинка существенно возрастает (рис. 46).
Морская атмосфера в различное время года и в различных широтах отличается по коррозионной активности. Скорость коррозии цинка при 100 % относительной влажности изменяется от 0,5 -1,0 мкм/год в северных широтах зимой до 35-50 мкм/год в тропиках.
Температура воздуха в условиях конденсации влаги оказывает существенное влияние на скорость коррозии цинка. С повышением температуры в период высыхания пленки влаги коррозионная стойкость цинка снижается. При относительной влажности, равной нулю, независимо от состава атмосферы цинк не подвержен коррозии. Толщина пленки влаги, уменьшаясь, вызывает рост скорости коррозии за счет облегчения диффузии кислорода, увеличения концентрации солей хлоридов и повышения кислотности в сернистой атмосфере. Из данных, представленных на рис. 47, видно с ростом скорости высыхания пленки и увеличением ее толщины скорость коррозии имеет экстремум.
Продолжительность воздействия атмосферы определяет общие потери цинка. На практике при эксплуатации цинка происходит изменение практически всех рассмотренных выше факторов, что создает серьезные трудности для оценки опасности коррозии цинка, выбора необходимых его толщин для удовлетворения требуемого срока службы и обеспечения надежности изделий из цинка или имеющих цинковое покрытие. По этой причине представляют интерес усредненные данные о скорости коррозии цинка в конкретных условиях эксплуатации.
Практический интерес представляют данные о скоростях коррозии цинка в типичных атмосферах (табл. выше).
Природные воды, классификация которых представлена на рис. 43, являются типичными электролитами. Возможный механизм процесса коррозии в них цинка может быть определен путем сопоставления диаграмм φ-рН, представленных на рис. 48.
Процесс коррозии цинка в воде идет преимущественно с электровосстановлением кислорода по суммарным реакциям: в кислой среде О2 + 4Н + + 4е = 2Н20, в нейтральной и щелочной средах О2 + 2Н20 + 4е = 40Н — .
В средах, не содержащих кислород, процесс коррозии цинка может идти с восстановлением ионов водорода:
Скорости коррозии цинка определяется составом, минерализацией, величиной рН и электропроводностью природных сред. Речная вода, не загрязненная промышленными сточными водами, относится к наименее агрессивной из природных сред. Это связано с тем, что большинство рек имеет невысокую минерализацию (S): наиболее чистая вода рек Печора (40 мг/л) и Нева (49 мг/л); в Волге солей до 458 мг/л. Но имеются реки с высокой минерализацией, например воды Сев. Донца и Калауса содержат 829 и 7904 мг/л солей.
Преобладающими ионами вод рек являются Ca 2+ , Mg 2+ , Na + , К + , HCO — 3, SO 2- 4, Cl — , соотношение и содержание которых непостоянны и зависят от многочисленных факторов. При этом величина рН, зависящая от содержания СО2, составляет 6,8-7,6 зимой и 7,6-8,8 летом. Электропроводность воды рек невелика и, как правило, не превышает 1 См/м при S . nZnCl2. Только в средах, содержащих H2S, образуется сульфид цинка ZnS.
Минерализация воды определяет кинетику процесса коррозии. Так, в дистиллированной воде скорость коррозии цинка составляет от 25 до 150 мкм/год в зависимости от содержания кислорода и СО,. С повышением содержания СО2 от 0 до 40 мг/л скорость коррозии возрастает от 7 до 90 мкм/год. В водопроводной и речной воде, а также в большинстве озер цинк и его сплавы имеют такую же стойкость, причем с ростом минерализации скорость коррозии, как правило, возрастает.
В морской, пластовой и подтоварной воде, а также в высокоминерализованных водах озер не обнаружена строгая связь кинетики коррозионных процессов с концентрацией солей. Как правило, скорость коррозии, отнесенная к многолетним испытаниям, мало отличается от наблюдаемой в речной воде. Усредненные же значения скорости коррозии цинка несколько выше и составляют от 25 до 60 мкм/кг.
Температура по-разному влияет на коррозию цинка в различных водах. Так, в аэрированной воздухом дистиллированной воде при 65-70 °С скорость коррозии цинка достигает максимума (рис. 49). Это связано с тем, что при указанной температуре на поверхности цинка, образуется зернистая пленка, плохо сцепленная с поверхностью. Благодаря облегченному доступу кислорода при аэрации воды воздухом процесс коррозии цинка не прекращается. При более высокой температуре образуется более совершенная пленка, затрудняющая диффузию кислорода к поверхности металла и тем самым предохраняющая цинк от коррозии.
В электропроводных водных растворах механизм влияния температуры несколько отличается от описанного. Это связано в тем, что с повышением температуры уменьшается растворимость газов в воде и прежде всего кислорода, а образующийся гидроксид или гидроксихлорид обладает более совершенными изолирующими свойствами. Подтверждением этому служат данные об изменении потенциала цинка. Так, в некоторых случаях величина потенциала сдвигается в положительную сторону настолько, что цинк становится катодом по отношению к стали, потенциал которой составляет, как правило, 0,3-0,5 В в различных средах при температуре воды до 90 °С. Интервал потенциалов неодинаков для различных марок цинка и его сплавов, а также при высоком содержании в воде газов, особенно H2S и S02.
Цинк, как правило, применяется в качестве покрытия для предотвращения коррозии стали. В электролитах при частичном нарушении покрытия цинк играет роль протектора по отношению к стали, предотвращая его коррозию путем катодной поляризации.
При показанной переплюсовке (см. рис. 48) цинк предотвращает коррозию только при полной изоляции поверхности. Незначительное нарушение покрытия приводит к усилению коррозии стали, вызывая, как правило, язвенный характер разрушения.
Подземная коррозия представляет особую опасность из-за чрезвычайно широкого диапазона физико-химических свойств почв, определяющих ее коррозионную активность, а она зависит от многочисленных факторов — состава, влажности, температуры и структуры грунта, от концентрации веществ в грунте и возможности проникновения в него воздуха.
Как и в природных водах, коррозионную активность грунтов определяет концентрация ионов С1 — и SO 2- 4. При их содержании более 0,1 % грунты вызывают, как правило, повышенную коррозию.
В грунтах могут содержаться анаэробные (сульфатовосстанавливающие) бактерии, живущие и размножающиеся при отсутствии свободного кислорода. В результате жизнедеятельности бактерий происходит восстановление SO 2- 4 по реакции (для двухвалентного Me): 4Ме + H2S04 + 2Н2О = 3Ме (ОН)2 +МеS. Промежуточным продуктом этой реакции является сероводород, снижающий рН среды и стимулирующий процесс коррозии.
Следует отметить, что коррозионную активность грунтов определяет в конечном счете удельное электросопротивление (р). Считается, что по его величине можно классифицировать грунты следующим образом:
Предлагаемая классификация не является строгой, так как при одинаковом удельном электросопротивлении, изменении состава почвы и рН (он может изменяться от 4 до 9) грунты могут иметь различную коррозионную активность. Тем не менее именно такой подход, обоснованный опытом эксплуатации подземных металлических конструкций, позволяет решать проблему защиты от коррозии. Эта проблема весьма сложна и многообразна и ее рассмотрение не входит в задачу книги. Ниже рассматривается только коррозионная стойкость цинка, применяющегося в качестве защитного покрытия.
Широкие эксперименты и многолетний опыт эксплуатации цинковых покрытий в грунтах различных типов показывают, что скорость коррозии цинка может изменяться от 3 до 130 мкм/год, причем коррозионный процесс, как правило, ускоряется по мере снижения удельного сопротивления грунтов и изменения их рН.
В отличие от рассмотренных выше природных сред для каждого грунта должны быть определены характеристики его коррозионной активности, причем эта оценка должна проводиться в различное время года через 1-5 лет. Таким образом можно выбрать необходимую толщину цинкового покрытия и гарантировать требуемый срок службы подземной металлоконструкции.
Обобщенной характеристикой стойкости цинка в природных средах, в том числе в кислых (рН = 4) и щелочных (рН =10), могут служить данные, представленные в табл. 31.
Из них следует, что применение цинкового покрытия обеспечивает возможность повышения стойкости стальных изделий в 5-20 раз.
Коррозионная стойкость цинка в искусственных средах
Как было показано выше, цинк нестоек в сильных щелочах и кислотах. В остальных химических средах цинк имеет различную коррозионную активность, и известно много случаев, когда он является незаменимым в качестве покрытия для защиты стали от коррозии. Часто продукты коррозии снижают качество химических веществ; в таких случаях независимо от стойкости стали рекомендуется применение цинкового покрытия.
Растворы солей — наиболее распространенные химические вещества, для предотвращения коррозии стали в которых применяется цинковое покрытие. Скорость его коррозии изменяется в широких пределах (от 0 до 10 мм/год) и зависит от состава солей. По величине скорости коррозии, требуемого срока службы покрытия и ответственности защищаемой металлоконструкции выбирают толщину покрытия. Для некоторых наиболее характерных растворов солей в табл. 32 представлены данные о скорости коррозии цинка. Как видно, стойкость цинка зависит от природы растворов, их концентрации и температуры.
При этом скорость коррозии в некоторых средах ничтожно мала, например, в двухромовокислом калии — всeго 0,003 мм/год. В хлориде алюминия цинк нестойкий и не может применяться.
Кислоты и щелочи
Данных о стойкости цинка в кислотах и щелочах недостаточно. Судя по данным, представленным в табл. 32, по-видимому, нельзя считать перспективным использование цинка в качестве конструкционного материала и покрытия, работающих в кислотах и щелочах.
В промышленности используются, являются конечными или промежуточными продуктами различные газообразные вещества, причем они могут быть как чистыми, так и в смеси с воздухом, парами воды и другими летучими компонентами.
Основные сухие газы — азот, хлор, оксиды углерода, аммиак, ацетилен и др. — при комнатной температуре не вызывают коррозию цинка. Только при высокой температуре и во влажной атмосфере цинк подвержен коррозии в газах. Усиленной коррозии подвержен цинк и в парах сероводорода и сернистого газа при их конденсации. В этих средах скорость коррозии близка к наблюдаемой в сернистой и серной кислотах.
Коррозионная стойкость цинковых сплавов
О систематических исследованиях, посвященных изучению влияния легирующих элементов и примесей на коррозионную стойкость цинка, сведений не имеется. Тем не менее многочисленные данные о свойствах цинка различных марок и его сплавов позволяют определить роль компонентов в их коррозионном поведении. Цинк различных марок отличается содержанием примесей свинца, железа, кадмия, меди, олова, мышьяка. Общее их содержание составляет от 0,003 до 2,5 %. Из указанных примесей с повышением содержания прежде всего меди и железа скорость коррозии цинка в окислительных средах, содержащих ионы С1 — и SO 2- 4, возрастает в 2-5 раз.
Данные многолетнего опыта применения цинка в различных отраслях промышленности при многообразии агрессивных сред и условий их коррозионного воздействия позволяют сделать ряд важных для практики обобщений.
Атмосфера, как было показано выше, не относится к числу наиболее агрессивных сред Однако и в ней скорость коррозии цинка зависит от его чистоты. Как правило, в средах с невысокой агрессивностью с увеличением содержания примесей в пределах, регламентируемых стандартом, скорость коррозии цинка возрастает в 1,5 — 2,0 раза. С повышением агрессивности среды чистота цинка в меньшей степени сказывается на его коррозионной стойкости, причем во многих случаях с повышением чистоты цинка скорость коррозии возрастает иногда в 2 раза. В пресной и морской воде скорость коррозии цинка различной чистоты мало отличается и на порядок выше, чем в атмосфере. Роль легирующих компонентов по-разному сказывается на коррозионной стойкости цинка. Катодные добавки — металлы, имеющие более положительный, чем у цинка, потенциал, как правило, вызывают снижение скорости коррозии в атмосфере. Это связано с тем, что при работе пары цинк-катод процесс коррозии первоначально идет интенсивнее, чем на чистом цинке, а защитная пленка формируется быстрее. При повышенной скорости образования пленки она отличается большей плотностью, более совершенна как изоляция поверхности от агрессивной среды и поэтому обладает более высокими защитными свойствами.
Сказанное выше относится к средам, как правило, нейтральным. При наличии в агрессивной среде активирующих ионов, а также в сильно кислом и в щелочном растворах коррозия защитной пленкой не предотвращается. В этом случае катодные легирующие элементы (Fe, Pb, Сu и др.) повышают скорость коррозии цинка, а анодные добавки (Al, Mg и др.) сами избирательно растворяются.
Следует отметить, что катодные компоненты сплавов, вызывая, как правило, язвенный характер растворения, накапливаются на поверхности. При этом, если в средах не формируется защитная пленка, растет ток пары цинк-легирующий элемент и, следовательно, возрастает во времени скорость коррозии цинка.
Для повышения коррозионной стойкости цинка нашли применение в основном катодные легирующие элементы — свинец, медь, кадмий, содержание которых составляет, как правило, не более 1 %. Анодные добавки, например алюминий и магний в количестве 0,01-0,5 %, вводят в основном вместе с катодными элементами.
Обращает на себя внимание тот факт, что в подавляющем большинстве случаев нелегированный цинк вполне стоек в агрессивных средах, и его легирования не требуется.
Защита цинковых покрытий от коррозии
Высокая коррозионная стойкость цинковых покрытий в различных средах и прежде всего в природных не исключает необходимости их защиты от коррозии. Цель защиты — возможность применения тонких покрытий, повышение срока их службы и сохранение декоративного вида изделий. Кроме того, в некоторых случаях на практике нельзя допустить и наблюдаемые минимальные скорости коррозии цинковых покрытий. Именно поэтому известны и широко применяются различные способы дополнительной обработки цинковых покрытий. О методах термохимической обработки было сказано выше, поэтому в данном разделе рассмотрим применяемые электрохимические способы и окраску.
Известно применение различных способов химического и электрохимического пассивирования цинковых покрытий для повышения их коррозионной стойкости. Процессу пассивирования предшествует подготовка поверхности изделия (обезжиривание, травление, промывка), аналогичная рассмотренной перед нанесением гальванических покрытий. Сущность процесса заключается в создании слоя защитных оксидов на поверхности цинкового покрытия, имеющих по сравнению с цинком более высокую коррозионную стойкость в агрессивной среде. В качестве пассиваторов используют различные растворы, включающие кислородсодержащие окислители, например хромовый ангидрид (СгО3), бихроматы (Сr2О 2- 7), фосфаты (PO 3- 4), нитраты (NО — 2), серную (H2S04), азотную (HN03), соляную (НС1) кислоты, соли аммония и другие компоненты. Например, высокие качества пассивирующего слоя получаются в растворах, содержащих, г/л:
а) Сr03 50; H2S04 2; НС1 50 в течение 5-15 с при 18-20 °С; б) СrО3 150; H2SO4
б; (NH4)2S04 10; HN03 30 в течение 3-10 с при 20 °С с последующей обработкой в растворе;
в) К2Сr207 20; H2S04 20 в течение 2-3 с для образования окрашенной пленки.
Сравнительные опыты показывают, что пассивирование позволяет снизить скорость коррозии цинкового покрытия в десятки раз: в водопроводной воде -от 73 до 1-5 мкм за 30 сут; в 3 %-ном растворе NaCl — от 92 до 14-23 мкм за 30 сут; в тумане из 3 %-ного раствора NaCl — от 42-56 до 14-24 мкм за 92 сут.
Некоторые способы пассивирования цинковых покрытий представлены в табл. выше.
Цинковые покрытия, полученные любыми из рассмотренных методов, имеют небольшую шероховатость и после обезжиривания легко окрашиваются. Только гладкие покрытия, полученные горячим способом, требуют механической обработки или протравливания для придания им некоторой шероховатости. Хроматированная и фосфатированная поверхность цинка также легко окрашивается. Наилучшие свойства имеют изделия, окрашенные после пассивирования.
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
 |
 |
 |
| |
| |
| |
| |
| |
| |
| |
| |
| |
 |
 НОВОСТИ НОВОСТИ |
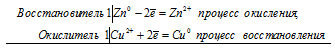











 Демонтаж доменной печи и конвертера американской компании ”AK Steel”
Демонтаж доменной печи и конвертера американской компании ”AK Steel”