Круговорот кислорода: схема, описание процесса и его значение для жизни на Земле
Кислород (O, лат. oxygenium) – неотъемлемая составляющая жизни на Земле, а также наиболее распространенный элемент в нашем теле. На его долю приходится около 65% массы тела человека, большая часть из которых находится в форме воды (H2O). Также кислород присутствует в химическом составе Земли (около 30%) и атмосфере (около 20%).
Эта статья посвящена круговороту кислорода (кислородному циклу) и его важности для всего живого на Земле. Вы узнаете о бесконечном цикле производства и использования кислорода.
Что такое круговорот кислорода?
Для жизни нужен кислород. Это бесцветный газ без запаха, на который приходится более 20% атмосферы. Вы найдете кислород в озоновом слое, двуокиси углерода, воде и даже земной коре.
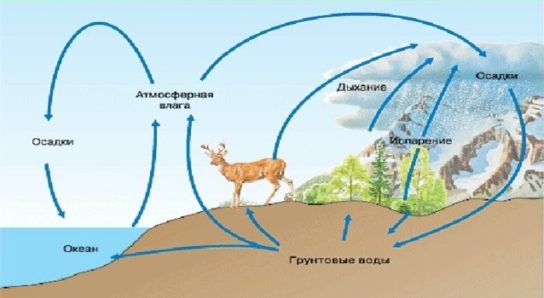
Круговорот кислорода – это очень важный биогеохимический цикл, при котором постоянно вырабатывается новый кислород и осуществляется его перенос между главными резервуарами/сферами Земли: атмосфера, биосфера, гидросфера и литосфера.
Кислород – это один из наиболее распространенных элементов на Земле, который присутствует в значительном количестве в каждом основном резервуаре. Безусловно, наибольшим резервуаром кислорода на планете являются силикатные и оксидные минералы в земной коре и мантии (99,5% от общей массы). В атмосфере, гидросфере и биосфере суммарно присутствует менее 0,05% общей массы кислорода на Земле. Кроме O2, дополнительные атомы кислорода присутствуют в различных формах, распределенных по всей поверхности резервуаров в молекулах биомассы, H2O, CO2, HNO3, NO, NO2, CO, H2O2, O3, SO2, H2SO4, MgO, CaO, AlO, SiO2, и PO4.
Как мы используем кислород?
Сделайте глубокий вдох, а затем выдохните. Все живые существа дышат посредством процесса, называемого дыханием, когда вдыхается кислород и выдыхается углекислый газ. Кислород также используется, когда умирают растения и животные. В процессе их разложение поглощается кислород и выделяется углекислый газ.
Для химических реакций также необходим кислород. Вы когда-нибудь оставляли свой велосипед под дождем и замечали, что на нем начинает образовываться ржавчина? Появление на железе ржавчины является следствие процесса окисления, при котором расходуется кислород. Пожар был бы невозможен без кислорода. В процессе горение используется кислород и выделяют углекислый газ.
Люди и другие живые существа непрерывно выделяют в атмосферу углекислый газ. Так же как автомобили, дымоходы, промышленные трубы, пожары. вулканы и т.д. В случае избытка углекислого газа и нехватки кислорода, большинство живых существ погибнет.
Как производится кислород?
Как мы уже упоминали, одним из ключевых ингредиентов в производстве кислорода является диоксид углерода. Растения и деревья производят кислород при помощи фотосинтеза. Фотосинтез – это процесс, при котором солнечный свет попадает на листья, а содержащийся в них хлорофилл – вместе с водой из почвы и углекислым газом из атмосферы – смешиваются вместе, образуя две очень важные вещи: питательные вещества для растений и кислород для животных. Во время фотосинтеза растения также выделяют лишнюю воду.
Фитопланктон – это крошечные водоросли, которое встречается в верхнем слое большинства водных сред, таких как озера, моря и океаны. На фитопланктон приходиться значительная часть глобальной выработки кислорода посредством фотосинтеза.
Где происходит кислородный цикл?
Производство и круговорот кислорода, как мы упоминали ранее происходит в четырех основных сферах Земли:
- Атмосфере (воздух) – процессе фотолиза образуется кислород, который затем формирует озоновый слой, защищающий планету от вредного солнечного излучения.
- Биосфера (глобальная экосистема Земли) – это место, где живут люди, растения и животные, и именно здесь производится наибольшее количество кислорода в процессе фотосинтеза.
- Гидросфере – фитопланктон, обитающий на поверхности океанов и морей, также использует фотосинтез для производства кислорода.
- Литосфера – крупнейший резервуар, где содержится больше всего кислорода. Кислород находится внутри горных пород и минералов, поэтому у нас нет доступа к нему. Но некоторые растения и животные могут извлекать минералы из горных пород, что позволяет выделять кислород.
Подведение итогов
Кислород – это газ без цвета и запаха, а растения и деревья – главные создатели кислорода на Земле. Фотосинтез – процесс, который растения используют для производства собственной пищи и кислорода. Круговорот кислорода происходит в четырех основных сферах Земли: атмосфере, биосфере, гидросфере и литосфере. Производство кислорода посредством кислородного цикла необходимо для сохранения жизни на планете.
Круговорот кислорода в природе
Из-за употребления кислорода всеми организмами, количество такого газа непрерывно уменьшается, поэтому запасы кислородные запасы должны постоянно восполняться. Именно этой цели способствует кислородный круговорот. Это сложнейший биохимический процесс, в течение которого атмосфера и земная поверхность обмениваются озоном. Как проходит такое круговращение, мы предлагаем узнать в этой статье.
Понятие круговорота
Среди атмосферы, литосферы, земных органических веществ и гидросферы протекает взаимообмен всевозможными химическими веществами. Взаимообмен происходит беспрестанно, перетекая из стадии в стадию. На протяжении всей истории существования нашей планеты, такое взаимодействие длится безостановочно и насчитывает уже 4,5 миллиарда лет.
Лучше всего понятия круговорота можно понять, обратившись к такой науке как геохимия. Эта наука такое взаимодействие объясняет четырьмя важнейшими правилами, которые проверенны и подтверждены не единожды проведенными опытами:
- беспрерывное распределение в земных оболочках всех химических элементов;
- беспрерывное перемещение во времени всех элементов;
- многообразное существование типов и форм;
- доминирование компонентов в рассредоточенном состоянии, над компонентами в объединенном состоянии.
Такие циклы тесно связаны с природой и деятельностью людей. Органические элементы взаимодействуют с неорганическими и образуют беспрерывный биохимический цикл называемый круговоротом.
Схема круговорота кислорода в природе
История открытия озона
До 1 августа 1774 года человечество не подозревало о существовании кислорода. Его открытием мы обязаны ученому Джозефу Пристли, который открыл его путем разложения оксида ртути в герметически закрытом сосуде, просто концентрируя солнечные лучи через огромную линзу на ртути.
Свое вложение в мировую науку этот ученный так и не осознал до конца и считал, что открыл не новое простое вещество, а всего лишь составляющую воздуха, которую гордо именовал – дефлогистированным воздухом.
Точку в открытии кислорода поставил выдающийся французский ученный – Карл Лавуазье, взяв за основу выводы Пристли: он провел ряд опытов и доказал, что кислород – отдельное вещество. Таким образом, открытие этого газа принадлежит, сразу двоим ученым – Пристли и Лавуазье.
Кислород как элемент
Кислород (oxygenium) – в переводе из греческого означает – «рождающий кислоту». Во времена Древней Греции кислотой именовали все оксиды. Этот уникальный газ – самый востребованный в природе и составляет 47% всей массы коры земли, он хранится как в земных недрах, так и в шарах атмосферы, морях, океанах, входит как составляющая более чем в полторы тысячи соединений земных недр.
Кислородный взаимообмен
Круговорот озона – это динамичное химическое взаимодействие элементов природы, живой органики, и их определяющая роль в этом действе. Биохимический цикл – процесс планетарного масштаба, он связывает атмосферные элементы с поверхностью земли и реализуется следующим образом:
- высвобождение свободного озона в процессе фотосинтеза из флоры, он рождается в растениях зеленого цвета;
- употребление образовавшегося кислорода, цель которого – поддержание дыхательной функции всех дышащих организмов, а также окисление органических и неорганических субстанций;
- другие химически преобразованные элементы, приводящие к образованию таких окислительных веществ как вода и двуокись органогена, а также повторное последовательное привлечение элементов в очередной фотосинтезирующий виток.
Кроме круговорота, происходящего за счет фотосинтеза, выделение озона также происходит из воды: из поверхности водных масс, морей, рек и океанов, дождей и других осадков. Кислород в составе воды испаряется, конденсируется и высвобождается. Кислород также получается за счет выветривания такой горной породы как известняк.
Фотосинтез как понятие
Фотосинтезом общепринято называют выделение озона в процессе высвобождения органических соединений с воды и углекислого газа. Для того чтобы процесс фотосинтеза состоялся, требуются следующие составляющие: вода, свет, тепло, углекислый газ и хлоропласты – пластиды растений, в которых содержится хлорофилл.
Благодаря фотосинтезу, образуемый кислород поднимается в атмосферные шары и образует озоновый слой. Благодаря озоновому шару, защищающему поверхность планеты от ультрафиолета, родилась жизнь на суше: морские жители смогли выйти на сушу и обосноваться на поверхности земли. Без кислорода жизнь на нашей планете прекратится.
Занимательные факты про кислород
- Кислород используют на металлургических заводах, при электрорезке и сварке, без него процесс получения хорошего металла не состоялся бы.
- Концентрированный в баллонах кислород позволяет исследовать морские глубины и космические просторы.
- Всего одно взрослое дерево способно обеспечить кислородом на год сразу троих людей.
- Из-за развития промышленности и автомобилестроения, содержание этого газа в атмосфере снизилось в два раза.
- При волнении люди употребляют в несколько раз больше кислорода, чем в умиротворенном, спокойном самочувствии.
- Чем выше земная поверхность над уровнем моря, тем кислорода и его содержание в атмосфере ниже, из-за этого в горах трудно дышать, с непривычки у человека может возникнуть кислородное голодании, кома и даже смерть.
- Динозавры смогли жить благодаря тому, что уровень озона в древности превышал теперешний в трижды, сейчас их кровь просто бы не насытилась должным образом кислородом.
Круговорот кислорода в природе – презентация
Мини видео про круговорот кислорода
Круговорот кислорода в природе уравнение
Данный урок посвящен изучению химических свойств простого вещества кислорода. Из материалов урока вы узнаете, на каких свойствах кислорода основано его применение в металлургии, медицине, пищевой промышленности и других областях.
I. Химические свойства кислорода
Кислород энергично реагирует со многими веществами: простыми – металлами и неметаллами и сложными.
Химические реакции взаимодействия веществ с кислородом называются реакциями окисления.
Химическая реакция, при которой происходит окисление веществ с выделением тепла и света называется реакцией горения.
Продуктами реакций взаимодействия веществ с кислородом, в большинстве случаев, являются оксиды.
Оксиды – это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
Общая формула оксидов: ЭхОу , где Э – это химический элемент в валентности = Nгруппы(для элементов главных подгрупп «А»), О – это кислород в валентности (II), Х и У – это индексы, полученные исходя из валентностей элемента.
1. С большинством металлов кислород реагирует уже при комнатной температуре, образуя оксиды.
- Железо сгорает в кислороде при температуре с треском и разбрасыванием искр, при этом образуется железная окалина Fe3O4 – это соединение двух оксидов железа: FeOв валентности (II) и Fe2O3в валентности (III):
- А вот медь не горит в кислороде, а окисляется кислородом при нагревании. При этом образуется оксид меди (II): 2Cu + O2 = 2CuO
- Взаимодействия кислорода с магнием.
В атмосфере кислорода магний вспыхивает ослепительным белым пламенем.При горении магния выделяются ультрафиолетовые лучи. 2Mg + O2= 2MgO
2. С неметаллами (за исключением гелия, неона, аргона) кислород реагирует, как правило, при нагревании. Так, с фосфором он реагирует при температуре
60 °С, образуя Р2О5, с серой — при температуре около 250 °С.
В чистом кислороде сера сгорает быстрее, чем на воздухе.
- С графитом кислород реагирует при 700 °С: С + О2 = СО2.
Если сжечь уголь в сосуде с кислородом, то в этом случае уголь сгорит быстрее, чем на воздухе. То есть, скорость горения угля в кислороде выше, чем на воздухе.
- Взаимодействие кислорода с азотом начинается лишь при 1200 ° С или в электрическом разряде: N2 + О2= 2NО
- Горение фосфора в кислороде: 4P + 5O2 = 2P2O5
3. Кислород реагирует и со многими сложными соединениями , например с оксидом азота (II) он реагирует уже при комнатной температуре: 2NО + О2 = 2NО2
Сероводород, реагируя с кислородом при нагревании, дает серу: 2Н2S + О2 = 2S+ 2Н2О
или оксид серы (IV): 2Н2S + ЗО2 = 2SО2 + 2Н2О в зависимости от соотношения между кислородом и сероводородом.
Алгоритм составления реакций взаимодействия веществ с кислородом
II. Применение кислорода
Применение любого вещества связано с его свойствами. Так и применение кислорода обусловлено, в основном, его способностями поддерживать дыхание и обеспечивать горение.
Рассмотрим основные области применения кислорода.
1. В металлургии, для резки и сварки металлов
Кислород используют в металлургии при производстве стали. Также, во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородо-воздушную смесь, т.е. обогащают воздух кислородом.
Рис. 1. Производство стали
Кислород в баллонах широко используется для газопламенной резки и сварки металлов. Горючий газ ацетилен, сгорая в токе кислорода, позволяет получить температуру выше 3000°С! Это приблизительно вдвое больше температуры плавления железа.
2. Окислитель топлива
Кислород, входящий в состав воздуха, применяют для сжигания топлива: например, в двигателях автомобилей, тепловозов и теплоходов.
В качестве окислителя для ракетного топлива применяется жидкий кислород. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива.
3. Применение в медицинских целях
В медицине кислород тоже нашел свое применение. Кислород используется для обогащения дыхательных газовых смесей при нарушении дыхания, для лечения астмы, профилактики гипоксии в виде кислородных коктейлей, кислородных подушек. Однако чистым кислородом при нормальном давлении долго дышать нельзя – это опасно для здоровья.
4. Применение в пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948, как пропеллент и упаковочный газ. Пропелленты — газы, выдавливающие пищевые продукты из ёмкости (контейнера, баллончика со спреем, танка или хранилища для сыпучих продуктов).
5. Биологическая роль
Кислород выполняет бесценную биологическую роль.
Кислород необходим практически всем живым существам для дыхания. Дыхание – это окислительно-восстановительный процесс, где кислород является окислителем. С помощью дыхания живые существа вырабатывают энергию, необходимую для поддержания жизни.
 |
III. Круговорт кислорода в природе
В природе кислород образуется в процессе фотосинтеза, который происходит в зелёных растениях на свету. В целях сохранения кислорода в воздухе вокруг городов и крупных промышленных центров создаются зоны зелёных насаждений.
10 удивительных фактов о кислороде, которые должен знать каждый
Наша планета поддерживает жизнь благодаря наличию воды, атмосферы и ее защитных слоев. Земля могла бы быть каменной пустыней, если бы не кислород — элемент, питающий жизнь на нашей планете. Вот интересные факты о газе, который содержится в нашей атмосфере в количестве 21 % ее объема.
1. Кислород не горит
2. Кислород хорошо растворяется
3. Вес кислорода
Этот газ отвечает за почти две трети веса большинства живых организмов, главным образом потому, что живые существа состоят из большого количества воды, а 88,9 % веса воды составляет кислород.
4. Нестабильный газ
Кислород (O) нестабилен в атмосфере нашей планеты и регулярно исчезает, поэтому его запас должен постоянно пополняться фотосинтезом. Без растительности и водорослей наша атмосфера почти не содержала бы O.
Кстати, говоря о водорослях, зеленые морские водоросли обеспечивают приблизительно 70 % кислорода, произведенного на Земле посредством фотосинтеза, остальные 30 % произведены оставшимися зелеными растениями.
5. Инопланетная жизнь
Если мы обнаружим какие-либо другие планеты с атмосферами, богатыми кислородом, можно быть практически уверенными, что на этих планетах присутствует жизнь. Значительное количество O наблюдается только там, где оно может пополняться живыми организмами.
6. Земная кора
Всего пять химических элементов составляют более 90 % веса земной коры. Почти половина этого веса — кислород. Кремний, алюминий, железо и кальций — оставшиеся элементы.
7. Холод
Мировые океаны содержат немало растворенного в воде кислорода, который поддерживает жизнь. Полярные океаны, будучи самыми холодными, содержат больше растворенного кислорода и поэтому поддерживают огромное количество живых организмов.
8. Озон
Озон (O3) – аллотропная форма кислорода, которая реагирует лучше, чем обычный кислород. Озон выделяется в природе во время крупных электрических выбросов (штормы и грозы с молниями) или ультрафиолетовым излучением в верхних слоях атмосферы Земли. Озон действует как защитный слой, предохраняющий нас от вредного воздействия ультрафиолетовых лучей. Иногда озон вместо хлора используется в обработке питьевой воды.
9. Вода
Вода (H2O) является самой широко известной молекулой, содержащей кислород. Другие известные молекулы являются оксидами, например, оксид железа, или ржавчина (Fe2O3), углекислый газ (CO2), окись алюминия (Al2O3) и кварц (SiO2).
10. Яд или афродизиак?
Слишком большое количество кислорода может оказаться токсичным. Это опасно во время подводного плавания, когда в легкие попадает большее количество О, чем обычно.
Кроме того, кислород, по мнению многих, вызывает состояние эйфории, но его воображаемые эффекты на спортивных состязаниях не доказаны с медицинской точки зрения.
http://ecoportal.info/krugovorot-kisloroda-v-prirode/
http://kardaeva.ru/88-dlya-uchenika/8-klass/152-khimicheskie-svojstva-kisloroda-oksidy-primenenie-krugovorot-kisloroda-v-prirode