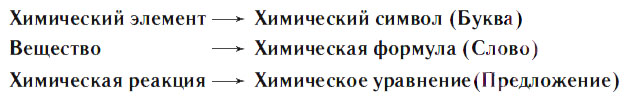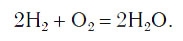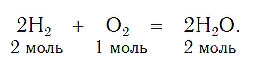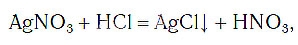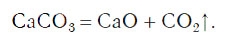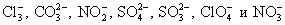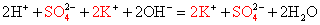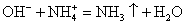§ 28. Химические уравнения
Закон сохранения массы веществ, открытый М. В. Ломоносовым в 1748 г., гласит:
| масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате её. |
Материальными носителями массы веществ являются атомы химических элементов, из которых состоят как вступившие в реакцию вещества (реагенты), так и образовавшиеся в результате её новые вещества (продукты реакции). Поскольку при химических реакциях атомы не образуются и не разрушаются, а происходит лишь их перегруппировка, то становится очевидным справедливость открытого М. В. Ломоносовым и подтверждённого позднее А. Лавуазье закона.
В справедливости закона сохранения массы веществ можно легко убедиться на простом опыте. Поместим в колбу немного красного фосфора, закроем её пробкой и взвесим на весах (рис. 96). Затем колбу осторожно нагреем. О том, что произошла химическая реакция, можно определить по появлению в колбе густого белого дыма, состоящего из оксида фосфора (V), который образовался при взаимодействии фосфора с кислородом. При повторном взвешивании колбы с продуктами этой реакции мы убедимся, что масса веществ в колбе не изменилась, хотя и произошло превращение фосфора в его оксид.
Рис. 96.
Экспериментальная проверка закона сохранения массы веществ:
а — взвешивание колбы с фосфором до реакции; б — горение фосфора в закрытой колбе; в — взвешивание колбы с продуктом реакции
Этот же вывод будет нами сделан и при проведении ещё одного простого, но очень наглядного опыта. В специальный сосуд нальём отдельно соляную кислоту и раствор щёлочи, например гидроксида натрия (рис. 97). К раствору щёлочи добавим несколько капель индикатора — фенолфталеина, отчего раствор окрасится в малиновый цвет. Закроем прибор пробкой, уравновесим гирями на весах, отметим массу, а затем сольём растворы. Малиновая окраска исчезнет, потому что кислота и щёлочь прореагировали друг с другом. Масса же сосуда с полученными продуктами реакции не изменилась.
Рис. 97.
Опыт, подтверждающий закон сохранения массы вещества
Аналогичное наблюдение сделал и автор закона сохранения массы веществ М. В. Ломоносов, который проводил опыты в запаянных стеклянных сосудах, «дабы исследовать, прибывает ли вес металла от чистого жару», и обнаружил, что «без пропущения внешнего воздуха вес металлов остаётся в одной мере».
На основании этого закона пишут химические предложения, т. е. составляют уравнения химических реакций с помощью химических слов — формул.
| Химическим уравнением называют условную запись химической реакции с помощью химических формул и математических знаков. |
В левой части уравнения записывают формулы (формулу) веществ, вступивших в реакцию, соединяя их знаком «плюс». В правой части уравнения записывают формулы (формулу) образующихся веществ, также соединённых знаком «плюс». Между частями уравнения ставят стрелку. Затем находят коэффициенты — числа, стоящие перед формулами веществ, чтобы число атомов одинаковых элементов в левой и правой частях уравнения было равным.
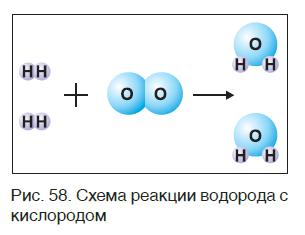
Запишем, например, уравнение реакции водорода с кислородом. Сначала составим схему реакции — укажем формулы веществ, вступающих в реакцию (водород Н2 и кислород O2) и образующихся в результате её (вода Н2O), и соединим их стрелкой:
Рис. 98.
Составление уравнения реакции взаимодействия водорода и кислорода
Так как число атомов кислорода в левой части вдвое больше, чем в правой, запишем перед формулой воды коэффициент 2:
Но теперь в правой части уравнения стало четыре атома водорода, а в левой их осталось два. Чтобы уравнять число атомов водорода, запишем перед его формулой в левой части коэффициент 2. Так как мы уравняли число атомов каждого элемента в левой и правой частях уравнения, заменим стрелку на знак равенства:
Теперь, наверное, вам понятно, почему такую запись называют уравнением (рис. 99).
Рис. 99.
Закон сохранения массы веществ на примере реакции, уравнение которой 2Н2 + O2 = 2Н2O
Для составления уравнений химических реакций, кроме знания формул реагентов и продуктов реакции, необходимо верно подобрать коэффициенты.
Это можно сделать, используя несложные правила,
1. Перед формулой простого вещества можно записывать дробный коэффициент, который показывает количество вещества реагирующих и образующихся веществ.
Так, для рассмотренного выше примера:
число атомов кислорода в правой и левой частях уравнения можно сделать равными с помощью коэффициента 1/2, поставив его перед формулой кислорода:
Но так как коэффициент показывает не только количество вещества, но и число молекул (атомов), а половину молекулы взять невозможно, лучше переписать приведённое уравнение, удвоив все коэффициенты в нём:
Приведём ещё пример составления уравнения реакции горения этана С2Н6, содержащегося в природном газе. Известно, что в результате этого процесса образуются углекислый газ и вода. Схема этой реакции:
Уравняем число атомов углерода и водорода:
Теперь в правой части уравнения реакции 7 атомов кислорода, а в левой — только 2. Уравняем число атомов кислорода, записав перед формулой 02 коэффициент 3,5 (7:2 = 3,5):
И наконец, перепишем полученное уравнение реакции, удвоив коэффициенты перед формулами всех участников реакции:
2. Если в схеме реакции есть формула соли, то вначале уравнивают число ионов, образующих соль.
Например, взаимодействие серной кислоты и гидроксида алюминия описывают схемой:
Образующаяся в результате реакции соль — сульфат алюминия Al2(SO4)3 — состоит из ионов алюминия Аl3+ и сульфат-ионов 
Чтобы уравнять число атомов водорода и кислорода, воспользуемся третьим правилом.
3. Если участвующие в реакции вещества содержат водород и кислород, то атомы водорода уравнивают в предпоследнюю очередь, а атомы кислорода — в последнюю.
Следовательно, уравняем число атомов водорода. В левой части схемы реакции 12 атомов водорода, а в правой — только 2, поэтому перед формулой воды запишем коэффициент 6:
Индикатором верности расстановки коэффициентов является равенство числа атомов кислорода в левой и правой частях уравнения реакции — по 24 атома кислорода. Поэтому заменим стрелку на знак равенства:
4. Если в схеме реакции имеется несколько формул солей, то необходимо начинать уравнивание с ионов, входящих в состав соли, содержащей большее их число.
Например, взаимодействие растворов фосфата натрия и нитрата кальция описывают схемой:
Наибольшее число ионов содержит один из продуктов реакции — фосфат кальция Са3(РO4)2, поэтому уравнивают ионы, которыми образована эта соль, — Са 2+ и 
и, наконец, ионы Na + и N0 — 3:
Ключевые слова и словосочетания
- Химические уравнения.
- Правила подбора коэффициентов в уравнениях реакций.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Запишите в виде химических уравнений следующие предложения: а) «При обжиге карбоната кальция образуются оксид кальция и оксид углерода (IV)»; б) «При взаимодействии оксида фосфора (V) с водой получается фосфорная кислота». Какая из реакций будет экзотермической, а какая — эндотермической?
- Составьте уравнения по следующим схемам:
Под формулами веществ напишите их названия.
Запишите уравнения химических реакций по следующим схемам:
Что показывает уравнение следующей химической реакции:
Вычислите количество вещества водорода, которое взаимодействует с 1 моль оксида железа (III). Вычислите объём водорода, который взаимодействует с 1 моль оксида железа (III). Вычислите количество вещества железа, которое при этом образуется. Сколько молекул воды при этом получается?
Урок 11. Химические уравнения
В уроке 11 «Химические уравнения» из курса «Химия для чайников» мы узнаем кем и когда был открыт закон сохранения массы веществ; познакомимся с химическими уравнениями и научимся правильно расставлять в них коэффициенты.
До сих пор при рассмотрении химических реакций мы обращали внимание на их качественную сторону, т. е. на то, как и при каких условиях исходные вещества превращаются в продукты реакций. Но в химических явлениях существует и другая сторона — количественная.
Закон сохранения массы веществ
Изменяется ли масса веществ, вступивших в химическую реакцию? В поиске ответа на этот вопрос английский ученый Р. Бойль еще в XVII в. провел множество опытов по прокаливанию свинца в запаянных сосудах. После окончания опытов он вскрывал сосуды и взвешивал продукты реакции. В результате Бойль пришел к выводу, что масса вещества после реакции больше массы исходного металла. Он объяснил это присоединением к металлу некой «огненной материи».
Опыты Р. Бойля по прокаливанию металлов повторил русский ученый М. В. Ломоносов в 1748 г. Прокаливание железа он проводил в специальной колбе (реторте) (рис. 56), которая была герметически запаяна. В отличие от Бойля после реакции он оставлял реторту запаянной. Взвешивание реторты после реакции показало, что ее масса не изменилась. Это свидетельствовало о том, что, хотя между металлом и веществом, содержащемся в воздухе, произошла химическая реакция, сумма масс исходных веществ равна массе продукта реакции.

М. В. Ломоносов сделал вывод: «Все перемены, в натуре случающиеся, суть такого состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому, так ежели где убудет несколько материи, то умножится в другом месте».
В 1789 г. французский химик А. Лавуазье доказал, что прокаливание металлов — это процесс их взаимодействия с одной из составных частей воздуха — кислородом. На основе работ М. В. Ломоносова и А. Лавуазье был сформулирован закон сохранения массы веществ в химических реакциях.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
При химических реакциях атомы не исчезают бесследно и не возникают из ничего. Их число остается неизменным. А так как они имеют постоянную массу, то и масса образованных ими веществ также остается постоянной.
Закон сохранения массы веществ можно проверить экспериментально. Для этого используют прибор, показанный на рисунке 57, а, б. Главная его часть — двухколенная пробирка. В одно колено нальем известковую воду, во второе — раствор медного купороса. Уравновесим прибор на весах, а затем смешаем оба раствора в одном колене. При этом мы увидим, что выпадает голубой осадок нового вещества. Образование осадка подтверждает, что произошла химическая реакция. Масса прибора при этом остается прежней. Это означает, что в результате химической реакции масса веществ не изменяется.
Закон важен для правильного понимания всего совершающегося в природе: ничто не может исчезнуть бесследно и возникнуть из ничего.
Химические уравнения
Химические реакции можно изобразить, используя химический язык формул. Химические элементы обозначают химическими символами, состав веществ записывают при помощи химических формул, химические реакции выражают при помощи химических уравнений, т. е. так же, как из букв составляются слова, из слов — предложения.
Уравнение химической реакции (химическое уравнение) — это условная запись реакции при помощи химических формул и знаков «+» и «=».
Закон сохранения массы веществ в химических реакциях должен соблюдаться и при составлении уравнений химических реакций. Как и в математических уравнениях, в уравнениях химических реакций имеется левая часть (где записываются формулы исходных веществ) и правая часть (где записываются формулы продуктов реакции). Например (рис. 58):
При написании уравнений химических реакций знак «+» (плюс) соединяет формулы веществ в левой и правой частях уравнения. Так как масса веществ до реакции равна массе образовавшихся веществ, используется знак «=» (равно), который связывает левую и правую части уравнения. Для уравнивания числа атомов в левой и правой частях уравнения используются числа перед формулами веществ. Эти числа называются коэффициентами химических уравнений и показывают число молекул или формульных единиц. Поскольку 1 моль любого вещества состоит из одинакового числа структурных единиц (6,02*10 23 ), то коэффициенты показывают и химические количества каждого из веществ:
При написании химических уравнений применяют также и специальные знаки, например знак «↓», обозначающий, что вещество образует осадок:
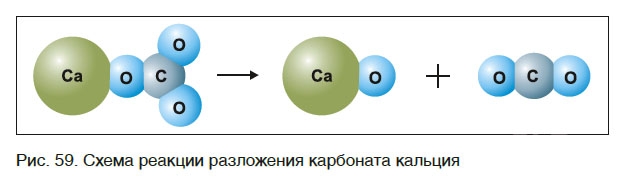
знак «↑», обозначающий, что вещество выделяется в виде газа (рис. 59):
Часто в уравнениях химических реакций над знаком «=» указывают условия их протекания: нагревание (t), облучение светом (hν), электрический ток (↯) и др.
Краткие выводы урока:
- В химических реакциях соблюдается закон сохранения массы веществ: масса исходных веществ равна массе продуктов реакции.
- Сущность химической реакции состоит в перегруппировке атомов, из которых состояли исходные вещества, с образованием новых веществ.
- Число атомов каждого химического элемента до реакции должно быть равно их числу после реакции.
- Химическое уравнение — условная запись реакции при помощи химических формул и специальных знаков.
Надеюсь урок 11 «Химические уравнения» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

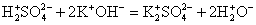
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.
АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
Записываем молекулярное уравнение химического процесса.
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
- растворимые соли;
- сильные кислоты (H2SO4, HNO3, HCl и др.);
- растворимые в воде основания.
Записываем в виде молекул:
- нерастворимые соли;
- слабые кислоты, щелочи, вода;
- оксиды;
- газы;
- простые вещества;
- большинство органических соединений.
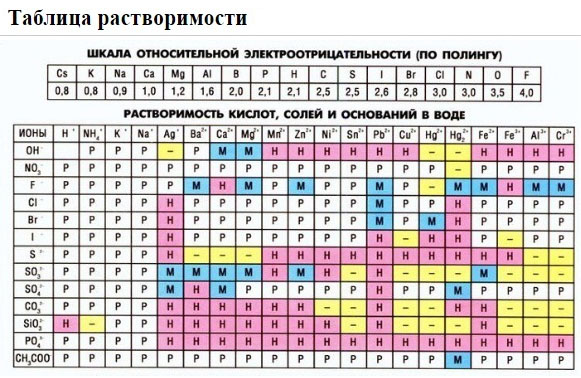
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
Записываем молекулярное уравнение, проверяем коэффициенты.
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.
http://himi4ka.ru/arhiv-urokov/urok-11-himicheskie-uravnenija.html
http://rosuchebnik.ru/material/ionnye-uravneniya/