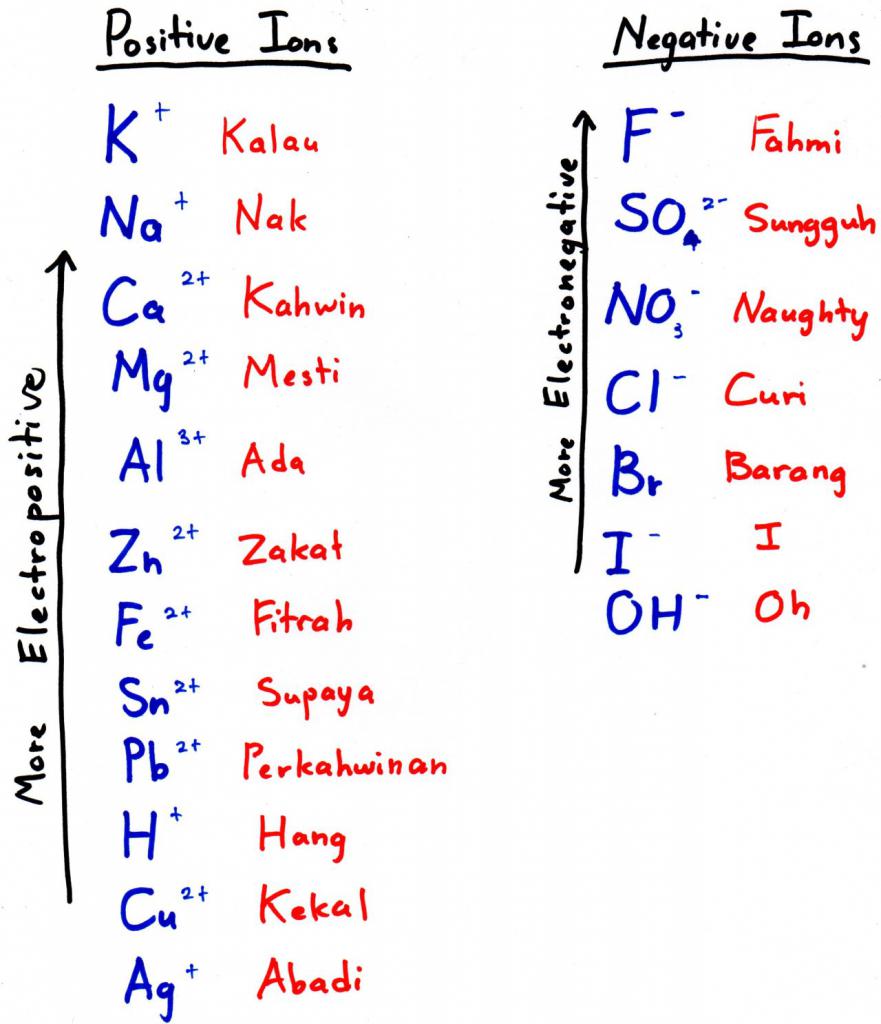
Гидроксид лития: способы получения и химические свойства
Гидроксид лития при стандартных условиях представляет собой бесцветные кристаллы. Растворяется в воде.
Относительная молекулярная масса Mr = 23, 95; относительная плотность для тв. и ж. состояния d = 1, 46; tпл = 471◦ C;
Способы получения
1. Гидроксид лития получают электролизом раствора хлорида лития :
2LiCl + 2H2O → 2LiOH + H2 + Cl2
2. При взаимодействии лития, оксида лития, гидрида лития и пероксида лития с водой также образуется гидроксид лития:
2Li + 2H2O → 2LiOH + H2
Li2O + H2O → 2LiOH
2LiH + 2H2O → 2LiOH + H2
3. Карбонат лития при взаимодействии с гидроксидом кальция образует гидроксид лития:
Качественная реакция
Качественная реакция на гидроксид лития — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид лития реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2. Гидроксид лития реагирует с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3. Гидроксид лития реагирует с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид лития также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид лития взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида лития:
Сера взаимодействует с гидроксидом лития только при нагревании:
6. Гидроксид лития взаимодействует с амфотерными металлами , кроме железа и хрома. При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2LiOH + 2Al + 6Н2О = 2Li[Al(OH)4] + 3Н2
7. Гидроксид лития вступает в обменные реакции с растворимыми солями .
Хлорид меди (II) реагирует с гидроксидом лития с образованием хлорида лития и осадка гидроксида меди (II):
2LiOH + CuCl2 = Cu(OH)2↓+ 2LiCl
Также с гидроксидом лития взаимодействуют соли аммония .
Например , при взаимодействии хлорида аммония и гидроксида лития образуются хлорид лития, аммиак и вода:
NH4Cl + LiOH = NH3 + H2O + LiCl
8. Гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Гидроксид лития проявляет свойства сильного основания. В воде практически полностью диссоциирует , образуя щелочную среду и меняя окраску индикаторов.
LiOH ↔ Li + + OH —
10. Гидроксид лития в расплаве подвергается электролизу . При этом на катоде восстанавливается сам литий, а на аноде выделяется молекулярный кислород:
4LiOH → 4Li + O2 + 2H2O
Как из оксида алюминия получить алюминий? Химические формулы
Алюминий обладает свойствами, которые применимы во многих промышленностях: военном деле, строительстве, питании, транспорте и др. Он пластичный, легкий и широко распространен в природе. Многие люди даже не подозревают того, как широко можно использовать алюминий.
Многие сайты и книги описывают этот чудесный металл и его свойства. Информация находится в свободном доступе.
В лаборатории можно производить любые соединения алюминия, но в малых количествах и по высоким ценам.
История добычи элемента
Вплоть до середины девятнадцатого века ни об алюминии, ни о восстановлении его оксида речи не шло. Первая попытка получения алюминия была предпринята химиком Х. К. Эрстедом и закончилась успешно. Чтобы восстановить металл из его оксида, он использовал амальгамированный калий. Но никто не понял, что получилось в итоге.
Прошло несколько лет, и алюминий снова был получен химиком Велером, который нагрел безводный хлорид алюминия с калием. Ученый упорно трудился 20 лет и, наконец, сумел создать гранулированный металл. По цвету он напоминал серебро, но был легче него в несколько раз. Длительное время до начала двадцатого века алюминий ценился больше золота и выставлялся в музеях как экспонат.
Где-то в начале XIX века английский химик Дэви провел электролиз оксида алюминия и получил металл, названный «алюмиум» или «алюминум», что можно переводить как «квасцы».
Алюминий очень трудно отделить от других веществ — это одна из причин его дороговизны в то время. Ученое собрание и промышленники быстро узнали о потрясающих свойствах нового металла и продолжили попытки его добычи.
В больших количествах алюминий стали получать уже в конце того же девятнадцатого века. Ученый Ч. М. Холлом предложил растворять оксид алюминия в расплаве криолита и пропускать эту смесь через электрический ток. Через какое-то время в сосуде появлялся чистый алюминий. В промышленности и сейчас производят металл этим методом, но об этом позже
Для производств нужна прочность, которой, как выяснилось чуть позднее, у алюминия не было. Тогда металл стали сплавлять с иными элементами: магнием, кремнием и т. д. Сплавы были намного прочнее обычного алюминия — именно из них стали выплавлять самолеты и военную технику. А придумали слить алюминий и другие металлы в единое целое в Германии. Там же, в Дюрене, сплав, названный дюралюминием, поставили на производство.
Как из оксида алюминия получить алюминий
В рамках школьной программы по химии проходят тему «Как из оксида металла получить чистый металл».
К этому методу мы можем отнести и наш вопрос, как из оксида алюминия получить алюминий.
Чтобы образовать металл из его оксида, нужно добавить восстановитель — водород. Пойдет реакция замещения с образованием воды и металла: МеО + Н2 = Ме + Н2О (где Ме — металл, а Н2 — водород).
На практике такой прием позволяет получать чистые активные металлы, которые не восстанавливаются оксидом углерода. Метод подходит для очистки небольшого количества алюминия и довольно-таки дорого стоит.
Как получить алюминий из оксида алюминия через добавление более электроотрицательного металла
Чтобы получить алюминий этим способом, нужно подобрать более электроотрицательный металл и добавить его к оксиду — он вытеснит наш элемент из кислородного соединения. Более электроотрицательный металл — это тот, что стоит левее в электрохимическом ряду (на фото к подзаголовку — выше).
Примеры: 3Mg + Al2О3 = 2Al + 3MgO
Но как получить алюминий из оксида алюминия в условиях широкой промышленности?
Промышленный способ
Большинство производств для добычи элемента используют руды, которые называют бокситами. Сначала из них выделяют оксид, потом растворяют его в расплаве криолита, а затем получают чистый алюминий путем электрохимической реакции.
Это обходится дешевле всего и не требует дополнительных операций.
Кроме того, можно получить хлорид алюминия из оксида алюминия. Как это сделать?
Получение хлорида алюминия
Хлоридом алюминия называют среднюю (нормальную) соль из соляной кислоты и алюминия. Формула: AlCl3.
Для получения нужно добавить кислоту.
Уравнение реакции выглядит следующим образом — Al2О3 + 6HCl = 2AlCl3 + 3Н2О.
Как получить хлорид алюминия из оксида алюминия, не добавляя кислот?
Для этого надо прокалить спрессованную смесь оксида алюминия и углерода (сажа) в токе хлора при 600-800 гр. Хлорид должен отогнаться.
Эту соль применяют в качестве катализатора многих реакций. Ее главная роль — образование продуктов присоединения с разными веществами. Хлоридом алюминия протравливают шерсть, и его добавляют в антиперспиранты. Также соединение играет не последнюю роль в переработке нефти.
Получение гидроксоалюмината натрия
Как из оксида алюминия получить гидроксоалюминат натрия?
Чтобы получить это сложное вещество, можно продолжить цепочку превращений и сначала получить из оксида хлорид, а потом добавить гидроксид натрия.
Хлорид алюминия — AlCl3, гидроксид натрия — NaOH.
AlCl3 + 4NaOH (концентрированный) = Na[Al(OH)4] + 3NaCl5
Но как из оксида алюминия получить тетрагидроксоалюминат натрия, избегая превращения в хлорид?
Чтобы из оксида алюминия получить алюминат натрия, нужно создать гидроксид алюминия и добавить к нему щелочь.
Следует напомнить, что щелочь — это основание, растворимое в воде. Сюда относят гидроксиды щелочных и щелочноземельных металлов (I и II группа таблицы Менделеева).
Из оксидов металлов средней активности, к которым относится алюминий, нельзя получать гидроксиды. Поэтому сначала мы восстановим чистый металл, например, через водород:
А потом получим гидроксид.
Чтобы получить гидроксид, надо растворить алюминий в кислоте (для примера, во фтороводородной): 2Al + 6HF = 2AlF3 + 3Н2. А затем прогидролизовать полученную соль с добавлением равного количества щелочи в разбавленном растворе: AlF3 +3NaOH = Al(ОН)3 + 3NaF.
(Al(ОН)3 — амфотерное соединение, которое может взаимодействовать и с кислотами, и с щелочами).
Тетрагидроксоалюминат натрия отлично растворяется в воде, а еще это вещество широко применяют в оформлении и добавляют в бетон, чтобы ускорить отвердевание.
Про метаалюминаты
Начинающие производители глинозема, наверное, задавались вопросом: «Как из оксида алюминия получить метаалюминат натрия?»
Алюминаты используются в широком производстве для ускорения некоторых реакций, окрашивания тканей и получения глинозема.
Лирическое отступление: глинозем — это, по сути, и есть оксид алюминия Al2О3.
Обычно оксид добывают из метаалюминатов, но здесь будет рассмотрен «обратный» способ.
Итак, чтобы получить наш алюминат, нужно просто смешать оксид натрия с оксидом алюминия при очень высокой температуре.
Случится реакция соединения — Al2О3 + Na2О = 2NaAlO2
Для нормального протекания требуется температура в 1200°C.
Можно проследить за изменением энергии Гиббса в реакции:
Еще одно лирическое отступление:
Энергия Гиббса (или «свободная энергия Гиббса») — это зависимость, которая существует между энтальпией (энергией, доступной для преобразований) и энтропией (мерой «хаоса», беспорядка в системе). Абсолютное значение измерить невозможно, поэтому измеряются изменения во время протекания процесса. Формула: G (энергия Гиббса) = Н (изменение энтальпии между продуктами и исходными веществами реакции) — Т (температура) * S (изменение энтропии между продуктами и исходниками). Измеряется в Джоулях.
Как из оксида алюминия получить алюминат?
Для этого подойдет и тот способ, который был рассмотрен выше — с глиноземом и натрием.
Оксид алюминия, смешанный с оксидом другого металла при высоких температурах, и дает метаалюминат.
Но еще можно сплавить гидроксид алюминия со щелочью в присутствии оксида углерода СО:
- Al2О3 + 2КОН = 2KAlO2 + Н2О (здесь глинозем растворяется в едкой щелочи калия) — алюминат калия;
- Al2О3 + Li2О = 2LiAlO2 — алюминат лития;
- Al2О3 + СаО = СаО × Al2О3 — сплавление оксида кальция с окисью алюминия.
Получение сульфата алюминия
Как получить сульфат алюминия из оксида алюминия?
Способ включен в школьную программу восьмых и девятых классов.
Сульфат алюминия — это соль вида Al2(SO4)3. Представлена может быть в виде пластинок или порошка.
Это вещество может разлагаться на оксиды алюминия и серы при температуре от 580 градусов. Сульфат используется для очистки воды от мельчайших частиц, очень полезен в пищевой, бумажной, тканевой и других отраслях производства. Он широко доступен благодаря своей низкой цене. Очистка воды происходит из-за некоторых особенностей сульфата.
Дело в том, что загрязняющие частицы имеют вокруг себя двойной электрический слой, а рассматриваемый реагент является коагулянтом, который, при проникновении в электрическое поле частиц, вызывает сжатие слоев и нейтрализует заряд частиц.
Теперь о самом методе. Чтобы получить сульфат, нужно смешать оксид и серную (не сернистую) кислоту.
Выходит реакция взаимодействия глинозема с кислотой:
Вместо оксида можно добавить сам алюминий или его гидроксид.
В промышленности для получения сульфата используют уже известную из третьей части этой статьи руду — боксит. Ее обрабатывают серной кислотой и получают «загрязненный» сульфат алюминия. В боксите содержится гидроксид, а реакция в упрощенном виде выглядит так:
Бокситы
Боксит — это руда, состоящая сразу из нескольких минералов: железа, бемита, гиббсита и диаспора. Является главным источником добычи алюминия, образуется путем выветривания. Крупнейшие месторождения бокситов находятся в России (на Урале), США, Венесуэле (река Ориноко, штат Боливар), Австралии, Гвинее и Казахстане. Эти руды бывают моногидратными, тригидратными и смешанными.
Получение оксида алюминия
Про глинозем выше сказано много, но до сих пор не описано, как получить оксид алюминия. Формула — Al2О3.
А нужно всего-навсего сжечь алюминий в кислороде. Горение — процесс взаимодействия О2 и другого вещества.
Простейшее уравнение реакции выглядит следующим образом:
Оксид не растворяется в воде, но он хорошо растворим в криолите при высокой температуре.
Свои химические свойства оксид проявляет при температуре от 1000°С. Именно тогда он начинает взаимодействовать с кислотами и щелочами.
В естественных условиях корунд является единственный устойчивой вариацией вещества. Корунд очень твердый, с плотностью примерно 4000 г/м 3 . Твердость этого минерала по шкале Мооса — 9.
Оксид алюминия — амфотерный оксид. Легко преобразовывается в гидроксид (см. выше), а превратившись, сохраняет все свойства своей группы с преобладанием основных.
Амфотерные оксиды — это оксиды, которые могут проявлять как основные (свойства оксидов металлов), так и кислотные (оксидов неметаллов) свойства в зависимости от условий.
К амфотерным оксидам, исключая оксид алюминия, относятся: оксид цинка (ZnO), оксид бериллия (ВеО), оксид свинца (PbO), оксид олова (SnO), оксид хрома (Cr2О3), оксид железа (Fe2О3) и оксид ванадия (V2О5).
Соли: комплексные и не очень
Бывают средние (нормальные), кислые, основные и комплексные.
Средние соли состоят из самого металла и кислотного остатка и имеют вид AlCl3 (хлорид алюминия), Na2SO4 (сульфат натрия), Al(NO3)3 (нитрат алюминия) или MgPO4.
Кислые соли — это соли из металла, водорода и кислотного остатка. Их примеры: NaHSO4, CaHPO4.
Основные соли так же, как и кислые, состоят из кислотного остатка и металла, но вместо Н там ОН. Примеры: (FeOH)2SO4, Ca(OH)Cl.
И, наконец, комплексные соли — это вещества из ионов разных металлов и кислотного остатка многоосновной кислоты (соли, содержащие сложный ион): Na3[Co(NO2)6], Zn[(UO2)3(CH3COO)8].
Речь пойдет о том, как из оксида алюминия получить комплексную соль.
Условием превращения оксида в это вещество является его амфотерность. Глинозем отлично подходит для метода. Чтобы получить комплексную соль из оксида алюминия, нужно смешать этот оксид с раствором щелочи:
Этот род веществ также образуется при воздействии растворов щелочей на амфотерные гидроксиды.
Раствор гидроксида калия взаимодействует с основанием цинка с получением тетрагидроксоцинката калия:
Раствор щелочи натрия реагирует, например, с гидроксидом берилия с образованием тетрагидроксобериллата натрия:
Использование солей
Комплексные соли алюминия часто используют в фармацевтике, производстве витаминов и биологически активных веществ. Препараты, созданные на основе этих веществ, помогают в борьбе с похмельем, улучшают состояние желудка и общее самочувствие организма человека. Очень полезные соединения, как можно заметить.
Реактивы дешевле покупать в интернет-магазинах. Там большой выбор веществ, но сайты лучше выбирать надежные и проверенные временем. Если покупать что-то на «однодневках», то риск потерять деньги увеличивается.
При работе с химическими элементами нужно соблюдать правила безопасности: обязательно наличие перчаток, защитного стекла, специализированной посуды и приборов.
Эпилог
Химия – несомненно, сложная для понимания наука, но иногда полезно в ней разобраться. Проще всего это сделать через интересные статьи, простой слог и понятные примеры. Не лишним будет прочитать пару книг по теме и освежить в памяти курс школьной программы по химии.
Здесь было разобрано большинство тем химии, связанных с преобразованиями алюминия и его оксидов, в том числе, как из оксида алюминия получить тетрагидроксоалюминат, и еще множество интересных фактов. Оказалось, что у алюминия есть много самых необычных сфер применения в производстве и в быту, да и история получения металла весьма незаурядна. Химические формулы соединений алюминия тоже заслуживают внимания и подробного разбора, что и было освящено в этой статье.
Напишите уравнения реакций электролиза оксида алюминия и взаимодействия оксидаалюминия со следующими веществами : H2SO4, NaOH, P2O5, Li20?
Химия | 5 — 9 классы
Напишите уравнения реакций электролиза оксида алюминия и взаимодействия оксидаалюминия со следующими веществами : H2SO4, NaOH, P2O5, Li20.
2Al2O3 — — — (электролиз в расплаве Na3[AlF6]) — — — > ; 4Al + 3O2
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Al2O3 + P2O5 — — — (t°) — — — > ; 2AlPO4
Li2O + Al2O3 — — — (t°) — — — > ; 2LiAlO2.
Напишите уравнения реакций взаимодействия алюминия со следующими веществами : бромом, разбавленной серной кислотой, раствором сульфата меди (II), оксидом хрома (III)?
Напишите уравнения реакций взаимодействия алюминия со следующими веществами : бромом, разбавленной серной кислотой, раствором сульфата меди (II), оксидом хрома (III).
Первое уравнение рассмотрите как ОВР.
Напишите уравнения реакций взаимодействия следующих веществ при нагревании : а)алюминия с разбавленной серной кислотой ; б) серебра с концентрированной серной кислотой?
Напишите уравнения реакций взаимодействия следующих веществ при нагревании : а)алюминия с разбавленной серной кислотой ; б) серебра с концентрированной серной кислотой.
В трех пробирках находятся следующие сухие вещества : оксид кальция, оксид алюминия, оксид фосфора?
В трех пробирках находятся следующие сухие вещества : оксид кальция, оксид алюминия, оксид фосфора.
При помощи каких реагентов можно различить эти вещества?
Напишите уравнения реакций.
Напишите уравнение реакции электролиза оксида алюминия и взаимодействия оксида со следующими веществами : H2SO4, NaOH, P2O5, Li2O?
Напишите уравнение реакции электролиза оксида алюминия и взаимодействия оксида со следующими веществами : H2SO4, NaOH, P2O5, Li2O.
Составьте уравнения реакций взаимодействия с водой следующих веществ :натрия, оксида кальция, оксида углерода?
Составьте уравнения реакций взаимодействия с водой следующих веществ :
натрия, оксида кальция, оксида углерода.
С веществами каких классов взаимодействуют кислотные оксиды?
С веществами каких классов взаимодействуют кислотные оксиды.
Напишите уравнение реакций.
Оксид алюминия не взаимодействует с каждым из веществ в ряду А) NO, Cu Б) NO, KCO B) KO, NaOH Г) HSO, NaO?
Оксид алюминия не взаимодействует с каждым из веществ в ряду А) NO, Cu Б) NO, KCO B) KO, NaOH Г) HSO, NaO.
Напишите уравнение возможных реакций оксида цинка со следующими веществами : NaOH , H2O , BaCI2, H2SO4?
Напишите уравнение возможных реакций оксида цинка со следующими веществами : NaOH , H2O , BaCI2, H2SO4.
Напишите уравнение возможных реакций оксида цинка со следующими веществами : NaOH , H2O , BaCI2, H2SO4 ?
Напишите уравнение возможных реакций оксида цинка со следующими веществами : NaOH , H2O , BaCI2, H2SO4 .
С какими из следующих веществ взаимодействует гидроксид калия : серная кислота, оксид натрия, гидроксид алюминия, оксид фосфора 5, и гидроксид кальция?
С какими из следующих веществ взаимодействует гидроксид калия : серная кислота, оксид натрия, гидроксид алюминия, оксид фосфора 5, и гидроксид кальция?
Напишите уравнения реакций.
На этой странице сайта, в категории Химия размещен ответ на вопрос Напишите уравнения реакций электролиза оксида алюминия и взаимодействия оксидаалюминия со следующими веществами : H2SO4, NaOH, P2O5, Li20?. По уровню сложности вопрос рассчитан на учащихся 5 — 9 классов. Чтобы получить дополнительную информацию по интересующей теме, воспользуйтесь автоматическим поиском в этой же категории, чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы расположена кнопка, с помощью которой можно сформулировать новый вопрос, который наиболее полно отвечает критериям поиска. Удобный интерфейс позволяет обсудить интересующую тему с посетителями в комментариях.
http://fb.ru/article/397413/kak-iz-oksida-alyuminiya-poluchit-alyuminiy-himicheskie-formulyi
http://himia.my-dict.ru/q/3089247_napisite-uravnenia-reakcij-elektroliza-oksida-aluminia/