Оксид лития: способы получения и химические свойства
Оксид лития — это белое, гигроскопичное, тугоплавкое вещество, при нагревании не разлагается.
Относительная молекулярная масса = 29,88; относительная плотность для тв. и ж. состояния = 2, 013; tпл = 1453º C; tкип ≈ 2600º C.
Способ получения
1. Оксид лития можно получить путем взаимодействия лития и кислорода :
2. Оксид лития получается при разложении гидроксида лития:
2LiOН → Li2O + Н2O
3. Путем термического разложения карбоната лития с образованием оксида лития и оксида углерода:
4. При термическом разложении нитрата лития образуется оксид лития, оксид азота и кислород:
Химические свойства
1. Литий вытесняется из оксида в результате взаимодействия с другими металлами :
1.1. Оксид лития взаимодействует с металлами и некоторыми неметаллами с образованием лития и оксида металла:
Li2O + Si = 4Li + SiO2
Li2O + Mg = 2Li + MgO
3Li2O + 2Al = 6Li + Al2O3
2. Оксид лития взаимодействует со сложными веществами:
2.1. Оксид лития реагирует с водой . Образуется гидроксид лития:
Li2O + H2O = 2LiOH
2.2. Оксид л ития взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид лития с соляной кислотой образует хлорид лития и воду:
2.3. При взаимодействии лития с оксидами образуются соли:
Составить уравнение реакций, отражающих следующие химические превращения:
1) литий + кислород = оксид лития
2) азот + кислород = оксид азота (II)
3) карбонат магния = оксид магния + оксид углерода (IV)
4) гидроксид алюминия + оксид алюминия + вода
5) цинк + соляная кислота = хлорид цинка + водород
6) оксид ванадия (V) + алюминий = ванадий + оксид алюминия
7) гидроксид магния + фосфорная кислота = фосфат магния + вода
8) хлорид алюминия + нитрат серебра = хлорид серебра + нитрат алюминия
Оксид лития
| Оксид лития | |
|---|---|
 | |
| Систематическое наименование | Оксид лития |
| Традиционные названия | Окись лития |
| Хим. формула | Li2O |
| Рац. формула | Li2O |
| Состояние | твёрдое |
| Молярная масса | 29,8774 г/моль |
| Плотность | 2,013 г/см³ |
| Температура | |
| • плавления | 1570 [1] |
| • кипения | 2600 [1] °C |
| Растворимость | |
| • в воде | 6,67 (0 °C) |
| Рег. номер CAS | 12057-24-8 |
| PubChem | 166630 |
| Рег. номер EINECS | 235-019-5 |
| SMILES | |
| RTECS | OJ6360000 |
| ChemSpider | 145811 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид лития (окись лития) — бинарное неорганическое вещество, имеющее химическую формулу Li2O. Относится к классу основных оксидов.
Содержание
- 1 Описание
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 5 См. также
Описание
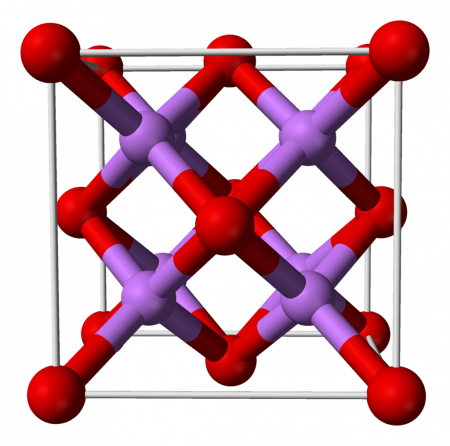
Оксид лития при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы с кубической решёткой. Пространственная группа F m3m, a = 0,4628 нм, Z = 4.
При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании. При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов дает оксометаллаты, двойные и тройные оксиды. Оксид лития — единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития). [2]
Получение
- Взаимодействие металлического лития с кислородом:
4 Li + O2 ⟶ 2 Li2O
- Разложение пероксида лития при температуре 195 °C:
2 Li2O2 → 195∘C 2 Li2O + O2↑
Химические свойства
- Взаимодействует с водой, образуя щёлочь:
Li2O + H2O → 2 LiOH
- с кислотами:
Li2O + 2 HCl → 2 LiCl + H2O
- литий из оксида вытесняется некоторыми металлами и неметаллами:
Li2O + Mg → 800∘C 2 Li + MgO 2 Li2O + Si → 1000∘C 4 Li + SiO2
- с кислотообразующими оксидами образует соли:
Li2O + CO2 → 500∘C Li2CO3
Применение
Оксид лития применяют в качестве добавки к смесям реагентов при твердофазном синтезе двойных и тройных оксидов для понижения температуры процесса; как компонент в производстве специальных стёкол (в частности, с небольшим температурным коэффициентом линейного расширения и прозрачных для рентгеновских лучей), глазурей и эмалей, повышающий их химическую и термическую стойкость, прочность и снижающий вязкость расплавов. Также используется в термобарьерных покрытиях вместе с оксидами иттрия и циркония для повышения стойкости.
http://urokam.net/himija/742942.html
http://chem.ru/oksid-litija.html

