Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Марганец, цинк и сереброМарганецСодержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам. Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 — амфотерные, +6, +7 — кислотные. Наиболее известными минералами, в которых содержится марганец, являются:
Получают марганец алюминотермией, восстановлением коксом, электролизом. MnO2 + C = (t) Mn + CO
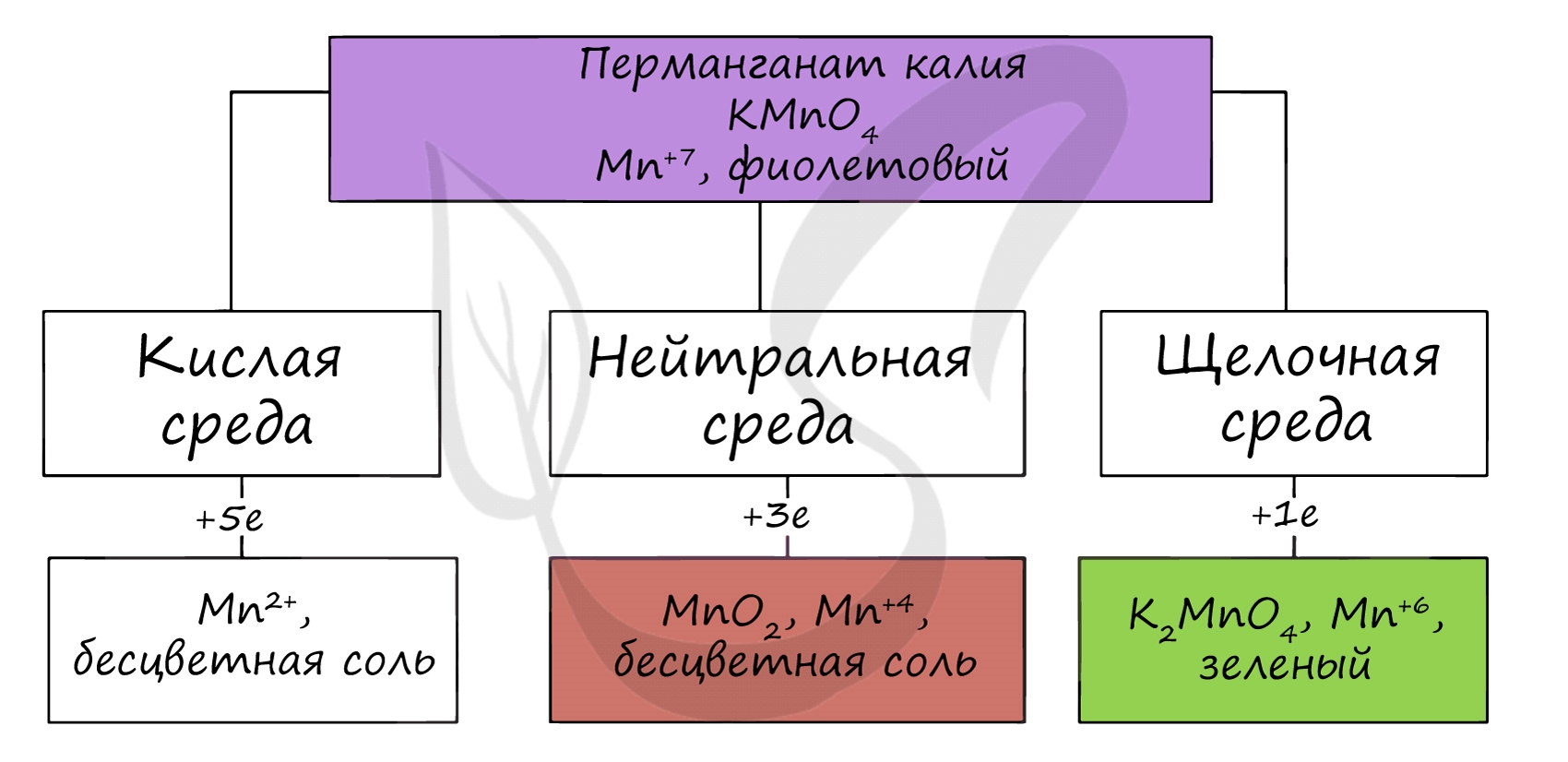
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка. При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором. При нагревании марганец вытесняет водород из воды. Реакции с кислотами Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот. Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется. Соединения марганца (II) Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II). При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II). Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV). Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли. Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит. При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+ Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II). В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2. MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная) Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет. Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде. В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором. Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют кислотные свойства. Соли марганцовой кислоты — перманганаты. В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже. Оксид марганца (VII) получают в реакции перманганата с сильными кислотами. При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты. Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II). В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение. При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода. При стоянии в растворе постепенно разлагается водой. В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn 2+ , в щелочной — Mn 6+ . Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав меди с цинком — латунь. Для цинка характерна постоянная степень окисления +2. Наиболее известные минералы, в которых содержится цинк:
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2. ZnO + C = (t) Zn + CO ZnO + CO = (t) Zn + CO2 Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном. Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком. Реакции с кислотами Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород. Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия) Соединения цинка (II) Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка. Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами. ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия) Комплексные соли образуются в растворе, при прокаливании они не образуются. ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия) Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями. ZnO + C = (t) Zn + CO ZnO + CO = (t) Zn + CO2 Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами. Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями. При прокаливании комплексные соли распадаются, вода испаряется. СереброДрагоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра. Реакции с кислотами Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами. Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода. С органическими веществами В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра. Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты. © Беллевич Юрий Сергеевич 2018-2022 Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. Блиц-опрос по теме Марганец, цинк и серебро Пособие-репетитор по химииЗАНЯТИЕ 10 Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11/2006 План
2. Процесс окисления, важнейшие восстановители. 3. Процесс восстановления, важнейшие окислители. 4. Окислительно-восстановительная двойственность. 5. Основные типы ОВР (межмолекулярные, внутримолекулярные, диспропорционирование). 7. Методы составления уравнений ОВР (электронный и электронно-ионный баланс). Все химические реакции по признаку изменения степеней окисления участвующих в них атомов можно разделить на два типа: ОВР (протекающие с изменением степеней окисления) и не ОВР. Степень окисления – условный заряд атома в молекуле, рассчитанный, исходя из предположения, что в молекуле существуют только ионные связи. П р а в и л а д л я о п р е д е л е н и я с т е п е н е й о к и с л е н и я
Сумма степеней окисления атомов в сложном веществе (в молекуле) равна нулю. Степень окисления атомов щелочных металлов +1. Степень окисления атомов щелочно-земельных металлов +2. Степень окисления атомов бора, алюминия +3. Степень окисления атомов водорода +1 (в гидридах щелочных и щелочно-земельных металлов –1). Степень окисления атомов кислорода –2 (в пероксидах –1). Любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов. Процесс отдачи электронов называют окислением. Частицы (атомы, молекулы или ионы), отдающие электроны, называют восстановителями. В результате окисления степень окисления восстановителя увеличивается. Восстановителями могут быть частицы в низшей или промежуточной степенях окисления. Важнейшими восстановителями являются: все металлы в виде простых веществ, особенно активные; C, CO, NH3, PH3, CH4, SiH4, H2S и сульфиды, галогеноводороды и галогениды металлов, гидриды металлов, нитриды и фосфиды металлов. Процесс присоединения электронов называют восстановлением. Частицы, принимающие электроны, называют окислителями. В результате восстановления степень окисления окислителя уменьшается. Окислителями могут быть частицы в высшей или промежуточной степенях окисления. Важнейшие окислители: простые вещества-неметаллы, обладающие высокой электроотрицательностью (F2, Cl2, O2), перманганат калия, хроматы и дихроматы, азотная кислота и нитраты, концентрированная серная кислота, хлорная кислота и перхлораты. Вещества, содержащие частицы в промежуточной степени окисления, могут выступать как в роли окислителей, так и в роли восстановителей, т.е. проявляют окислительно-восстановительную двойственность. Это сернистая кислота и сульфиты, хлорноватистая кислота и гипохлориты, пероксиды и др. Различают три типа окислительно-восстановительных реакций. Межмолекулярные ОВР – окислитель и восстановитель входят в состав различных веществ, например: Внутримолекулярные ОВР – окислитель и восстановитель входят в состав одного вещества. Это могут быть разные элементы, например: или один химический элемент в разных степенях окисления, например: Диспропорционирование (самоокисление-самовосстановление) – окислителем и восстановителем является один и тот же элемент, находящийся в промежуточной степени окисления, например: ОВР имеют огромное значение, поскольку большинство реакций, протекающих в природе, относятся к этому типу (процесс фотосинтеза, горение). Кроме того, ОВР активно используются человеком в его практической деятельности (восстановление металлов, синтез аммиака): Для составления уравнений ОВР можно использовать метод электронного баланса (электронных схем) или метод электронно-ионного баланса. Метод электронного баланса: Метод электронно-ионного баланса: Тест по теме «Окислительно-восстановительные реакции»
а) хромат калия; б) оксид хрома(III); в) гидроксид хрома(III); г) сульфид хрома(III). 2. Какой продукт реакции между перманганатом калия и бромоводородной кислотой может реагировать с сероводородом? а) Бром; б) бромид марганца(II); в) диоксид марганца; г) гидроксид калия. 3. При окислении йодида железа(II) азотной кислотой образуются йод и монооксид азота. Чему равно отношение коэффициента при окислителе к коэффициенту при восстановителе в уравнении этой реакции? а) 4 : 1; б) 8 : 3; в) 1 : 1; г) 2 : 3. 4. Степень окисления атома углерода в гидрокарбонат-ионе равна: а) +2; б) –2; в) +4; г) +5. 5. Перманганат калия в нейтральной среде восстанавливается до: а) марганца; б) оксида марганца(II); в) оксида марганца(IV); г) манганата калия. 6. Сумма коэффициентов в уравнении реакции диоксида марганца с концентрированной соляной кислотой равна: а) 14; б) 10; в) 6; г) 9. 7. Из перечисленных соединений только окислительную способность проявляют: а) серная кислота; б) сернистая кислота; в) сероводородная кислота; г) сульфат калия. 8. Из перечисленных соединений окислительно-восстановительную двойственность проявляют: а) пероксид водорода; б) пероксид натрия; в) сульфит натрия; г) сульфид натрия. 9. Из перечисленных ниже типов реакций окислительно-восстановительными являются реакции: а) нейтрализации; б) восстановления; в) диспропорционирования; г) обмена. 10. Степень окисления атома углерода численно не совпадает с его валентностью в веществе: а) тетрахлорид углерода; б) этан; в) карбид кальция; г) угарный газ.
Упражнения по окислительно-восстановительным реакциям
1. Цинк + дихромат калия + серная кислота = сульфат цинка + сульфат хрома(III) + сульфат калия + вода. 2. Сульфат олова(II) + перманганат калия + серная кислота = сульфат олова(IV) + сульфат марганца + сульфат калия + вода. 3. Йодид натрия + перманганат калия + гидроксид калия = йод + манганат калия + гидроксид натрия. 4. Сера + хлорат калия + вода = хлор + сульфат калия + серная кислота. 5. Йодид калия + перманганат калия + серная кислота = сульфат марганца(II) + йод + сульфат калия + вода. 6. Сульфат железа(II) + дихромат калия + серная кислота = сульфат железа(III) + сульфат хрома(III) + сульфат калия + вода. 7. Нитрат аммония = оксид азота(I) + вода. 8. Фосфор + азотная кислота = фосфорная кислота + оксид азота(IV) + вода. 9. Азотистая кислота = азотная кислота + оксид азота(II) + вода. 10. Хлорат калия + соляная кислота = хлор + хлорид калия + вода. 11. Дихромат аммония = азот + оксид хрома(III) + вода. 12. Гидроксид калия + хлор = хлорид калия + хлорат калия + вода. 13. Оксид серы(IV) + бром + вода = серная кислота + бромоводородная кислота. 14. Оксид серы(IV) + сероводород = сера + вода. 15. Сульфит натрия = сульфид натрия + сульфат натрия. 16. Перманганат калия + соляная кислота = хлорид марганца(II) + хлор + хлорид калия + вода. 17. Ацетилен + кислород = углекислый газ + вода. 18. Нитрит калия + перманганат калия + серная кислота = нитрат калия + сульфат марганца(II) + сульфат калия + вода. 19. Кремний + гидроксид калия + вода = силикат калия + водород. 20. Платина + азотная кислота + соляная кислота = хлорид платины(IV) + оксид азота(II) + вода. 21. Сульфид мышьяка + азотная кислота = мышьяковая кислота + сернистый газ + диоксид азота + вода. 22. Перманганат калия = манганат калия + оксид марганца(IV) + кислород. 23. Сульфид меди(I) + кислород + карбонат кальция = оксид меди(II) + сульфит кальция + 24. Хлорид железа(II) + перманганат калия + соляная кислота = хлорид железа(III) + хлор + 25. Сульфит железа(II) + перманганат калия + серная кислота = сульфат железа(III) + сульфат марганца(II) + сульфат калия + вода. Ответы на упражнения задания 1
При использовании метода полуреакций (электронно-ионный баланс) следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходит по-разному в кислой, нейтральной и щелочной средах. В кислых растворах избыток кислорода связывается протонами с образованием молекул воды, а в нейтральных и щелочных – молекулами воды с образованием гидроксид-ионов. Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде – за счет гидроксид-ионов с образованием молекул воды. Задание 2. С помощью метода электронно-ионного баланса составить уравнения ОВР, протекающих в определенной среде. В н е й т р а л ь н о й с р е д е
2. Гидроксид железа(II) + кислород + вода = . . 3. Бромид натрия + перманганат калия + вода = . . 4. Сероводород + бром + вода = серная кислота + . . 5. Нитрат серебра(I) + фосфин + вода = серебро + фосфорная кислота + . . В щ е л о ч н о й с р е д е
2. Бромид калия + хлор + гидроксид калия = бромат калия + . . 3. Сульфат марганца(II) + хлорат калия + гидроксид калия = манганат калия + . . 4. Хлорид хрома(III) + бром + гидроксид калия = хромат калия + . . 5. Оксид марганца(IV) + хлорат калия + гидроксид калия = манганат калия + . . В к и с л о й с р е д е
2. Нитрит калия + йодид калия + серная кислота = оксид азота (II) + . . 3. Перманганат калия + оксид азота(II) + серная кислота = оксид азота(IV) + . . 4. Йодид калия + бромат калия + соляная кислота = . . 5. Нитрат марганца(II) + оксид свинца(IV) + азотная кислота = марганцовая кислота + Ответы на упражнения задания 2 В н е й т р а л ь н о й с р е д е
Задание 3. С помощью метода электронно-ионного баланса составить уравнения ОВР. 2. Оксид марганца(IV) + кислород + гидроксид калия = манганат калия +. . 3. Сульфат железа(II) + бром + серная кислота = . . 4. Йодид калия + сульфат железа(III) = . . 5. Бромоводород + перманганат калия = . . 6. Хлороводород + оксид хрома(VI) = хлорид хрома(III) + . . 8. Оксид меди(I) + азотная кислота = оксид азота(II) + . . 9. Сульфид калия + манганат калия + вода = сера + . . 10. Оксид азота(IV) + перманганат калия + вода = . . 11. Йодид калия + дихромат калия + серная кислота = . . 12. Сульфид свинца(II) + пероксид водорода = . . 13. Хлорноватистая кислота + пероксид водорода = соляная кислота + . . 14. Йодид калия + пероксид водорода = . . 15. Перманганат калия + пероксид водорода = оксид марганца(IV) + . . 16. Йодид калия + нитрит калия + уксусная кислота = оксид азота(II) + . . 17. Перманганат калия + нитрит калия + серная кислота = . . 18. Сернистая кислота + хлор + вода = серная кислота + . . 19. Сернистая кислота + сероводород = сера + . . Ответы на упражнения задания 3 источники: http://studarium.ru/article/179 http://him.1sept.ru/article.php?ID=200601303 |



















 1. Окислительно-восстановительные реакции (ОВР), степень окисления.
1. Окислительно-восстановительные реакции (ОВР), степень окисления.






 1. Дихромат калия обработали сернистым газом в сернокислом растворе, а затем водным раствором сульфида калия. Конечным веществом Х является:
1. Дихромат калия обработали сернистым газом в сернокислом растворе, а затем водным раствором сульфида калия. Конечным веществом Х является: Задание 1. Составить уравнения ОВР с помощью метода электронного баланса, определить тип ОВР.
Задание 1. Составить уравнения ОВР с помощью метода электронного баланса, определить тип ОВР.





