Математическая термодинамика
Вы будете перенаправлены на Автор24
Основным математическим аппаратом в классической термодинамики является гипотеза дифференциальных фазовых форм, которая представляет собой две и более независимые переменные, а также способы преобразования частных производных от одной группы независимых показателей к другой.
На сегодняшний день ученые выделяют два типа дифференциальных форм:
- неполное уравнение — характеризуется зависимостью решения от пути интегрирования;
- полный дифференциал — предполагает независимость интеграла от выбора пути.
Примеров, иллюстрирующих свойства указанных критериев математической термодинамики можно привести множество из различных областей физики, экономики и химии. Также часто используются простые термодинамические системы, состояние которых непременно определяется заданием основных значений двух независимых переменных. В этом случае дифференциальная форма будет иметь более простой вид.
Математическая формулировка второго закона термодинамики
Рисунок 1. Математическое выражение 2-го начала термодинамики. Автор24 — интернет-биржа студенческих работ
Согласно первому закону классической термодинамике математическое выражение удельной внутренней энергии можно приравнять к алгебраической сумме, полученной системой в форме показателя внешней работы. Это позволяет подвести тепловую энергию к работе тела, в результате чего значительно уменьшается энергетический потенциал. Следует подчеркнуть, что математическая формулировка в этом случае справедлива только для обратимых процессов, протекающих бесконечно медленно без потери энергии.
Работа, совершаемая при этом, является максимальной. При необратимых явлениях тепло любого физического тела всегда меньше, чем при обратимых. Изменение же уровня энтропии, являющейся функцией общего состояния, не зависит от характера происходящего процесса. Поэтому для необратимого процесса. Это соотношение и называется математической формулировкой второго закона термодинамики.
Готовые работы на аналогичную тему
Для реализации этих расчетов необходимо учитывать задание математических уравнения в виде величин удельной энергии основного состояния концепции.
Как правило, этот показатель практически не изменяется, так может быть задан для определенных моделей или косвенно определен посредством упомянутых выше выражений. Обязательный учет наличия внешних электромагнитных полей необходимо включить в работающую схему, в итоге — увеличится общее количество уравнений. Это проще всего с помощью предварительного подсчета изменения свободной энергии при включении линий системы от нуля до заданной величины.
Математические задачи термодинамики
Рисунок 2. Второе начало термодинамики. Автор24 — интернет-биржа студенческих работ
Математическая термодинамика – это прежде всего задачи, которые напрямую связаны с изучением наиболее общих свойств макроскопических систем, находящихся в состоянии термодинамического равновесия, и физических процессов перехода между данными состояниями.
Математический аппарат термодинамики исходит из основных термодинамических начал. Согласно нулевому закону, любая концепция должна иметь единственное и постоянное в термодинамическом смысле устойчивое состояние, которое возможно определить с помощью фиксации внешних условий, в которых находится система.
Первое начало – основной закон сохранения и превращения энергии, используемый для квазистатического малого изменения показателей состояния системы в виде медленного перехода из одной позиции в другую.
Такой эффект связывает тепловую энергию этого процесса с внезапным изменением внутреннего потенциала концепции. В качестве достаточно простого и наглядного примера можно выбрать систему типа идеального газа с фиксированным количеством частиц, то его общее состояние фиксируется тремя параметрами, задав изначально, к примеру, его объем, температуру и число элементов. Тогда связанная с процессом расширения работа определяет давление газа наряду с первым началом баланса тепловой энергии.
Из второго начала термодинамики для квазистатических процессов следует факт существования энтропии, как равномерной функции термодинамических состояния. Следовательно, в этом случае полный дифференциал необходимо учитывать в математической формулировке для удельной энергии как функции и удельного объема $v = \frac
Остальные термодинамические характеристики и потенциалы системы определяются уже путем полученных решений с применением математических операций, однако не сложнее операций дифференцирования. Для получения правильных решений уравнений все элементы в концепции должны быть заданы. Эта конкретизация системы зачастую включает задание формул состояния и калорического уравнения состояния в качестве теплоемкости, которые определяют макроскопические явления по отношению к изменению внешних показателей.
Константу возможно отнести в счет главного выбора начала отсчета внутренней энергии. Энтропийный параметр, крайне важные при решении ряда конкретных проблем, устанавливается с помощью третьего начала термодинамики, которое в более радикальной формулировке Планка выглядит как второстепенное условие к системе действующих уравнений.
Математические основы иерархической термодинамики
Рисунок 3. Математическое выражение второго закона термодинамики. Автор24 — интернет-биржа студенческих работ
Математическая база иерархической термодинамики живых систем является термодинамической функцией.
Способы иерархий и разделения, их наличие в научных рассуждениях в виде количественного метода анализа «движения» выполняют значимую роль во временном и пространственном развитиях.
Важным является то обстоятельство, что при разбивании процессов на классы, каждый должен оказаться только в одной окружающей среде. Это значит, что необходимо соблюдать принципы полноты и несовместимости. Что касается нестабильности, то при совмещении нескольких материальных веществ, в частности, когда все три параметра возможно фиксировать-разделять, получаются различные допустимые состояния физического процесса.
Математически неразличимые уравнения несут, в отдельности, очень ценную для науки информацию о комплексном развитии системы с качественной точки зрения. Взгляд на явления посредством теплоты отлично работает, следовательно, дает повод изучить процессы с различных теорий и мнений.
Приводящий к математическому уравнению подход является всеобщим и постоянным: рассуждая таким образом, можно прийти к уравнениям «геодезическим» в дифференциальной геометрии, обеспечивающим полноценный переход к «самому центру механического мира » и к «основам термодинамического учения» тем самым, подчеркивая «глубокую аналогию между современной механикой и термодинамикой». Иерархическая связь осуществляется по определенной системе матрешек — каждый уровень которой входит в другой, как его существенная часть и каждый подобен собственному элементу.
Необратимость тепловых процессов. Второй закон термодинамики. Понятие энтропии
Первый закон термодинамики – закон сохранения тепловых процессов, устанавливающий связь между количеством теплоты Q и изменением ∆ U внутренней энергии и работой А , совершенной над внешними телами:
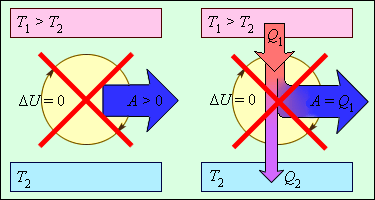
Исходя из закона, энергия не может быть создана или уничтожена: производится процесс передачи от одной системы к другой, принимая другую форму. Еще не было получено процессов, нарушающих первый закон термодинамики. Рисунок 3 . 12 . 1 показывает устройства, противоречащие первому закону.
Рисунок 3 . 12 . 1 . Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1 .
Обратимый и необратимый процессы
Первый закон термодинамики не устанавливает направления тепловых процессов. Опыты показывают, что большинство тепловых процессов протекают в одном направлении. Их называют необратимыми.
Если имеется тепловой контакт двух тел с разными температурами, тогда направление теплового потока направляется от теплого к холодному. Самопроизвольной передачи тепла от тела с низкой температуры к телу с высокой не наблюдается. Отсюда следует, что теплообмен с конечной разностью температур считается необратимым.
Обратимым процессом называется переход системы из одного равновесного расстояния в другое, которые возможно проводить в обратном направлении в той же последовательности промежуточных равновесных состояний. Она вместе с окружающими телами возвращаются к исходному состоянию.
Если система находится в состоянии равновесия во время процесса, она называется квазистатической.
Когда рабочее тело тепловой машины контактирует с тепловым резервуаром, температура которого неизменна во время всего процесса, то только изотермический квазистатический процесс считается обратимым, так как протекает с бесконечно малой разницей температур рабочего резервуара. Если имеется два резервуара, причем с разными температурами, тогда обратимым путем можно провести процессы на двух изотермических участках.
Так как адиабатический процесс проводится в обоих направлениях (сжатие и расширение), наличие кругового процесса с двумя изотермами и двумя адиабатами (цикл Карно) говорит о том, что это и есть единственный обратимый круговой процесс, где рабочее тело контактируется с двумя тепловыми резервуарами. Остальные при наличии 2 тепловых резервуаров считаются необратимыми.
Превращение механической работы во внутреннюю энергию считаются необратимыми при наличии силы трения, диффузии в газах и жидкостях, а процесс перемешивания по причине начальной разности давлений и так далее. Все реальные процессы считаются необратимыми, даже если значения будут максимально приближены к обратимым. Обратимые рассматриваются как пример реальных процессов.
Первый закон термодинамики не различает их. Правило требует от термодинамического процесса определенного энергетического баланса, но не говорит о том, возможен ли он. Установка направления прохождения процесса определяется вторым законом термодинамики. Его формулировка может звучать как запрет на определенные термодинамические процессы.
Второй закон был трактован У. Кельвином в 1851 .
В циклически действующей тепловой машине невозможно прохождение процесса, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Предположительно, машина с такими процессами могла бы получить название вечного двигателя второго рода.
При земных условиях могла бы быть отбита энергия Мирового океана и полностью превратилась бы в ее работу. Масса воды Мирового океана – 10 21 к г . Для его охлаждения хотя бы на 1 градус потребуется огромное количество энергии ≈ 10 24 Д ж , которое сравнимо с сжиганием 10 17 к г угля. Вырабатываемая энергия на Земле за год в 10 4 раз меньше. Отсюда и вывод о том, что вечный двигатель второго рода мало вероятен, как и двигатель первого, потому как оба они недопустимы, исходя из первого закона термодинамики.
Второй закон термодинамики
Формулировка 2 -го закона термодинамики была дана физиком Р. Клаузиусом.
Невозможно прохождение процесса, единственным результатом которого была бы передача энергии при помощи теплообмена от тела с низкой температуры к телу с более высокой.
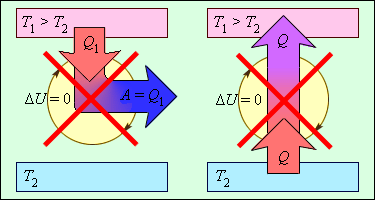
Рисунок 3 . 12 . 2 объясняет процессы, которые запрещены вторым законом, но разрешены согласно первому. Они соответствуют трактовкам второго закона термодинамики.
Рисунок 3 . 12 . 2 . Процессы, не противоречащие первому закону термодинамики, но запрещаемые вторым законом: 1 – вечный двигатель второго рода; 2 – самопроизвольный переход тепла от холодного тела к более теплому (идеальная холодильная машина).
Формулировки обоих законов считаются эквивалентными.
Когда тело без помощи внешних сил переходит при теплообмене от холодного к горячему, то возникает мысль о возможности создания вечного двигателя второго рода. Если такая машина получит количество теплоты Q 1 от нагревателя и отдаст холодильнику Q 2 , тогда совершается работа A = Q 1 — Q 2 . Если бы Q 2 самопроизвольно перешло к нагревателю, то конечный результат тепловой машины и идеальной холодильной машины выглядело бы таким образом Q 1 — Q 2 . Причем сам переход происходил бы без изменений холодильника. Отсюда вывод – комбинация тепловой машины и идеальной холодильной машины равноценна двигателю второго рода.
Прослеживается связь между вторым законом термодинамики и необратимостью реальных тепловых процессов. Энергия теплового движения молекул отлична от механической, электрической и так далее. Она способна превратиться в другой вид энергии только частично. Поэтому при наличии энергии теплового движения молекул любой процесс считается необратимым, так как полностью в обратном направлении он не осуществим.
Свойство, относящееся к необратимым процессам, говорит о том, что они проходят в термодинамически неравновесной системе, а результат получается в виде замкнутой системы, приближающейся к состоянию термодинамического равновесия.
Теоремы Карно
Имеются теоремы Карно, которые могут быть доказаны, исходя из второго закона термодинамики.
КПД тепловой машины, работающей при данных значениях температур нагревателя холодильника, не может иметь значение больше, чем КПД действия машины, работающей согласно обратимому циклу Карно с теми же значениями температур нагревателя и холодильника.
КПД действия тепловой машины, работающей по циклу Карно, не зависит от рода рабочего тела, а только от температур нагревателя и холодильника.
Отсюда следует, что КПД действия машины с циклом Карно считается максимальным.
η = 1 — Q 2 Q 1 ≤ η m a x = η К а р н ю = 1 — T 2 T 1 .
Знак равенства данной записи говорит об обратимости процесса. Если машина работает по циклу Карно, тогда:
Q 2 Q 1 = T 2 T 1 или Q 2 T 2 = Q 1 T 1 .
Знаки Q 1 и Q 2 всегда отличаются независимо от направления цикла. Поэтому получаем:
Q 1 T 1 + Q 2 T 2 = 0 .
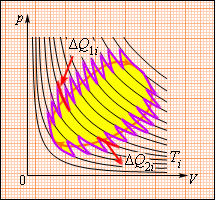
Рисунок 3 . 12 . 3 говорит о том, что данное соотношение обобщается и представляется в виде последовательности малых изометрических и адиабатических участков.
Рисунок 3 . 12 . 3 . Произвольный обратимый цикл как последовательность малых изотермических и адиабатических участков.
Полный обход замкнутого обратимого цикла имеет вид:
∑ ∆ Q i T i = 0 (обратимый цикл).
Откуда ∆ Q i = ∆ Q 1 i + ∆ Q 2 i – количество теплоты, полученное рабочим телом на двух изотермических участках с температурой T i . Чтобы данный цикл провести наоборот, нужно рабочее тело сконтактировать со многими тепловыми резервуарами с T i .
Энтропия
Отношение Q i T i получило название приведенного тепла. Формула показывает, что полное приведенное тепло на любом обратимом цикле равно нулю. Благодаря ей вводится еще одно понятие – энтропия, обозначаемая S . Ее открыл Р. Клаузиус в 1865 году.
При переходе из одного равновесного состояние в другое изменяется и ее энтропия. Разность энтропий двух состояний равняется приведенному теплу, полученному системой во время обратного перехода состояния.
∆ S = S 2 — S 1 = ∑ ( 1 ) ( 2 ) ∆ Q i о б р T .
Если рассматривается адиабатический процесс ∆ Q i = 0 , тогда энтропия S не изменяется.
Изменение энтропии ∆ S во время перехода в другое состояние фиксируется как формула:
∆ S = ∫ ( 1 ) ( 2 ) d Q о б р T .
Определение энтропии достаточно точное. Разность ∆ S двух состояний системы подразумевает физический смысл. Если имеется необратимый переход, а необходимо найти энтропию, тогда нужно придумать обратимый процесс, который свяжет начальное и конечное состояние. После этого перейти к нахождению приведенного тепла, полученного системой.
Рисунок 3 . 12 . 4 Модель энтропии и фазовых переходов.
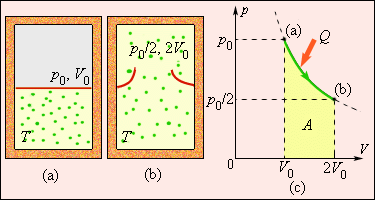
Рисунок 3 . 12 . 5 показывает необратимый процесс расширения шага с отсутствием теплообмена. Равновесными считаются начальное и конечное значение, изображаемые на диаграмме p , V . Точки a и b соответствуют состояниям и располагаются на одной изотерме. Чтобы найти ∆ S , следует перейти к рассмотрению обратимого изотермического перехода из a в b . При изопроцессе газ получает определенное количество теплоты окружающих тел Q > 0 , тогда при необратимом расширении энтропия возрастет до ∆ S > 0 .
Рисунок 3 . 12 . 5 . Расширение газа в «пустоту». Изменение энтропии ∆ S = Q T = A T > 0 где A = Q – работа газа при обратимом изотермическом расширении.
Еще одним примером необратимого процесса считается теплообмен при конечной разности температур. Рисунок 3 . 12 . 6 и показывает два тела, заключенные в адиабатическую оболочку, где начальные температуры обозначаются как T 1 и T 2 T 1 . Течение процесса теплообмена способствует выравниванию температур. Очевидно, что теплое тело отдает, а холодное принимает. Холодное тело превосходит по модулю приведенное тепло, отдаваемое горячим. Отсюда вывод – изменение энтропии в замкнутой системе необратимого процесса ∆ S > 0 .
Рисунок 3 . 12 . 6 . Теплообмен при конечной разности температур: a – начальное состояние; b – конечное состояние системы. Изменение энтропии Δ S > 0 .
Все самопроизвольно протекающие процессы в изолированных термодинамических процессах характеризуются ростом энтропии.
Обратимые процессы имеют постоянную энтропию ∆ S ≥ 0 . Соотношение называют законом возрастания энтропии.
При любых процессах, протекающих в термодинамических изолированных системах, энтропия либо не меняется, либо возрастает.
Наличие энтропии говорит о самопроизвольно протекающем процессе, а ее рост – приближение всей системы к термодинамическому равновесию, где S принимает максимальное значение. Возрастание энтропии можно трактовать как формулировку второго закона термодинамики.
В 1878 году Л. Больцман дал вероятностное определение понятию энтропии, так как было предложено рассматривать ее в качестве меры статистического беспорядка замкнутой термодинамической системы. Все самопроизвольно протекающие процессы в таких системах приближают ее к равновесному состоянию, так как сопровождаются ростом энтропии, и направляют в сторону увеличения вероятности состояния.
Если состояние макроскопической системы содержит большое число частиц, то его реализация может предусматривать несколько способов.
Термодинамическая вероятность W системы – это количество способов, которыми реализуется данное состояние макроскопической системы, макросостояний, осуществляющих его.
Из определения имеем, что W ≫ 1 .
При наличии 1 м о л ь газа в емкости существует число N способов размещения молекулы по двум половинам емкости: N = 2 N А , где N А — число Авогадро. Каждое из них – это микросостояние.
Одно из них соответствует случаю с молекулами, собранными в одной половине сосуда. Вероятность такого события приравнивается к нулю. Большое количество состояний соответствует такому, где молекулы распределяются равномерно по всей площади емкости.
Тогда равновесное состояние является наиболее вероятным.
Равновесное состояние считается состоянием наибольшего беспорядка в термодинамической системе с максимальной энтропией.
Исходя из трактовок Больцмана, энтропия S и термодинамическая вероятность W связаны:
S = k · ln W , где k = 1 , 38 · 10 — 23 Д ж / К является постоянная Больцмана. Отсюда следует, что определение энтропии определяется логарифмом числа микросостояний. Именно они способствуют реализации данного макросостояния. Тогда энтропия может быть рассмотрена в качестве меры вероятности состояния термодинамической системы.
Вероятностная трактовка второго закона термодинамики допускает самопроизвольное отклонение системы от состояния термодинамического равновесия. Их называют флуктуациями.
В системах с большим числом частиц отклонения от состояния равновесия имеют достаточно малую вероятность на существование.
Второй закон термодинамики
Второй закон термодинамики устанавливает критерии, позволяющие определить направление самопроизвольного протекания процессов.
Самопроизвольными называют процессы, которые протекают в системе без затраты энергии извне.
Процессы бывают обратимыми и необратимыми. Необратимые процессы идут самопроизвольно лишь в одном направлении. После протекания данных процессов, сопровождающихся изменениями в системе и окружающей среде, невозможно вернуть одновременно и систему и окружающую среду в исходное состояние.
Обратимыми являются процессы, после которых систему и окружающую среду можно вернуть в исходное состояние.
Второй закон термодинамики имеет несколько формулировок, в варианте, предложенном Клаузиусом, он выглядит следующим образом: невозможен самопроизвольный переход теплоты от холодного тела к горячему.
Физический смысл второго закона термодинамики заключается в том, что любой самопроизвольный процесс протекает в направлении, при котором система из менее вероятного состояния переходит в более вероятное состояние. Другими словами, самопроизвольному протеканию процесса способствует увеличение неупорядоченности в системе.
Для характеристики меры неупорядоченности используется термодинамическая функция – энтропия S, которая связана с термодинамической вероятностью системы формулой Больцмана:
где k – постоянная Больцмана.
Под термодинамической вероятностью W понимают число равновероятных микроскопических состояний, которыми может быть реализовано данное макроскопическое состояние системы. Для определения термодинамической вероятности системы необходимо найти число различных вариантов положений всех частиц системы в пространстве.
Энтропия является количественной мерой беспорядка в системе. Чем больше W, тем хаотичнее система, тем больше величина энтропии. Нагревание вещества приводит к увеличению энтропии, а охлаждение – к уменьшению. При приближении к абсолютному нулю (-273ºС) энтропия стремится к нулю, что позволяет определить абсолютные значения энтропии различных веществ, значения которых при стандартных условиях представлены в таблицах. Следует отметить, что в отличие от энтальпии образования, энтропия простого вещества, даже находящегося в кристаллическом состоянии, не равна нулю, т.к. при температуре, отличающейся от абсолютного нуля, макросостояние кристалла может быть реализовано не единственным макросостоянием, а большим числом равновероятных состояний.
Другая формулировка второго закона термодинамики выглядит так: полная энтропия всегда увеличивается в самопроизвольном процессе.
Увеличение энтропии ΔS при протекании процесса должно превышать или быть равным отношению количества теплоты Q, переданного системе, к температуре Т, при которой теплота передаётся:
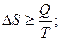
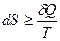
Уравнение (26) является математической записью второго начала термодинамики. В данном уравнении знак неравенства относится к необратимым самопроизвольным процессам, а знак равенства – к обратимым процессам.
Согласно уравнению (26), изменение энтропии при обратимом переходе системы из состояния 1 в состояние 2 можно определить как:
ΔS = S2 – S1 = 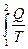
Фазовые переходысопровождаются тепловым эффектом, называемым теплотой фазового перехода ΔНф.п., и являются изотермическими процессами (Тф.п.= const). Для фазового перехода одного моля вещества изменение энтропии равно:
ΔSф.п.= 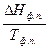
В процессах плавления, испарения жидкости или сублимации вещества энтропия увеличивается, так как разрушается упорядоченная кристаллическая решётка. Обратные процессы: кристаллизации, конденсации, десублимации сопровождаются уменьшением неупорядоченности в системе, и следовательно, уменьшением энтропии.
При изменении температурывещества от Т1 до Т2 при постоянном давлении изменение энтропии определяется по формуле:
ΔS = 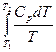
поскольку Ср = const, то
ΔS = Ср· ln 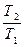
Для изохорных процессов
ΔS = 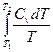
ΔS = Сv· ln 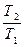
Стандартной энтропией ΔS 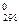
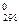
ΔS 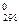
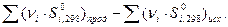
Наиболее хаотичной формой вещества является газообразное состояние, поэтому если в результате химической реакции число молей газа увеличивается, то хаотичность, а следовательно, и энтропия системы возрастает.
Обычно определяют не абсолютн6ое значение энтропии, а её изменение (S2 – S1) в том или ином процессе. Для вычисления изменения энтропии при переходе одного моля идеального газа из одного состояния в другое используют формулы:
S2 – S1 = R 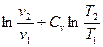
S2 – S1 = R 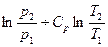
где Ср и Сv – постоянные величины. Изменение энтропии при нагревании единицы массы вещества, находящегося в твёрдом или жидком состоянии, рассчитывают по формуле:
S2 – S1 = 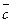
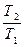
где 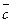
При переходе вещества из одного агрегатного состояния в другое изменение энтропии определяется по формуле:
S2 – S1 = 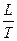
где L – скрытая теплота обратимого фазового перехода (испарения, плавления и др.); Т – температура фазового перехода.
http://zaochnik.com/spravochnik/fizika/termodinamika/neobratimost-teplovyh-protsessov/
http://helpiks.org/1-41140.html