Надо придумать уравнение1) Ме + не Ме — > ; соль , 3 уравнения придумать надо2) МеО + не Ме О — > ; соль , 3 уравнения придумать3) Ме (ОН)n + Н кисл ост?
Химия | 5 — 9 классы
Надо придумать уравнение
1) Ме + не Ме — > ; соль , 3 уравнения придумать надо
2) МеО + не Ме О — > ; соль , 3 уравнения придумать
3) Ме (ОН)n + Н кисл ост.
— > ; соль + Н2О , 3 уравнения придумать
2) CaO + CO2 = CaCO3
MgO + SO3 = MgSO4
K2O + SiO2 = K2SiO3
3) NaOH + HCl = NaCl + H2O
2KOH + H2SO4 = K2SO4 + 2H2O
NaOH + HNO3 = NaNO3 + H2O.
Пожалуйста, придумайте 15 солей по химии?
Пожалуйста, придумайте 15 солей по химии!
С многоосновными кислотами аммиак образует не только средние, н и кислые соли?
С многоосновными кислотами аммиак образует не только средние, н и кислые соли.
Напишите формулы кислых солей, которые он может дать при взаимодействии с фосфорной кислотой .
Назовите их и напишите уравнения диссоциации этих солей.
Составить уравнение реакции метановой кислоты с : Ме МеО МеОН соль?
Составить уравнение реакции метановой кислоты с : Ме МеО МеОН соль.
Уравнение реакции получения возможных солей (их названия) при взаимодействии гидроксида кальция и ортофосфорной кислоты?
Уравнение реакции получения возможных солей (их названия) при взаимодействии гидроксида кальция и ортофосфорной кислоты.
Уравнения реакции с помощью которых кислые и основные соли можно перевести в средние.
Помогите пожалуйста * о * /К образованию каких солей приводит неполная нейтрализация кислотно — основныхвзаимодействий?
Помогите пожалуйста * о * /
К образованию каких солей приводит неполная нейтрализация кислотно — основных
Объясните с составлением уравнений реакции образования
кислых и основных солей.
Можно ли из уксусной кислоты получить кислую соль?
Можно ли из уксусной кислоты получить кислую соль?
Если можно, то уравнение реакции написать.
Придумайте 3 ионных уравнения, и подтвердите?
Придумайте 3 ионных уравнения, и подтвердите.
Fe(OH)3 + HCl = Уравнение для кислых солей?
Fe(OH)3 + HCl = Уравнение для кислых солей.
Придумайте любое химическое уравнение и уровнять его?
Придумайте любое химическое уравнение и уровнять его.
Напишите уравнения реакций, с помощью которых можно перевести : а) кислую соль Ba(HSO4)2 в нормальнуюсоль BaSO4 ; б) основную соль Fe(OH)Cl в нормальную соль FeCl2?
Напишите уравнения реакций, с помощью которых можно перевести : а) кислую соль Ba(HSO4)2 в нормальную
соль BaSO4 ; б) основную соль Fe(OH)Cl в нормальную соль FeCl2.
Если вам необходимо получить ответ на вопрос Надо придумать уравнение1) Ме + не Ме — > ; соль , 3 уравнения придумать надо2) МеО + не Ме О — > ; соль , 3 уравнения придумать3) Ме (ОН)n + Н кисл ост?, относящийся к уровню подготовки учащихся 5 — 9 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
Ме не ме о уравнение
Вопрос по химии:
Надо придумать уравнение
1) Ме + не Ме -> соль , 3 уравнения придумать надо
2) МеО + не Ме О -> соль , 3 уравнения придумать
3) Ме (ОН)n + Н кисл ост. -> соль + Н2О , 3 уравнения придумать
ПОМОГИТЕ ПОЖАЛУЙСТА
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
1) Fe + S = FeS
Zn + Cl2 = ZnCl2
2K + Br2 = 2KBr
2) CaO + CO2 = CaCO3
MgO + SO3 = MgSO4
K2O + SiO2 = K2SiO3
3) NaOH + HCl = NaCl + H2O
2KOH + H2SO4 = K2SO4 + 2H2O
NaOH + HNO3 = NaNO3 + H2O
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Химические свойства Ме
Электрохимические процессы.
Химические свойства металлов.
Механизм возникновения электродного потенциала
В узлах металлической кристаллической решетки располагаются положительно заряженные ионы, находящиеся в равновесии со свободными электронами. При погружении металла (Ме) в раствор полярные молекулы воды притягиваются к положительно заряженному катиону Ме. В результате этого катион Ме может оторваться от кристаллической решетки и перейти в раствор в виде гидратированного иона. При этом на поверхности Ме скапливаются избыточные электроны. Это процесс можно выразить уравнением:
Me + mH2O ↔ Me n+ · m H2O + nē,
где n – число электронов, принимающих участие в процессе.
Гидратированные катионы Ме, находящиеся в растворе, притягиваются к отрицательно заряженной поверхности Ме, поскольку на нем появляется избыток электронов, в результате чего образуются два слоя с противоположными зарядами — двойной электрический слой, характеризующийся определенным скачком потенциала — электродным потенциалом.
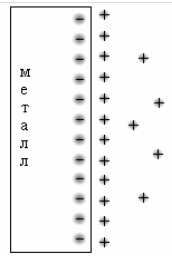
Рисунок 1 – Схема двойного электрического слоя (а);
распределение заряда в объеме электролита (б)
Электродному потенциалу приписывают тот знак, который имеет поверхность Ме.
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
Уравнение Нернста
Электродный потенциал каждого электрода зависит от природы Ме, концентрации (активности) ионов в растворе и температуры. Эта зависимость определяется по уравнению Нернста:
Е Ме n + / Ме 0 = Е 0 Ме n + / Ме 0 + 
где Е Ме n + / Ме 0 — электродный потенциал;
Е 0 Ме n + / Ме 0 – стандартный электродный потенциал;
R – газовая постоянная (8,31 Дж/моль*К);
Т – температура (298 K);
F – число Фарадея (96496 Кл/моль);
n – число электронов, участвующих в электронной реакции;
а – активная концентрация ионов металла в растворе.
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T , а также заменив активность на молярную концентрацию, получим удобную для расчетов форму уравнения Нернста:
Е Ме n + / Ме 0 = Е 0 Ме n + / Ме 0 +
Значения стандартных электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях.
Стандартный водородный электрод состоит из стеклянного сосуда, заполненного 2Н (двунормальным) раствором H2SO4, в котором активность ионов Н + равна единице 1 (1 моль/л). В этот раствор погружен электрод из платины, покрытый мелкодисперсной платиновой чернью для увеличения поверхности. При использовании водородного электрода через раствор H2SO4 пропускают химически чистый газообразный водород под давлением 100 кПа при T = 298 K.
Поскольку потенциал стандартного водородного электрода равен нулю, то измеренное напряжение будет представлять собою потенциал данного электродного процесса.
Таким образом, стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор, в котором концентрация (или активность) собственных ионов равна 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 298 К условно принимается равным нулю. Стандартный потенциал обозначают буквой j ° (или Е ° ) с указанием электрода, который записывают следующим образом: сначала потенциал – определяющие ионы, находящиеся в растворе, а затем материал электрода, например стандартный электродный потенциал цинка Е 
В зависимости от значения стандартного электродного потенциала все Ме можно расположить в ряд стандартных электродных потенциалов (ряд активности). Чем меньше потенциал металла, тем активнее этот металл и выше его восстановительная способность.
Химические свойства Ме
(взаимодействие со сложными веществами)
1) Взаимодействие с водой (окислитель Н + ). При обычных условиях щелочные и щелочноземельные металлы вытесняют водород из воды, образуя при этом растворимое основание. Остальные металлы, расположенные в ряду активности от магния до водорода, на поверхности имеют защитную оксидную пленку, которая практически не растворяется в воде и предохраняет металл от взаимодействия.
Например: Ca 0 + 2H + 20 = Ca +2 (OH)2 + H2 0 ↑
2) Взаимодействие с разбавленными кислотами (искл. разб. азотная кислота) (окислитель Н + ). В этих кислотах растворяются Ме, стоящие в ряду активности до водорода.
Однако проявляется пассивация свинца (возникает из-за того, что образующийся в начале реакции хлорид свинца ( II ) трудно растворим в воде и, оставаясь на поверхности Ме, защищает его от доступа новых порций кислоты):
3) Взаимодействие с разбавленной азотной кислотой
восстанавливается до следующих продуктов:
Активные Ме ( Li — Al ) N 2,
очень разб. NH 3 , NH 4 NO 3
Ме средней активности ( Al -Н2)
Малоактивные (Н2— Au ) NO
4) Взаимодействие с концентрированной азотной кислотой
восстанавливается до следующих продуктов:
Активные Ме (Li-Al) N 2 O
Ме средней активности (Al-Н2)
Малоактивные (Н2-Au) NO 2
не реагирует с Al, Cr, Fe, Au, Pt, Ir (пассивация Ме)
5) Взаимодействие с концентрированной серной кислотой
восстанавливается до следующих продуктов:
Активные ( Li — Al ) H 2 S
Средней активности ( Al -Н2) S
Малоактивные (Н2— Au ) SO 2
не реагирует с Al, Cr, Fe, Au, Pt (пассивация Ме)
6) Взаимодействие со щелочами
Некоторые металлы (Be, Al, Zn, Sn, Pb, Cr), которым соответствуют амфотерные оксиды и гидроксиды, взаимодействуют с растворами щелочей:
http://online-otvet.ru/himia/5b74982bf0470558d275151b
http://megaobuchalka.ru/15/27660.html









