Медный купорос ГОСТ 19347-99
| Медный купорос | |
|---|---|
| Систематическое наименование | медный купорос |
| Традиционные названия | пентагидрат: сульфат меди (II), медь сернокислая техническая |
| Хим. формула | CuSO 4 |
| Состояние | кристаллическое |
| Молярная масса | 159,609 (сульфат) 249.685 (пентагидрат) г/моль |
| Плотность | 3,64 г/см³ |
| Твёрдость | 2,5 |
| Т. разл. | выше 650 °C |
| pKa | 5⋅10 −3 |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | безв. — ромбическая пентагидрат — триклинная пинакоидальная тригидрат — моноклинная |
| ГОСТ | ГОСТ 19347-99 |
| Рег. номер CAS | 7758-98-7 |
| PubChem | 24462 |
| Рег. номер EINECS | 231-847-6 |
| SMILES | |
| Кодекс Алиментариус | E519 |
| RTECS | GL8800000 |
| ChEBI | 23414 |
| ChemSpider | 22870 |
| ПДК | в воздухе: мр 0,009, сс 0,004; в воде: 0,001 |
| ЛД50 | крысы, орально: 612,9 мг/кг мыши, орально: 87 мг/кг |
| Токсичность | |
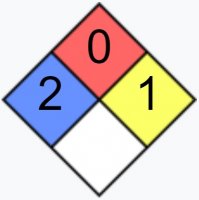
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Медный купорос (медь сернокислая, сульфат меди (II) ) — неорганическое соединение, медная соль серной кислоты с формулой CuSO 4. Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего с горьковато-металлическим вяжущим вкусом, на воздухе постепенно выветриваются (теряют кристаллизационную воду).
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется голубой пентагидрат CuSO4·5H2O — медный купорос. Токсичность медного купороса для теплокровных животных относительно невысока, в то же время, он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Реакция гидратации безводного сульфата меди (II) экзотермическая и проходит со значительным выделением тепла.
Содержание
- 1 Нахождение в природе
- 2 Получение
- 2.1 В промышленности
- 2.2 В лабораторных условиях
- 2.3 Очистка
- 2.3.1 Глубокая очистка
- 3 Физические свойства
- 3.1 Строение кристаллогидрата
- 3.2 Термическое воздействие
- 3.3 Растворимость
- 4 Химические свойства
- 4.1 Электролитическая диссоциация
- 4.2 Реакция замещения
- 4.3 Реакция с растворимыми основаниями (щелочами)
- 4.4 Сокращённое ионное уравнение (Правило Бертолле)
- 4.5 Реакция обмена с другими солями
- 4.6 Прочее
- 5 Производство и применение
- 6 Токсикология
Нахождение в природе
В природе встречается в виде минералов халькантита (CuSO4·5H2O), халькокианита (CuSO4), бонаттита (CuSO4·3H2O), бутита (CuSO4·7H2O) и в составе некоторых других минералов.
Получение
В промышленности
В промышленности загрязненный сульфат меди(II) получают растворением меди и медных отходов в разбавленной серной кислоте H2SO4 при продувании воздуха:
растворением оксида меди(II) CuO в H2SO4:
сульфатизирующим обжигом сульфидов меди и как побочный продукт электролитического рафинирования меди.
В лабораторных условиях
В лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см 3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл конц. азотной кислоты. Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности пленки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 перекристаллизовать из дистиллированной воды и высушить.
Очистка
Очистить загрязненный или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространенной примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности пленки кристаллов, после чего охлаждают для кристаллизации.
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ».
Глубокая очистка
Существует более сложный способ очистки, позволяющий получить сульфат меди особой чистоты, с содержанием примесей около 2·10 -4 %.
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная). В него добавляют перекись водорода в количестве 2-3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3-5 грамм, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3%-ного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей. Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов.
Физические свойства
Пентагидрат сульфата меди (II) (медный купорос) — синие прозрачные кристаллы триклинной сингонии. Плотность 2,284 г/см 3 . При температуре 110 °С отщепляется 4 молекулы воды, при 150 °С происходит полное обезвоживание.
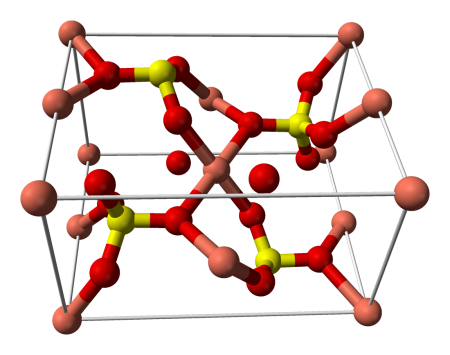
Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Термическое воздействие
При нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
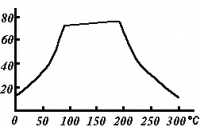
Растворимость
Растворимость сульфата меди (II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80—200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди (II) гидролизуется, (степень гидролиза в 0,01 М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5⋅10 −3 .
Химические свойства
Электролитическая диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) так же, как и все растворимые соли, диссоциирует в одну стадию:
Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов:
Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:
Сокращённое ионное уравнение (Правило Бертолле)
Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu 2+ и SO4 2-
Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Подборка простых опытов с медным купоросом в домашних условиях
В прошлой статье я рассказывала про медный купорос, что это такое, где применяется и даже как некоторые им лечатся (вот только не знаю, вылечиваются ли?), а сегодня предлагаю поделать опыты с медным купоросом в домашних условиях.
Обо всех этих экспериментах я уже рассказывала в рубрике «Похимичим», так что сейчас, по сути, просто собираю их все вместе, так как они раскиданы по разным статьям.
В начале, как обычно предупреждаю о соблюдении правил техники безопасности!
Напоминаю, что практически все опыты (кроме одного) мы будем делать с раствором медного купороса. Чтобы его получить, растворите половину чайной ложки в стакане воды – этого вполне хватит на все сегодняшние эксперименты. Предлагаю начать с самого простого и похимичить гвоздем.
Опыт с медным купоросом и железным гвоздем
Все очень просто – в раствор купороса опускаете чистый (имеется ввиду без ржавчины и масла) железный гвоздь и ждете. Химическая реакция пройдет сама, без вашего дальнейшего участия. Первые результаты будут видны уже через несколько минут. Ну а самым терпеливым советую «забыть» про происходящее на пару недель. Будет очень интересно.
Подробнее читайте вот в этой статье.
Взаимодействие с аммиаком
В светло-голубой раствор капаем немного аммиака. Вуаля! Готов ярко-фиолетовый раствор аммиаката меди. Не забивайте голову названием, просто наслаждайтесь красивым зрелищем.
Взаимодействие с гидроксидом натрия
Добавляем немного гидроксида натрия. Получается красивый голубой осадок гидроксида меди. Не выливайте его, он нам пригодится в следующем опыте.
Красивые превращения глюкозы
Вам понадобится аптечный раствор чистой глюкозы. Приливаем ее к осадку, полученному в предыдущем опыте, и аккуратно нагреваем. Ярко-голубой осадок постепенно превратится сначала в желтый раствор, затем – в красный.
Делать все нужно достаточно внимательно и аккуратно, поэтому посмотрите, как я делала.
Опыты с яйцом
Денатурация (разрушение) белка
Берем сырое яйцо и отделяем белок от желтка. Белок помещаем в стакан, добавляем немного воды,перемешиваем и делим на две части, то есть на два эксперимента. К первой части приливаем немного медного купороса. После перемешивания получаем вот такую невразумительную массу:
Биуретовая реакция
Ко второй части белка добавляем немного гидроксида натрия, а потом – несколько капель купороса. Получаем ярко-фиолетовую окраску раствора.
Подробно об этих реакциях можно прочитать вот здесь.
Взаимодействие с поваренной солью
Разводим в стакане с водой немного обычной поваренной соли и смешиваем с раствором медного купороса. Любуемся изумрудно-зеленой окраской получившегося раствора.
Желающих продолжить этот опыт дальше отсылаю к статье «Цветные реакции». В ней вы найдете много интересного.
Забавный химический фокус
Он потребует от вас некоторых приготовлений (минут на пять), но оно того стоит. Нужна всего лишь старая сковородка и кристаллический (не раствор!) медный купорос. Будем с помощью воды превращать белое вещество в синее. Подробная инструкция здесь.
Морозные узоры на стекле
Хоть сейчас и лето, но вы легко можете создать на стекле самые настоящие морозные узоры.
Выращиваем химический сад
Еще один очень простой опыт. Единственное, что от вас потребуется, это, как и в случае с гвоздем, терпение. Ну и немного обычного канцелярского силикатного клея. Подробности в статье «Химические водоросли».
Непослушная пена
Ну и под занавес, эффектный опыт по получению пены. Его можно делать в двух вариантах – с медным купоросом либо с марганцовкой. По сути, процессы идут одинаковые и результат также практически одинаковый. Правда, придется побегать по аптекам в поисках гидроперита. Если вам улыбнется удача и вы его купите, то внимательно читайте вот эту статью и химичьте в свое удовольствие!
Вот и все на сегодня. Надеюсь, эта подборка домашних опытов с медным купоросом вам пригодится. Может, у вас есть какие-то идеи, что еще можно сделать? Пишите в комментариях, делитесь опытом.
Всем хорошего настроения!
P.S. Я совсем забыла про самый распространенный опыт — выращивание красивых синих кристаллов. Обещаю исправиться и в ближайшее время показать вам его
KidsChemistry теперь есть и в социальных сетях. Присоединяйтесь прямо сейчас! Google+ , В контакте , Одноклассники , Facebook , Twitter
Подробный разбор задач (задание 33 экзамена)
Задача 3. Медный купорос ( CuSO4·5H2O ) массой 12,5 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 5,6 г железа и после завершения реакции еще 117 г 10%-ного раствора сульфида натрия. Определите массовую долю сульфида натрия в конечном растворе.
Источник: Я сдам ЕГЭ. Типовые задания. А.А. Каверина, стр. 210.
Решение:
1. Посчитаем количество веществ сульфата меди (II) в растворе и железа:
M(CuSO4) = 160 г/моль
M(CuSO4·5H2O) = 250 г/моль.
n(CuSO4·5H2O) = 12,5/250 = 0,05 моль
n(CuSO4) =n(CuSO4·5H2O) = 0,05 моль
m(CuSO4 в исходном растворе) = 0,05·160 = 8 г.
n(Fe) = 5,6/56 = 0,1 моль.
2. Запишем уравнение реакции сульфата меди (II) с железом:
| CuSO4 | + | Fe |   → | FeSO4 | + | Cu |
|---|---|---|---|---|---|---|
| Было: | 0,05 моль | 0,1 моль | — | — | ||
| Стало: | — | 0,05 моль | 0,05 моль | 0,05 моль |
3. Рассчитаем исходное количество сульфида натрия:
n(Na2S) = 117·0,1/78 = 0,15 моль
| FeSO4 | + | Na2S |   → | FeS | + | Na 2 SO4 |
|---|---|---|---|---|---|---|
| Было: | 0,05 моль | 0,15 моль | — | — | ||
| Стало: | — | 0,15-0,05 = 0,1 моль | 0,05 моль | 0,05 моль |
Так как сульфат железа (II) в недостатке, в растворе останется 0,1 моль сульфида натрия.
m(Na2S) = 0,1·78 = 7,8 г.
4. Рассчитаем массу итогового раствор:
m(итогового р-ра) = m(исх. р-ра CuSO4) + m(железа, которое перешло в раствор) + m(р-ра Na2S) — m(Cu) — m(FeS)
m(исх. р-ра CuSO4) = 8/0,2 = 40 г.
m(железа, которое перешло в раствор) = 0,05 ·56 = 2,8 г.
m(ра-ра Na2S) = 117 г (по условию)
m(Cu) = 0,05 ·64 = 3,2 г.
m(FeS) = 0,05 ·88 = 4,4 г.
m(итогового р-ра) = 40 + 2,8 + 117 — 3,2 — 4,4 = 152,2 г.
http://kidschemistry.ru/prostye-opyty-s-mednym-kuporosom-v-domashnix-usloviyax.html
http://chemrise.ru/theory/tasks_inorganic11/t23