Медный купорос ГОСТ 19347-99
| Медный купорос | |
|---|---|
| Систематическое наименование | медный купорос |
| Традиционные названия | пентагидрат: сульфат меди (II), медь сернокислая техническая |
| Хим. формула | CuSO 4 |
| Состояние | кристаллическое |
| Молярная масса | 159,609 (сульфат) 249.685 (пентагидрат) г/моль |
| Плотность | 3,64 г/см³ |
| Твёрдость | 2,5 |
| Т. разл. | выше 650 °C |
| pKa | 5⋅10 −3 |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | безв. — ромбическая пентагидрат — триклинная пинакоидальная тригидрат — моноклинная |
| ГОСТ | ГОСТ 19347-99 |
| Рег. номер CAS | 7758-98-7 |
| PubChem | 24462 |
| Рег. номер EINECS | 231-847-6 |
| SMILES | |
| Кодекс Алиментариус | E519 |
| RTECS | GL8800000 |
| ChEBI | 23414 |
| ChemSpider | 22870 |
| ПДК | в воздухе: мр 0,009, сс 0,004; в воде: 0,001 |
| ЛД50 | крысы, орально: 612,9 мг/кг мыши, орально: 87 мг/кг |
| Токсичность | |
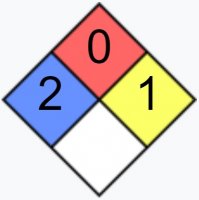
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Медный купорос (медь сернокислая, сульфат меди (II) ) — неорганическое соединение, медная соль серной кислоты с формулой CuSO 4. Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего с горьковато-металлическим вяжущим вкусом, на воздухе постепенно выветриваются (теряют кристаллизационную воду).
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется голубой пентагидрат CuSO4·5H2O — медный купорос. Токсичность медного купороса для теплокровных животных относительно невысока, в то же время, он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Реакция гидратации безводного сульфата меди (II) экзотермическая и проходит со значительным выделением тепла.
Содержание
- 1 Нахождение в природе
- 2 Получение
- 2.1 В промышленности
- 2.2 В лабораторных условиях
- 2.3 Очистка
- 2.3.1 Глубокая очистка
- 3 Физические свойства
- 3.1 Строение кристаллогидрата
- 3.2 Термическое воздействие
- 3.3 Растворимость
- 4 Химические свойства
- 4.1 Электролитическая диссоциация
- 4.2 Реакция замещения
- 4.3 Реакция с растворимыми основаниями (щелочами)
- 4.4 Сокращённое ионное уравнение (Правило Бертолле)
- 4.5 Реакция обмена с другими солями
- 4.6 Прочее
- 5 Производство и применение
- 6 Токсикология
Нахождение в природе
В природе встречается в виде минералов халькантита (CuSO4·5H2O), халькокианита (CuSO4), бонаттита (CuSO4·3H2O), бутита (CuSO4·7H2O) и в составе некоторых других минералов.
Получение
В промышленности
В промышленности загрязненный сульфат меди(II) получают растворением меди и медных отходов в разбавленной серной кислоте H2SO4 при продувании воздуха:
растворением оксида меди(II) CuO в H2SO4:
сульфатизирующим обжигом сульфидов меди и как побочный продукт электролитического рафинирования меди.
В лабораторных условиях
В лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см 3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл конц. азотной кислоты. Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности пленки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 перекристаллизовать из дистиллированной воды и высушить.
Очистка
Очистить загрязненный или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространенной примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности пленки кристаллов, после чего охлаждают для кристаллизации.
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ».
Глубокая очистка
Существует более сложный способ очистки, позволяющий получить сульфат меди особой чистоты, с содержанием примесей около 2·10 -4 %.
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная). В него добавляют перекись водорода в количестве 2-3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3-5 грамм, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3%-ного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей. Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов.
Физические свойства
Пентагидрат сульфата меди (II) (медный купорос) — синие прозрачные кристаллы триклинной сингонии. Плотность 2,284 г/см 3 . При температуре 110 °С отщепляется 4 молекулы воды, при 150 °С происходит полное обезвоживание.
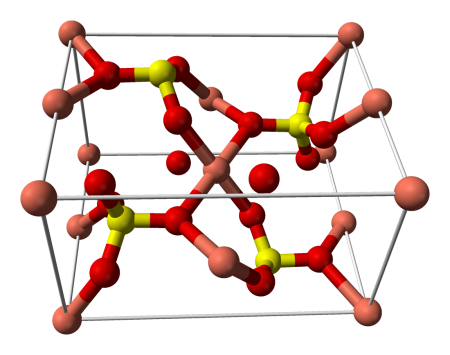
Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Термическое воздействие
При нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
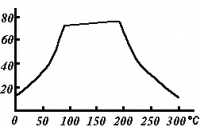
Растворимость
Растворимость сульфата меди (II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80—200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди (II) гидролизуется, (степень гидролиза в 0,01 М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5⋅10 −3 .
Химические свойства
Электролитическая диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) так же, как и все растворимые соли, диссоциирует в одну стадию:
Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов:
Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:
Сокращённое ионное уравнение (Правило Бертолле)
Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu 2+ и SO4 2-
Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Подробный разбор задач (задание 33 экзамена)
Задача 3. Медный купорос ( CuSO4·5H2O ) массой 12,5 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 5,6 г железа и после завершения реакции еще 117 г 10%-ного раствора сульфида натрия. Определите массовую долю сульфида натрия в конечном растворе.
Источник: Я сдам ЕГЭ. Типовые задания. А.А. Каверина, стр. 210.
Решение:
1. Посчитаем количество веществ сульфата меди (II) в растворе и железа:
M(CuSO4) = 160 г/моль
M(CuSO4·5H2O) = 250 г/моль.
n(CuSO4·5H2O) = 12,5/250 = 0,05 моль
n(CuSO4) =n(CuSO4·5H2O) = 0,05 моль
m(CuSO4 в исходном растворе) = 0,05·160 = 8 г.
n(Fe) = 5,6/56 = 0,1 моль.
2. Запишем уравнение реакции сульфата меди (II) с железом:
| CuSO4 | + | Fe |   → | FeSO4 | + | Cu |
|---|---|---|---|---|---|---|
| Было: | 0,05 моль | 0,1 моль | — | — | ||
| Стало: | — | 0,05 моль | 0,05 моль | 0,05 моль |
3. Рассчитаем исходное количество сульфида натрия:
n(Na2S) = 117·0,1/78 = 0,15 моль
| FeSO4 | + | Na2S |   → | FeS | + | Na 2 SO4 |
|---|---|---|---|---|---|---|
| Было: | 0,05 моль | 0,15 моль | — | — | ||
| Стало: | — | 0,15-0,05 = 0,1 моль | 0,05 моль | 0,05 моль |
Так как сульфат железа (II) в недостатке, в растворе останется 0,1 моль сульфида натрия.
m(Na2S) = 0,1·78 = 7,8 г.
4. Рассчитаем массу итогового раствор:
m(итогового р-ра) = m(исх. р-ра CuSO4) + m(железа, которое перешло в раствор) + m(р-ра Na2S) — m(Cu) — m(FeS)
m(исх. р-ра CuSO4) = 8/0,2 = 40 г.
m(железа, которое перешло в раствор) = 0,05 ·56 = 2,8 г.
m(ра-ра Na2S) = 117 г (по условию)
m(Cu) = 0,05 ·64 = 3,2 г.
m(FeS) = 0,05 ·88 = 4,4 г.
m(итогового р-ра) = 40 + 2,8 + 117 — 3,2 — 4,4 = 152,2 г.
Свойства и применение медного купороса
Это химическое вещество пользуется популярностью у садоводов, которые заботятся о состоянии растений на дачном участке. Совсем необязательно знать его формулу, важно, что регулярное опрыскивание деревьев весной, обработка кустарников осенью помогает спасти урожай от заболеваний и вредителей. Как правильно приготовить раствор, какие еще есть области применения этого вещества, представляет ли оно опасность – ответы на вопросы полезны не только садоводам.
Что такое медный купорос
Медь сернокислая пятиводная – это название имеет неорганическое химическое соединение. Если соблюдать дозировку, оно обладает полезными свойствами, при больших количествах способно провести к смерти. Состав характеризуется токсичностью, относится к 4 классу опасности ядовитых веществ:
при попадании порошка внутрь раздражает слизистые оболочки;
Химическое соединение – порошок голубого цвета или прозрачные ярко-синие триклидные кристаллы, содержащее в составе 24% меди. Препарат обладает физическими свойствами:
Формула
Что такое сульфат меди? Это вещество, получаемое в промышленных условиях как результат химической реакции. Оно обладает очень высокой гигроскопичностью, при поглощении жидкости образует кристаллы – пентагидрат сульфата меди. Другое название соединения – медный купорос или медная соль серной кислоты. Состав имеет химическую формулу CuSO4 5H2O. В ней наблюдается связь одной молекулы соли с пятью молекулами воды.
Свойства
Если сернокислую медь использовать правильно, то будут только положительные эффекты от применения. При этом она безопасна, не накапливается организмом, растениями и почвой, не дает побочных эффектов. Полезные свойства соединения:
Для чего нужен
Благодаря своим химическим свойствам медь сернокислая находит огромное применение во многих областях. Ее используют как пищевую добавку при выращивании сельскохозяйственных животных, для дезинфекции при содержании скота. Состав применяется:
для очистки водоемов, бассейнов;
Состав широко используется в промышленности:
горнодобывающей – при получении кобальта, цинка, свинца;
Применение медного купороса в садоводстве
Особой популярностью пользуется купорос в сельском хозяйстве и в огородах. Он находит применение в различных качествах. Химическое вещество используется:
для борьбы с фитофторозом на томатах и картофеле;
Весной
Как обрабатывать медным купоросом растения на садовом участке? Применение химического вещества имеет особенности, зависящие от времени года. В весеннее время:
до распускания почек обрабатывают растения от плодовой гнили готовым раствором с концентрацией 1% – яблони, груши, айву;
Чтобы получить ранние всходов огурцов, семена замачивают на 10 часов в теплом 0,2% составе. К весенним работам относится дезинфекция корней саженцев. Их выдерживают 3 минуты в составе с насыщенностью 1%, затем тщательно промывают водой. Для протравливания от болезней семян выдерживают 15 минут в специальной смеси, затем хорошо промывают. Для приготовления раствора в 10 литрах теплой воды растворяют:
2 г борной кислоты;
Летом
При появлении на участке вредителей или признаков заболеваний, производят обработку винограда, опрыскивания роз, листьев растений и кустарников. С возникновением летом признаков фитофтороза на картофеле, томатах применяют фунгициды. Для приготовления состава:
налить 10 литров воды;
Осенью
При окончании огородного сезона проводят обработку растений, деревьев и приствольных кругов от вредителей и заболеваний. Для лечения грибка в осеннее время рекомендуют применять крепкий раствор бордоской жидкости. Чтобы его приготовить, необходимо:
взять 10 литров воды;
Применение медного купороса в медицине
Хотя врачи официальной медицины настороженно относятся к применению этого вещества для лечения заболеваний, народные целители практикуют использование и показывают положительные результаты. Они отмечают, что полезные свойства медной соли серной кислоты способствуют выздоровлению при наличии:
Антисептик
Применение раствора рекомендуется при гинекологических заболеваниях, вследствие антисептических, прижигающих, противоинфекционных свойств. Можно ли спринцеваться медным купоросом? Лучше перед проведением процедуры посоветоваться с гинекологом. После его разрешения важно соблюдать все пропорции, чтобы не получить побочных эффектов, опасных для жизни.
Для спринцевания сначала делают маточный раствор – разводят в литре кипятка столовую ложку чистых кристаллов сульфата меди, приобретенных в аптеке. Состав необходимо отфильтровать. Для приготовления рабочего раствора потребуется:
взять 0,5 литра теплой кипяченой воды;
Для прижиганий
Опытные дерматологи отмечают эффект от использования пентагидрата сульфата меди при лечении мокрой экземы. Для этого необходимо приготовить синюю мазь. При ее регулярном нанесении происходит прижигание болезненных язвочек. Через два дня они из синих становятся коричневыми и отваливаются. Для изготовления состава потребуется:
измельчить голубые кристаллы пентагидрата сульфата меди;
При отравлении
Долгие годы существовала практика применения медного купороса при появлении признаков отравлении в качестве средства, вызывающего рвоту. Поскольку даже небольшое нарушение концентрации раствора может вызвать серьезные проблемы со здоровьем, современные медики отказались от такого метода лечения. Однако Всемирная организация здравоохранения в своей анатомической терапевтической системе классификации считает это вещество антидотом.
Лечение медным купоросом в народной медицине
Народные целители применяют слабый раствор для дезинфекции ран. Мазь, сделанная на основе медной соли серной кислоты, избавляет от грибка ногтей. Смесь доводится до кипения, охлажденной наноситься на поверхность до устранения симптомов. Для приготовления требуется смешать равные части:
порошка сернокислой меди;
Для эффективного лечения рака кишечника, желудка, молочной железы, рекомендуют по утрам принимать внутрь по 50 мл раствора. Для приготовления нужно настоять в течение суток щепотку вещества с половиной литра воды. Лечебными свойствами при диабете отличаются ванны, снижающие потребность в инсулине, если их принимать трижды за неделю. Процедуру проводят до 15 раз. Для ее проведения:
наполнить ванну водой;
Применение медного купороса в строительстве
Благодаря огнеупорным, фунгицидным свойствам водный раствор сульфата меди с концентрацией 10% используется при выполнении строительных работ. Препарат наносится на деревянные, бетонные, кирпичные поверхности. Состав медного купороса способствует:
антисептической защите деталей из дерева от гниения;
Вред медного купороса
Необходимо соблюдать осторожность при использовании химического средства в домашних и огородных условиях. Во время работы с купоросом рядом не должны находиться дети и животные, требуется соблюдение инструкции по технике безопасности. При попадании вещества в организм необходимо срочное обращение к врачу. Промывание желудка может усугубить положение. Если препарат попал внутрь:
при вдыхании – происходит ожог слизистой легких;
Особую опасность для жизни представляет попадание сульфата меди в кровь. Как результат токсического действия происходит:
разрушение мембраны эритроцитов;
Видео
http://chemrise.ru/theory/tasks_inorganic11/t23
http://sovets.net/13276-mednyj-kuporos.html