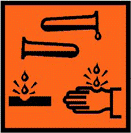
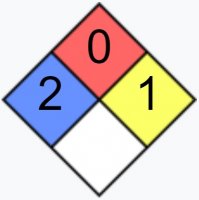
Медный купорос ГОСТ 19347-99
| Медный купорос | |
|---|---|
| Систематическое наименование | медный купорос |
| Традиционные названия | пентагидрат: сульфат меди (II), медь сернокислая техническая |
| Хим. формула | CuSO 4 |
| Состояние | кристаллическое |
| Молярная масса | 159,609 (сульфат) 249.685 (пентагидрат) г/моль |
| Плотность | 3,64 г/см³ |
| Твёрдость | 2,5 |
| Т. разл. | выше 650 °C |
| pKa | 5⋅10 −3 |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | безв. — ромбическая пентагидрат — триклинная пинакоидальная тригидрат — моноклинная |
| ГОСТ | ГОСТ 19347-99 |
| Рег. номер CAS | 7758-98-7 |
| PubChem | 24462 |
| Рег. номер EINECS | 231-847-6 |
| SMILES | |
| Кодекс Алиментариус | E519 |
| RTECS | GL8800000 |
| ChEBI | 23414 |
| ChemSpider | 22870 |
| ПДК | в воздухе: мр 0,009, сс 0,004; в воде: 0,001 |
| ЛД50 | крысы, орально: 612,9 мг/кг мыши, орально: 87 мг/кг |
| Токсичность | |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Медный купорос (медь сернокислая, сульфат меди (II) ) — неорганическое соединение, медная соль серной кислоты с формулой CuSO 4. Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего с горьковато-металлическим вяжущим вкусом, на воздухе постепенно выветриваются (теряют кристаллизационную воду).
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется голубой пентагидрат CuSO4·5H2O — медный купорос. Токсичность медного купороса для теплокровных животных относительно невысока, в то же время, он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Реакция гидратации безводного сульфата меди (II) экзотермическая и проходит со значительным выделением тепла.
Содержание
- 1 Нахождение в природе
- 2 Получение
- 2.1 В промышленности
- 2.2 В лабораторных условиях
- 2.3 Очистка
- 2.3.1 Глубокая очистка
- 3 Физические свойства
- 3.1 Строение кристаллогидрата
- 3.2 Термическое воздействие
- 3.3 Растворимость
- 4 Химические свойства
- 4.1 Электролитическая диссоциация
- 4.2 Реакция замещения
- 4.3 Реакция с растворимыми основаниями (щелочами)
- 4.4 Сокращённое ионное уравнение (Правило Бертолле)
- 4.5 Реакция обмена с другими солями
- 4.6 Прочее
- 5 Производство и применение
- 6 Токсикология
Нахождение в природе
В природе встречается в виде минералов халькантита (CuSO4·5H2O), халькокианита (CuSO4), бонаттита (CuSO4·3H2O), бутита (CuSO4·7H2O) и в составе некоторых других минералов.
Получение
В промышленности
В промышленности загрязненный сульфат меди(II) получают растворением меди и медных отходов в разбавленной серной кислоте H2SO4 при продувании воздуха:
растворением оксида меди(II) CuO в H2SO4:
сульфатизирующим обжигом сульфидов меди и как побочный продукт электролитического рафинирования меди.
В лабораторных условиях
В лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см 3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл конц. азотной кислоты. Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности пленки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 перекристаллизовать из дистиллированной воды и высушить.
Очистка
Очистить загрязненный или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространенной примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности пленки кристаллов, после чего охлаждают для кристаллизации.
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ».
Глубокая очистка
Существует более сложный способ очистки, позволяющий получить сульфат меди особой чистоты, с содержанием примесей около 2·10 -4 %.
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная). В него добавляют перекись водорода в количестве 2-3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3-5 грамм, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3%-ного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей. Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов.
Физические свойства
Пентагидрат сульфата меди (II) (медный купорос) — синие прозрачные кристаллы триклинной сингонии. Плотность 2,284 г/см 3 . При температуре 110 °С отщепляется 4 молекулы воды, при 150 °С происходит полное обезвоживание.
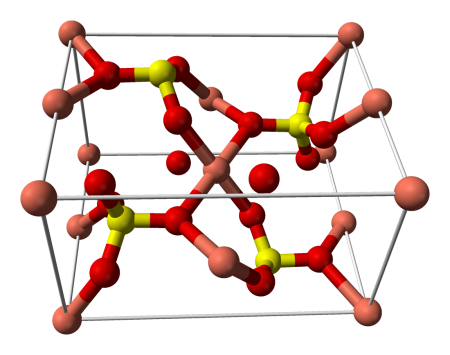
Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Термическое воздействие
При нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
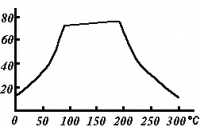
Растворимость
Растворимость сульфата меди (II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80—200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди (II) гидролизуется, (степень гидролиза в 0,01 М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5⋅10 −3 .
Химические свойства
Электролитическая диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) так же, как и все растворимые соли, диссоциирует в одну стадию:
Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов:
Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:
Сокращённое ионное уравнение (Правило Бертолле)
Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu 2+ и SO4 2-
Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Медный купорос вода уравнение реакции

Кристаллогидраты – вещества, в состав которых входит кристаллизационная вода. Например, медный купорос CuSO 4 •5 H 2 O ‑ пятиводный сульфат меди. Медный купорос – голубого цвета. При нагревании большинство кристаллогидратов теряют кристаллизационную воду, превращаясь в безводные вещества. При этом часто происходит изменение цвета веществ. Измельчим купорос и прокалим его. Медный купорос постепенно теряет воду, превращаясь в белый порошок сульфата меди.
При добавлении воды происходит обратный процесс: безводный белый сульфат меди превращается в кристаллогидрат –голубой медный купорос.
Вновь образовался кристаллогидрат ‑ пятиводный сульфат меди.
Оборудование: спиртовка, фарфоровая чашка, ступка фарфоровая, шпатель, штатив, стеклянная палочка, химический стакан, вода, пипетка.
Техника безопасности . Следует соблюдать правила работы с нагревательными приборами. Не допускать попадания солей меди на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Медный купорос: описание, применение, польза и вред, инструкция
Медный купорос – это вещество, принадлежащее к классу неорганических. Оно представляет собой медную соль серной кислоты. Другое название – сульфат меди. Особенной популярностью медный купорос пользуется у владельцев как огромных полей, так и совсем маленьких огородов – применяют вещество практически все дачники и садоводы. Медный купорос традиционно применяют для обработки деревьев весной. Его также применяют для защиты кустарников в осенний период и предотвращения появления заболеваний.
Визуально медный купорос – это сравнительно небольшие кристаллы с голубоватым или синеватым оттенком. Вещество нелетучее, запах у него полностью отсутствует. Для вещества характерен горький вкус с металлическим оттенком.
В природе медный купорос можно встретить в составе некоторых минералов. На крупных предприятиях его производят посредством воздействия серы на основной компонент.
Данное вещество легко растворяется в обычной воде, особенно легко кристаллы купороса таят в подогретой жидкости. При попадании в воду вещество выделяет тепло, а при длительном пребывании на открытом воздухе соединение теряет все свои свойства, а его цвет меняется из голубого на белый или серый.
Что такое медный купорос
Медный купорос – это неорганическое соединение, представленное голубыми кристаллами, которое достигло наибольшей популярности в сельскохозяйственной сфере: его используют для защиты плодовых деревьев и различных кустарников, для обработки почвы с целью предотвращения развития различных заболеваний и для защиты от грибка. Стоит отметить, что данное соединение не вызывает привыкания у вредителей и бактерий, поэтому его эффективность со временем не снижается.
Сульфат меди во всемирной классификации значится под индексом Е519. Получают данное соединение исключительно синтетическим способом. Добавку, помимо обработки растений, применяют также в качестве консерванта. В малых дозах она безопасна для человеческого организма. Впрочем, начиная с 2010 года применение сульфата меди в качестве пищевой добавки на территории Российской Федерации запрещено: специалисты утверждали, что несмотря на общее мнение о безопасности медного купороса, он способен вызывать мутации в организме и оказывать на него токсическое воздействие.
Визуально сульфат меди представляет собой однородный порошок с легким синеватым оттенком. В безводной среде вещество выглядит как белый порошок.
Кристаллы медного купороса
Формула медного купороса и его свойства
Формула медного купороса:
Основные сведения о медном купоросе:
- Молярная масса – 160 г/моль.
- Плотность – 3,64 г/см 3 .
- Твердость кристаллов – 2,5.
- Цвет – синий или голубоватый, в определенных условиях может быть белым или сероватым.
- Внешняя форма – крупные кристаллы или гранулы.
- Запах – отсутствует.
- Растворимость – кристаллы медного купороса легко таят в воде, метаноле и серной кислоте.
- Вкус – горький, с металлическим послевкусием.
- Температура, при которой вещество начинает разлагаться – 650 градусов.
При нагревании медного купороса до 110 градусов, отщепляется 4 молекулы воды, а при повышении показателя температуры до 150 градусов и вовсе теряет всю жидкость, содержащуюся в его составе.
В процессе нагревания медный купорос отщепляет две молекулы воды и преобразуется в тригидрат, затем в моногидрат, а при нагревании до отметки в 258 градусов – в безводную соль. Разложение вещества происходит при повышении температуры до отметки 650 градусов. По завершении реакции разложения образуются оксиды меди и серы и выделяется кислород.
Медный купорос прекрасно растворяется в воде, причем его способность к растворению возрастает при нагревании жидкости. При гидролизации вещество дает кислую среду.
При взаимодействии с щелочными металлами купорос образует комплексные соли.
При добавлении вещества в пламя, оно меняет свой цвет из красно-оранжевого в зеленый.
Кроме того, сульфату меди присущи следующие свойства:
- вяжущее – вещество способно регулировать консистенцию;
- антибактериальное – медный купорос устраняет бактерии, защищая тем самым растения от развития заболеваний;
- прижигающее;
- обеззараживающее;
- фунгицидное – сульфат меди борется с грибками и различными видами плесени;
- ускоряет синтез фитогормонов у растений.
Молекула медного купороса
Получение медного купороса
В современном мире известны разные методы получения медного купороса. Так, например, наибольшей популярностью пользуются следующие способы:
- растворение разного рода отходов, основу которых составляет меть, в слабой серной кислоте с параллельным обдувом воздушными массами;
- растворение оксида меди в высококонцентрированной серной кислоте (в данном случае обдув воздухом не требуется);
- обжиг меди;
- электролитическое воздействие на чистую медь – при данном методе вместе с медным купоросом выделяются и другие, побочные продукты.
Реакции с медным купоросом и соединения на его основе
Характерной для сульфата меди является реакция электрической диссоциации, в ходе которой медный копорос образует два вещества – медь и оксид серы:
Реакция замещения медного купороса возможна исключительно в водных растворах, в которых присутствуют металлы, чья активность превышает активность меди – то есть, металлов, которые располагаются в электрохимическом ряду левее купрума. Рассмотрим реакцию замещения с цинком:
Сульфат меди с легкостью вступает в реакции со щелочами с выделением гидроксида меди, представленного осадком насыщенного голубого или синего цвета:
Медный купорос вступает в обменные реакции с солями:
Взаимодействие сульфата меди с аммиаком:
Допустимые нормы приема медного купороса
Употреблять медный купорос в пищу не рекомендуется – отечественные специалисты заявляют о его токсичности и способности вызывать мутации в организме. Максимально допустимой дозировкой вещества для взрослого здорового человека считается 2,5 грамма. При превышении этого показателя велик риск ухудшения самочувствия.
Сферы применения медного купороса
Сульфат меди крайне часто применяют как исходное сырье для получения длинного перечня соединений.
Безводный вариант вещества применяют для определения уровня влажности. Кроме того, с его участием осуществляется осушка этанола и некоторых других соединений.
Большая часть от всего производимого в мире купороса уходит на борьбу с вредителями в сельскохозяйственной сфере. На основе сульфата меди готовят специальные растворы, защищающие растения от появления плесени, от грибка, от отрицательного воздействия насекомых и бактерий.
В сфере строительства раствор медного купороса необходим для устранения последствий протечек разного рода жидкостей, а также удаления въевшейся ржавчины и следов соли на кирпичных и каменных стенах. Раствором пропитывают деревянные конструкции, дабы защитить их от гнилостных процессов, от грибка и плесени.
Встретить медный купорос можно в перечне ингредиентов некоторых красящих средств.
В медицине раствор медного купороса применяется как один из компонентов электролитических ванн. В фармакологии его используют как ингредиент для приготовления лекарственных смесей.
В производстве продуктов питания медный купорос применяют в качестве вещества, продлевающего срок хранения различной продукции, добавка известна под индексом Е519. Однако применение медного купороса в сфере производства продуктов питания строго ограничено, а в некоторых странах (например, в России) и вовсе запрещено.
Также медный купорос применяется для обработки водоемов и бассейнов – там его действие аналогично тому, какое он оказывает в сельскохозяйственной сфере: соединение препятствует образованию бактерий.
Раствор медного купороса
Сульфат меди можно встретить и в горнодобывающей промышленности – он применяется при получении различных цветных металлов. В металлургии медный купорос применяют в гальванических ваннах для производства медных катодов.
Медный купорос применяется на производстве зеркал и стекол, полотен и красок для них.
Медный купорос в садоводстве
Наибольшей популярностью, как уже было сказано выше, раствор медного купороса пользуется в сельскохозяйственной сфере, где он применяется для:
- борьбы с фитофторозом (заболеванием, причиной которого является воздействие грибоподобных микроорганизмов, поражающих томаты и картофельные клубни – в результате они начинают гнить, покрываются плесенью;
- защиты растений от воздействия на них вредителей. Причем медный купорос не вызывает привыкания – со временем эффект от его применения не становится менее заметным;
- обеззараживания земли;
- как удобрение в случае нехватки меди в почве – такая проблема наиболее характерна для известковых грунтов;
- удобрения как садовых, так и комнатных, горшковых растений;
- профилактики грибковых заболеваний у кустарников и деревьев.
Краткие выводы о применении медного купороса в различных сферах:
| Сфера применения | Назначение медного купороса |
| Тяжелая промышленность | Гальванические процессы |
| Пищевая промышленность | Консервант |
| Химическая промышленность | Сырье для получения различных соединений, анализ металлов |
| Строительство | Защита деревянных конструкций, удаление ржавчины и солевого налета со стен |
| Производство лакокрасочных материалов | Компонент красок, регулирующих их консистенцию |
| Медицина | Антисептик, прижигающее средство, раствор, улучшающий состояние больного при тяжелых отравлениях |
| Животноводство | Пищевая добавка |
| Сельское хозяйство | Обработка почвы с целью защиты растений от различных заболеваний |
| Обработка водоемов и растений | Предотвращение негативного воздействия бактерий на качество воды |
Влияние медного купороса на организм человека
При взаимодействии с раствором на основе сульфата меди необходимо строго следовать правилам, позволяющим обеспечить безопасность работников. Так, крайне важным является строгое соблюдение рекомендуемых дозировок.
В избыточных количествах рассматриваемое соединение опасно для человека: особенно агрессивное воздействие оно оказывает на кожу и слизистые оболочки, вызывая раздражение, покраснение и сыпь. При регулярном контакте с медным купоросом велик риск разрушения мембранного слоя у эритроцитов, возникновения проблем с бронхами, легкими и органами пищеварительной системы.
Опасным считается медный купорос в количестве 11 мк на 1 килограмм веса.
С точки зрения токсичности рассматриваемое соединение принадлежит ко 2 классу опасности – это высокоопасные вещества. Они оказывают негативное воздействие на состояние здоровья человека и животных.
Фармакологическое действие медного купороса
Медный купорос способен оказывать антисептическое воздействие, и, вместе с этим, вызывать рвотные реакции. В определенных условиях вещество способно нейтрализовать фосфор и выводить его из организма.
В небольших количествах медный купорос стимулирует выработку гемоглобина, поэтому препараты, включающие его в свой состав, часто назначают пациентам, страдающим анемией.
Польза медного купороса
Наибольшую пользу сульфат меди несет не людям, а растениям – медный купорос помогает предотвратить развитие длинного перечня заболеваний у различных растений. Благодаря медному купоросу можно защитить от грибка и вирусных болезней.
Для человека медный купорос способен нести пользу только в составе лекарственных препаратов.
Вред медного купороса
Специалисты, проводившие исследования в разных странах и в разное время, установили токсичное воздействие медного купороса на здоровье человека. Так, сульфат меди обладает способностью скапливаться в организме, оказывая негативное воздействие на состояние печени и почек.
Особенно сильное негативное воздействие можно получить при случайном проглатывании вещества. Степень вреда определяется возрастом человека, его весом и состоянием здоровья.
Специалисты называют следующие симптомы отравления медным купоросом:
- сильная рвота;
- диарея и вздутие в области живота;
- поражение слизистых оболочек;
- судороги;
- ускорение сердечного ритма.
В случае отравления необходимо срочно промыть желудок.
Инструкция по применению медного купороса
Садоводство
Чтобы приготовить раствор медного купороса для обработки растений, потребуется горячая вода и, собственно, сам медный купорос. Его объем зависит от того, с каким конкретно растением вы имеете дело.
Традиционно применяют 1% раствор медного купороса, норма расхода которого составляет 10 литров на 100 м 2 . Объем раствора, который необходим для обработки, зависит от того, с каким конкретно растением вы имеете дело.
Существуют следующие правила разведения медного купороса для получения раствора для обработки:
- яблоня груша и айва – 100 г порошка на 10 л воды, расход – от 2 до 5 литров на одно дерево;
- абрикос, персик, слива и вишня – 50-60 г порошка на 10 литров воды, расход – от 2 до 3 литров на дерево;
- крыжовник и смородина – 50-60 г порошка на 10 л воды, а один куст потребуется приблизительно 1,5 литра;
- картофель – 2 г препарата на 10 л воды.
Сульфат меди разводят в воде до полного растворения кристаллов. В теплое время года и весной рекомендуется применение 1%-го раствора купороса, для более взрослых растений лучше использовать более концентрированный препарат.
Весеннюю обработку осуществляют в начале марта (еще до образования и набухания почек), когда температура задерживается на отметке от 5 до 6 градусов. Повторную обработку проводят в начале осени.
Важно ограничить доступ детям и животным к местам обработки растений.
Долго хранить готовый раствор не рекомендуется – со временем он теряет свои свойства.
Работать с раствором купороса разрешается исключительно в защитных перчатках, не допуская его попадания в кожу и глаза.
Медный купорос для бассейна, дозировка на куб
Для обеззараживания воды в бассейне используется пропорция 0,9 грамм медного купороса на 1 куб (1000 литров). Часто в воду для бассейна вместе с купоросом добавляют соль, это дополнительный антисептик для воды. Пропорция – 3:1, т.е. три части соли и 1 часть купороса.
Такие пропорции воды и медного купороса считаются безопасными для бассейна. Что будет при попадании раствора медного купороса внутрь описано выше, это канцерогенное вещество и чем больше его попадет внутрь, тем выше вероятность отравления и летального исхода. Поэтому дезинфицируя воду для бассейна не превышайте установленные пропорции.
Фармакология
Для лечения разного рода заболеваний также применяют раствор медного купороса:
| Концентрация раствора сульфата меди | Назначение |
| 0,1 % | Отравление фосфором – раствор применяют для промывки желудка и выведения следов фосфора |
| 0,25 % | Конъюнктивит – раствор применяют в виде глазных капель, для одного глаза используют от 2 до 3 капель препарата |
| 0,25 – 1,0 % | Уретрит и вагинит |
| 0,5 – 1,0 % | Витилиго – препарат принимают вовнутрь, во время еды. Используют от 5 до 15 капель лекарства трижды в день |
| 1 % | Рвотное средство – рекомендуется применение 15 мл раствора внутрь каждые 10 минут до возникновения рвотных позывов |
| 5,0 % | Ожоги от фосфора – ватные диски пропитывают лекарственным раствором, затем делают примочки для пораженных участков кожи |
Медный купорос как пищевая добавка: его класс опасности и особенности хранения
Медный купорос в пищевой промышленности известен под индексом Е519. Он принадлежит к классу стабилизаторов, регулирующих консистенцию пищевых продуктов.
В наши дни медный купорос запрещается применять в производстве продуктов питания в следующих странах: Норвегии, Англии, России и странах ЕС. Но существуют государства, которые его применяют в пищевой промышленности, к ним относятся Япония и Украина.
Медный купорос принадлежит к 2 классу опасности – то есть, высокоопасным соединениям. Вещество обладает свойством накапливаться в организме человека, вызывая нарушение работы печени и почек.
Хранить сульфат меди рекомендуется в многослойных бумажных или полипропиленовых мешках, обладающих дополнительной полиэтиленовой вставкой. На полки специализированных магазинов медный купорос поступает в пластиковых банках или флаконах, реже его можно встретить в плотных полиэтиленовых пакетах.
Где можно приобрести медный купорос и сколько он стоит
Приобрести медный купорос можно в специализированных хозяйственных магазинах или в интернете.
100 граммов медного купороса будет стоить вам примерно 60-70 рублей.
Заключение
Медный купорос – это соединение, принадлежащее к классу неорганических веществ. Наибольшей популярностью оно пользуется в сфере садоводства: сульфат меди необходим для обработки плодовых растений и деревьев – он предотвращает развитие заболеваний, причиной которых является воздействие бактерий и микроорганизмов, защищает от грибка.
В пищевой промышленности применение вещества ограничено из-за его способности оказывать сильный вред на здоровье человека. В России и большинстве стран Евросоюза применение медного купороса как пищевой добавки запрещено. При попадании в организм сульфат меди вызывает сильное отравление, поражает кожный покров, вызывает нарушение работы органов пищеварительной системы.
http://files.school-collection.edu.ru/dlrstore/920a7d84-4901-c6ab-ccad-c4cb0bf329c3/index.htm
http://chtoikak.ru/mednyj-kuporos.html