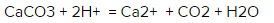Практическая работа 6. Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов.
Получение оксида углерода (IV) и изучение его свойств.
1) Поместите в пробирку несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты. Пробирку быстро за кройте пробкой с газоотводной трубкой. Коней трубки поместите в другую пробирку, в которой находится 2-3 мл известковой воды. Несколько минут пропускайте выделяющийся газ через известковую воду.
Что происходит, если на мел (мрамор) действуют соляной кислотой?
Почему при пропускании образующегося газа через раствор известковой воды сначала происходит помутнение, а затем взвесь растворяется?
2) Конец газоотводной трубки выньте из раствора и сполосните в дистиллированной воде. Поместите трубку в пробирку с 2-3 мл дистиллированной воды и пропустите через неё выделяющийся газ. Через не сколько минут выньте трубку из раствора и добавьте к нему несколько капель синего лакмуса. Что наблюдаете?
3) В пробирку налейте 2-3 мл разбавленного раствора гидроксида натрия, добавьте к нему несколько капель фенолфталеина и затем через раствор пропустите выделяющийся газ. Что наблюдаете?
Напишите уравнения всех проведённых реакций в молекулярном, ионном и сокращённом ионном виде.
Распознавание карбонатов.
В трёх пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия. Определите, какое вещество находится в каждой пробирке.
Сделайте вывод, что является качественной реакцией на карбонат-ионы. Напишите соответствующее уравнение реакции.
Получение оксида углерода (IV) и изучение его свойств.
При взаимодействии мела с соляной кислотой наблюдается выделение газа:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2H + + 2Cl — ⟶ Ca 2+ + 2Cl — + H2O + CO2↑
CaCO3 + 2H + ⟶ Ca 2+ + H2O + CO2↑
При пропускании выделяющегося газа через известковую воду, наблюдается помутнение раствора:
Ca(OH)2 + CO2 ⟶ CaCO3↓ + H2O
Ca 2+ + 2OH — + CO2 ⟶ CaCO3↓ + H2O
При дальнейшем пропускании выделяющегося газа мутный раствор становится прозрачным. Это связано с тем, что нерастворимый карбонат кальция, при взаимодействии с углекислым газом, превращается в растворимый гидрокарбонат кальция:
CaCO3 + H2O + CO2 ⟶ Ca(HCO3)2
CaCO3 + H2O + CO2 ⟶ Ca 2+ + 2HCO3 —
При добавлении лакмуса в дистиллированную воду, через которую пропускали углекислый газ, наблюдается окрашивание в красный цвет. Это объясняется тем, что углекислый газ реагирует с водой с образованием слабой угольной кислоты:
H2O + CO2 ⇄ H2CO3
При добавлении фенолфталеина раствор гидроксида натрия, наблюдается окрашивание раствора в малиновый цвет. При пропускании углекислого газа через этот раствор, происходит его обесцвечивание. Это связано с тем, что гидроксид натрия вступает в реакцию с углекислым газом:
2NaOH + CO2 ⟶ Na2CO3 + H2O
2Na + + 2OH — + CO2 ⟶ 2Na + + CO3 2- + H2O
2OH — + CO2 ⟶ CO3 2- + H2O
Распознавание карбонатов.
В начале добавить соляной кислоты, в пробирке с карбонатом калия выделится газ: K2CO3 + 2HCl ⟶ 2KCl + H2O + CO2↑
В оставшиеся две пробирки добавить хлорид бария, в пробирке с сульфатом натрия образуется осадок белого цвета: Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
В последнюю пробирку добавить гидроксид натрия, если там находится хлорид цинка, то выпадет белый осадок:
ZnCl2 + 2NaOH ⟶ 2NaCl + Zn(OH)2↓
Качественной реакцией на карбонат-ионы, является взаимодействие с кислотой, в результате реакции образовывается углекислый газ.
ГДЗ учебник по химии 8 класс Габриелян. Практическая работа №4 Опыт 2. Номер №2
Взаимодействие мрамора с кислотой.
Положите в небольшой стакан 1 − 2 кусочка мрамора. Прилейте в стакан столько соляной кислоты, чтобы ею покрылись кусочки. Зажгите лучинку и внесите её в стакан. Образовались ли новые вещества при взаимодействии мрамора с кислотой? Какие признаки химических реакций вы наблюдали? Запишите уравнение химической реакции и укажите её тип по признаку числа и состава исходных веществ и продуктов реакции.
Решение
Поместим в химический стакан кусочек мрамора, и нальём в стакан соляной кислоты, ровно столько, чтобы ей покрылся кусочек; наблюдаем выделение пузырьков газа. Произошла химическая реакция, мрамор растворился, выделился углекислый газ $СO_<2>$ .
$CaCO_ <3>+ 2HCl ⟶ CaCl_ <2>+ H_<2>O + CO_<2>$ ↑.
Реакция обмена, при которой также протекает разложение слабой угольной кислоты на углекислый газ и воду ( $H_<2>CO_ <3>= H_<2>O + CO_<2>$ ↑).
Внесём в стакан зажженную лучинку, она погасла, т.к. углексислый газ $СO_2$ не поддерживает горение.
Какое ионное уравнение реакции CaCO3 + 2HCl?
Каким будет ионное уравнение реакции CaCO3 + 2HCl = CaCl2 + CO2 + H20?
Объясните как составить ионное уравнение этой реакции?
Как составить ионное уравнение реакции CaCO3 (карбоната кальция) и 2HCl (хлорной кислоты)?
Тип реакции: кислотно-основный.
В результате реакции карбонат кальция и 2 молекул хлорной кислоты, HCl нейтрализуется с образованием слабой неустойчивой кислоты H2CO3, которая не может оставаться в таком виде, потому распадается на углекислый газ CO2 и воду H2O.
Чтобы составить ионную реакцию, нужно сделать следующее:
- Проанализировать компоненты молекулярной реакции.
- Разложить на ионы газы, жидкости и растворы, а твердые вещества не трогать.
- Убрать с обоих сторон одинаковые ионы, записать конечный вид ионной реакции CaCO3 и 2HCl.
Итак, вот молекулярное уравнение:
Теперь нужно разобрать каждую составляющую этого уравнения, чтобы составить правильное ионное уравнение:
- CaCO3 не растворяется (ведь это обычный мел);
- HCl — кислота, растворяющаяся в воде;
- CaCl2 — хлорид кальция, растворяющийся в воде.
- H20 — это вода, в ионной реакции она не участвует;
- CO2 — газ, в данной ионной реакции он не участвует.
Теперь можно разложить составляющие на ионы (раскладывается только 2HCL и CaCl2):
CaCO3 (твердый элемент) + 2Cl- + 2H+ = Ca2+ + 2Cl- + CO2 + H2O
Что мы имеем? В обеих частях уравнения есть ионы хлора, потому их можно сократить. И вот что мы получаем в итоге:
Если вы любознательны и хотите знать больше, читайте также вопросы:
http://reshalka.com/uchebniki/8-klass/chemistry/gabrielyan/300
http://vovet.ru/q/kakoe-ionnoe-uravnenie-reakczii-caco3-2hcl-dt2.html