Метод Мора: основы, реакции, процедура, использование
Метод Мора: основы, реакции, процедура, использование — Наука
Содержание:
В Метод Мора Это вариант аргентометрии, которая, в свою очередь, является одной из многих областей волюметрии, используемых для определения содержания хлорид-ионов в пробах воды. Концентрация Cl – указывает на качество воды, влияющее на ее органолептические свойства, такие как вкус и запах.
Этот метод, изобретенный в 1856 году немецким химиком Карлом Фридрихом Мором (106-1879), продолжает действовать благодаря своей простоте и практичности. Однако одним из его основных недостатков является то, что он основан на использовании хромата калия, K2CrO4, соль, вредная для здоровья, когда загрязняет воду.
Концентрация ионов Cl определяется объемным методом. – через степени или оценки. В них конечная точка, указывающая на то, что точка эквивалентности была достигнута. Это не изменение цвета, как мы видим в кислотно-щелочном индикаторе; но образование красноватого осадка Ag2CrO4 (верхнее изображение).
Когда появляется этот красноватый или кирпичный цвет, титрование завершается и после серии вычислений определяется концентрация хлоридов, присутствующих в пробе воды.
Основы
Хлорид серебра AgCl — это осадок молочного цвета, который образует только ионы Ag. + и Cl – они в растворе. Имея это в виду, можно подумать, что добавление достаточного количества серебра из растворимой соли, например нитрата серебра, AgNO3, до образца с хлоридами мы можем осаждать их все в виде AgCl.
Затем путем взвешивания этого AgCl определяется масса хлоридов, присутствующих в водной пробе.Это соответствовало бы гравиметрическому, а не волюметрическому методу. Однако есть проблема: AgCl — довольно нестабильное и нечистое твердое вещество, поскольку оно разлагается под солнечным светом, а также быстро осаждается, поглощая все примеси, которые его окружают.
Следовательно, AgCl не является твердым веществом, из которого можно получить надежные результаты. Вероятно, в этом причина изобретательности разработки объемного метода определения ионов Cl. – , без необходимости взвешивать какой-либо продукт.
Таким образом, метод Мора предлагает альтернативу: получить осадок хромата серебра Ag2CrO4, который служит конечной точкой титрования или титрования хлоридов. Его успех настолько велик, что он до сих пор используется для анализа хлоридов в пробах воды.
Реакции
Какие реакции происходят в методе Мора? Для начала у нас есть ионы Cl – растворяется в воде, где при добавлении ионов Ag + Сильно смещенное равновесие растворимости начинается с образования осадка AgCl:
Ag + (ас) + Cl – (ас) ⇋ AgCl (т)
С другой стороны, в середине тоже должны быть ионы хромата CrO4 2- , так как без них красноватый осадок Ag2CrO4:
Так что теоретически должен быть конфликт между обоими осадками, AgCl и Ag.2CrO4 (белый против красного соответственно). Однако в воде при 25 ºC AgCl более нерастворим, чем Ag.2CrO4, поэтому первое всегда выпадет в осадок раньше второго.
Фактически, Ag2CrO4 он не будет выпадать в осадок, пока не исчезнут хлориды, с которыми серебро будет образовывать соли; то есть минимально избыточные ионы Ag + больше не осаждается с Cl – но с CrO4 2- . Таким образом, мы увидим появление красноватого осадка, что будет последней точкой оценки.
Процесс
Реагенты и условия
Титрант должен попасть в бюретку, которая в данном случае представляет собой раствор AgNO.3 0,01 М. Поскольку AgNO3 Бюретка чувствительна к свету, после заполнения рекомендуется накрыть бюретку алюминиевой фольгой. А в качестве индикатора раствор K2CrO4 в 5%.
Эта концентрация K2CrO4 гарантирует отсутствие значительного избытка CrO4 2- относительно Cl – ; потому что если это произойдет, сначала выпадет Ag2CrO4 вместо AgCl, хотя последний более нерастворим.
С другой стороны, pH пробы воды должен иметь значение от 7 до 10. Если pH больше 10, гидроксид серебра выпадет в осадок:
Ag + (ас) + ОН – (ac) ⇋ AgOH (s)
Если pH меньше 7, Ag2CrO4 он станет более растворимым, потребуется добавить избыток AgNO3 для получения осадка, изменяющего результат. Это связано с балансом между видами CrO4 2- и CR2ИЛИ7 2- :
Вот почему pH пробы воды необходимо измерить до применения метода Мора.
Оценка
Титрант AgNO3 перед титрованием его необходимо стандартизировать с помощью раствора NaCl.
Как только это будет сделано, 15 мл пробы воды переносят в колбу Эрленмейера, разбавленную 50 мл воды. Это помогает, когда добавляются 5 капель индикатора K2CrO4, желтый цвет хромата не такой интенсивный и не препятствует обнаружению конечной точки.
Титрование начинается с открытия крана бюретки и капания раствора AgNO по капле.3. Видно, что жидкость в колбе станет мутно-желтоватой из-за выпадения в осадок AgCl. Как только появится красноватый цвет, остановите титрование, встряхните колбу и подождите около 15 секунд.
Если осадок Ag2CrO4 повторно растворяется, необходимо добавить другие капли AgNO3. Когда он остается постоянным и неизменным, титрование завершается и отмечается объем, выброшенный из бюретки. По этим объемам, факторам разбавления и стехиометрии определяется концентрация хлоридов в пробе воды.
Приложения
Метод Мора применим к любому типу водных образцов. Он позволяет определять не только хлориды, но и бромиды, Br – , и цианиды, CN – . Следовательно, это один из часто используемых методов оценки качества воды для потребления или для промышленных процессов.
Проблема с этим методом заключается в использовании K2CrO4, соль, которая является высокотоксичной из-за хромата и, следовательно, отрицательно влияет на воду и почвы.
Вот почему мы искали, как изменить метод, чтобы отказаться от этого индикатора. Один из вариантов — заменить его на NaHPO.4 и фенолфталеин, где образуется соль AgHPO4 достаточно изменить pH, чтобы получить надежную конечную точку.
Ссылки
- Дэй Р. и Андервуд А. (1965). Количественная аналитическая химия. (пятое изд.). ПИРСОН Прентис Холл, стр. 277.
- Анхелес Мендес. (22 февраля 2012 г.). Метод Мора. Получено с: quimica.laguia2000.com
- ChemBuddy. (2009). Метод Мора. Получено с: titrations.info
- Даниэле Навильо. (н.д.). Метод Мора. Federica Web Learning. Получено с: federica.unina.it
- Хонг, Т. К., Ким, М. Х., и Чаэ, М. З. (2010). Определение хлористости воды без использования индикатора хромата. Международный журнал аналитической химии, 2010, 602939. doi: 10.1155 / 2010/602939
Устойчивое потребление: для чего это нужно, важность, действия, примеры
Метод Мора
Читайте также:
|
NaI + AgNO 3 → AgI ↓ + NaNO 3 .
Йодид серебра адсорбирует на себе одноименные ионы; появляется ярко-розовая окраска:
В точке эквивалентности коллоидная частица становится электронейтральной , в КТТ начинает адсорбировать Ag + ; идет перезарядка мицеллы, осадок коагулирует, раствор просветляется:
< m ( AgI )∙ n I – ( n – x ) K + > x – ∙ x Ag + + Ind 2– → ( x /2) Ag 2 Ind + < m ( AgI )∙ n I – ( n – x ) K + > x – .
f экв ( NaI )=1, 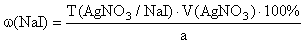
Метод Фольдгарда . Обратная аргентометрия .
Титранты – 1) AgNO 3 , 2) NH 4 SCN ;
Среда – HNO 3 ( pH =3).
К раствору навески препарата прибавляют HNO 3 , точный избыточный объем AgNO 3 и индикатор:
KBr + AgNO 3 → AgBr ↓ + KNO 3 ,
В КТТ индикатор взаимодействует с титрантом :
f экв ( KI )=1, 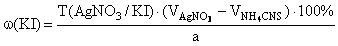
Преимущества пред другими методами:
1. Сильнокислая среда,
2. Не мешают друг ие ио ны;
1. Меньшая точность (обратный метод),
Особенности титрования хлоридов:
1. Низкая скорость титрования [ Ks ( AgCl )> Ks ( AgCNS )],
2. Очень слабое перемешивание,
3. Добавление толуола или бензола для экстракции AgCl .
Особенности титрования йодидов:
После добавления нитрата серебра ждут полного осаждения AgI , второй индикатор добавляют перед самым титрованием:
Метод Кальтгофа – Стенглера . /Только для Br – /
Титранты – 1) AgNO 3 , 2) NH 4 SCN , индикатор – NH 4 Fe ( SO 4 )2, среда – HNO 3 ( pH =3).
К раствору навески препарата прибавляют HNO 3 , индикатор и точный избыточный объем NH 4 SCN (0,1 мл):
Титруют нитратом серебра до исчезновения красного окрашивания:
KBr + AgNO 3 → AgBr ↓ + KNO 3,
f экв ( KBr )=1, 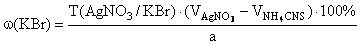
Метод Кальтгофа (Йодкрахмальный). / Для I – в присутствии Cl – и Br – /
Титрант – AgNO 3 , индикатор – крахмал, среда – H 2 SO 4 .
К ратсвору навески препарата прибавляют 1 каплю KIO 3 (0,1 моль/л), раствор крахмала и H 2 SO 4 (1:5) до появления синего окрашивания:
Титруют AgNO 3 (0,1 моль/л) до исчезновения синего окрашивания (после удаления йодида):
f экв ( KI )=1, 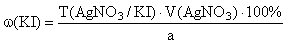
Аргентометрия с внешним индикатором. /Для I – /
Титрант – AgNO 3 , индикатор – нитриткрахмальная бумага, среда – H 2 SO 4 .
К раствору навески препарата добавляют H 2 SO 4 (1:5), титруют AgNO 3 . Вблизи точки эквивалентности после каждого раза прибавления титранта наносят каплю раствора на нитриткрахмальную бумагу. Титрование заканчивают, когда синего окрашивания на бумаге от прибавления раствора не будет:
f экв ( NaI )=1, 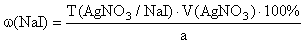
http://lektsii.com/1-6454.html
http://nesterovdmitriy.narod.ru/03-Nauchnaya_Deyat/pharm_chem/o_argentometr.htm


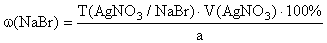 .
.