Методы кислотно-основного титрования. Основное ур-е метода. Рабочие р-ры. Стандартные р-ры. Индикаторы. Расчеты Использование метода
Кислотно-основное титрование — титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации. Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией.
Методы кислотно-основного титрования основаны на использовании реакции между кислотами и основаниями. В зависимости от титранта различают ацедиметрическое и алкалиметрическое титрование. В методе ацедиметрического титрования в качестве титрантов применяют 0,1 или 0,01 н. растворы HCI, H2SO4. В методе алкалиметрического титрования– 0,1 и 0,01 н. растворы NaOH, KOH.
Ацидиметрическое(абочий р-р к-та) титрование применяют для определения сильных и слабых оснований, солей слабых кислот и органических соединений, обладающих основными свойствами.
Алкалиметрическое(рабочий р-р основание) титрование применяют для определения сильных и слабых кислот, кислых солей, солей слабых оснований и органических соединений, обладающих кислыми свойствами (кислоты, фенолы).
1.Сильн осн – сильн к-та
2. Сильн. К-та – сильн осн
3. Слаю к-та – сильн осн
4.Слаб осн – сильн -та
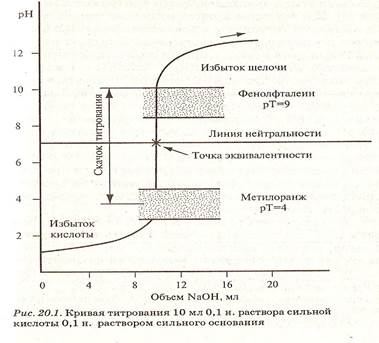
Определение точки эквивалентности в кислотно-основном титровани проводят разными способами: химическими индикаторами и физико-химическими методами – по изменению рН среды, электрической проводимости раствора, изменению оптических свойств раствора и др.
Индикаторы: Метиловый оранжевый: красная→желтая; Метиловый Красный красная→желтая; Фенолфталеин бесцветная→малиновая; Лакмус
Алкалиметрия. Использование метода для анализа веществ.
Если рабочим раствором является раствор основания, то метод называется алкалиметрией.
В алкалиметрии в качестве титрантов применяют растворы сильных оснований, таких как гидроксиды калия, натрия, бария, а также четвертичного аммониевого основания R4NOH. В неорганическом количественном анализе чаще всего используют NaOH и KOH, а в органическом KOH и R4NOH.
Стандартизацию приготовленных растворов оснований проводят по дигидрату щавелевой кислоты H2C2O4 *2H2O, бензойной C6H5COOH ,а также янтарной HOOCCH2-CH2COOH, сульфаминовой H2N-SO3H кислотам , гидрофталату калия HOOC-C6H4-COOK и ряду других веществ.
44. Ацидиметрия.Использование метода для анализа веществ.Рабочим раствором(титрантом)явл.р-р сильной к-ты(HCl,H2SO4,HNO3); (от лат.acidus-кислый). Используется для определения концентрации(содержания):
Б) слабых оснований: NH3+HOH+HCl=NH4CL+H2O
В)образованных щелочами и слабыми кислотами (Na2CO3, K3PO4 и др):
Стандартные р-ры всех указанных кислот приготавл.не по точной навеске, а путем стандартизации ранее приготовл.р-ров приблизительно необходимой концентрации. Стандартизацию к-т проводят по безводному карбонату (Na2CO3); декагидратутетрабората натрия (Na2B4O7*10H2O); иодиту калия (KIO3):
Общая характеристика окислительно-восстановительного титрования. Классификация.
В ОВТ используются реакции, связанные с изменением степени окисления реагируемых веществ, т.е. реакция окисления и восстановления. Все методы в ОВТ основаны на колич. окислении или восстановлении анализируемого вещества. Другое название этих методов – оксидиметрия, редоксиметрия – происходит от названия нач.слогов окисл. и восстан.
Методы в ОВТ классифиц-т в соответствии с примененяемым титрованным раствором. Наиболее распространенные из них:
1. Пермангонатометрия – определение основано на использовании реакций окисления раствором KMnO4
2. Йодометрия — определение основано на использовании растворов I2 или I — ионов.
3. Хроматометрия – определение основано на использовании растворов дихромата или хромата К, а иногда Cr2O3
4. Броматометрия – основано на использовании реакций раствором KBr
Для расчетов в титриметрических методах с использованием ОВР необходимо знать молярные концентрации и массы эквивалента.
Эквивалент в-ва в реакциях окисления-восстановления – условная частица, приходящаяся на один принятый или отданный электрон.
Молярная масса эквивалента вещества – масса одного моля эквивалентов этого в-ва.
В титриметрических методах, основанных на проведении реакции О-В, для обнаружения конечной точки титрования разные приемы:
· Исчезновение или появление окраски титранта или титруемого вещества
· Специфические и окислительно-восстан. индикаторы
Так, при титровании р-ра KMnO4 окончание титрования определяют по появлению розового окрашивания при появлении одной лишней капли избытка титранта.
ОВИндикаторы — в основном органические соединения, способные в окислению или восстановлению. Их окисленная и востановленная формы имеют разные окраски. Индикаторами этого типа являются, например, дифениламин, салициловая к-та и т.д.
Лекция № 14 Методы кислотно – основного титрования (нейтрализации)
Методы кислотно – основного титрования (нейтрализации)
1) Сущьность метода.
2) Индикаторы метода кислотно-основного титрования.
3) Кривые титрования.
4) Расчеты при титровании.
В основе метода кислотно-основного титрования положена реакция взаимодействия ионов водорода или гидроксония с гидроксид-ионами, сопровождаются образованием слабодисоциируемых молекул воды (растворителя).
H++ OH-→ H2O H3O+ + OH-→ 2H2O
Этот метод применяется для количественного определения кислот (H2 SO4 , HNO3 , HCl, H3 PO4 , CH3 COOH, H2C2O4 ) гидроксидов (KOH, NaOH, Ba(OH)2 ) солей, способных гидролизироваться в водных растворах (Na2 CO3 , K2CO3), а также их смесей (смесь NH4Cl, и NaOH).
Кислотно-основное титрования имеет два основных метода: ацидиметрия — определение оснований и алкалиметрия – определение кислот. В качестве рабочих растворов используют чаще всего растворы кислот – HCl и H2 SO4, растворы KOH, NaOH. Поскольку эти кислоты и гидроксиды не могут быть использованы как исходные в-ва для приготовления титрованных растворов, то сначала готовят растворы примерной концентрации, а точный титр и нормальность (м. к.э.) их устанавливают по исходным веществам. чаще всего применяют 0,1 – 0,5 н р-ры.
В качестве исходных в-ва для установления титра растворов кислот используют чаще тетраборат натрия Na2B4O4 и Na2CO3 а для установления титра р-ров щелочей – щавеливую кислоту H2C2O4 * 2H2O или янтарную H2C4H4O4 . Все эти в-ва весьма удобны для работы и дают хорошие результаты при титровании. Для выяснения сущьности процессов происходит при кислотно-основном титровании, изучим реакцию среды в эквивалентном точке при различных случаях титрования. При данном методе точка эквивалентности может лежать в нейтральной (pH =7) щелочной (pH > 7) и кислой среде (pH 7
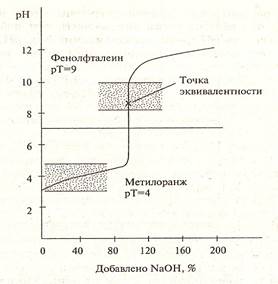
В р-ре избыток OH-. Следовательно при титровании слабых кислот сильными основаниями точка эквивалентности не совпадает с точкой нейтральности и будет находиться в щелочной среде.
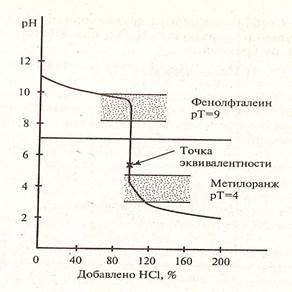
3) Титрование слабого основания сильной кислотой.
NH4OH + HCl → NH4Cl + H2O
NH4OH + H+ → NH4+ + H2O
NH4Cl + HOH → NH4OH + HCl
NH4+ + HOH → NH4OH + H+ pH 10-9 (pH 10-9 (pH>9) ионизируемой форме малиново-красного цвета (образование коллоидной формы). Изменения цвета индикатора происходит не сразу, скачком, а в некотором интервале с изменением pH, который называют интервалом перехода индикатора. Каждый индикатор имеет свой интервал перехода, который зависит от особенности структуры индикатора. Кроме интервала перехода индикаторы характеризуются показателем титрования pT, который равен pH середины перехода, когда 50% молекул индикатора перешло из одной формы в другую и концентрации обеих форм уравнялись:[Ind-]=[HInd]. В этом случае константа равновесия системы HInd/ Ind — также равна pH среды
pK= pH +lg [HInd] /[Ind-] =pH +lg1 =pH ; pK =pK1=pT
Например м/о изменяет окраску от красной до желтой в интервале pH 3,1-4,4 и имеет показатель титрования pT =4,0 т. к. при pH=4 половина его молекул находиться в не ионизируемой, половина в ионизируемой форме.
Задача 1. Вычислить для 0,1135 н HCl титрования раствора и титрования его по CaO.
THCl/CaO -? THCl = CHCl * MЭHCl /1000 = 0,1135*36,5/1000= 0,004138 г/мл
Титр по определяемому в-ву можно вычеслить по формуле:
THCl/CaO = CHCl * MЭCaO /1000 = 0,1135*28,0397/1000= 0,003182 г/мл
Задача 2. Чему равен титр р-ра H2SO4 если для получения 3л этого р-ра взято 25мл H2SO4 ρ=1,515 (61,54%)
V( H2SO4)=3л m(H2SO4)=V* ρ* ω=25*1,515*0,6154=23,3 г
ω(H2SO4)=61,54% T (H2SO4 )= m/V=23,3/3000=0,007769 г/мл
Задача 3. Какому объему точно 0,1 н. р-ра HCl соответствует 21мл 0,1н р-ра. NaOH Поправочный коэффициент равен отношению практически взятой навески и теоретически вычисляемой. K=0,950
Cэ1 =0,1 моль/л Cэ = K Cэ1 =0,95*0,1=0,095 моль/л
V2 =21 мл C1 /C2 =V1 /V2 V1= C1 *C2/V2 =0,095 *21/0,1= 18,95мл (HCl)
Тема лекции: Метод кислотно-основного титрования
1. Теоретические основы метода кислотно-основного титрования. рН.
2. Титранты метода. Индикаторы метода.
3. Кривые титрования.
4. Значение метода в технохимическом контроле продукции пищевых производств и общественного питания.
5. Гидролиз солей.
Метод кислотно-основного титрования (нейтрализации) – метод химического анализа, основанный на применении реакции взаимодействия ионов Н + и ОН — .
Характеристика метода нейтрализации.
| Уравнение реакции | Рабочий раствор (титрант) | Применение метода | Фиксирование точки эквивалентности | Недостатки метода |
| Взаимодействие кислот с основаниями: Н + + ОН — → Н2О | Раствор кислоты или щелочи | Для количественного определения кислот или щелочей (жесткость воды, концентрацию солей слабых кислот – щелочная среда) | Индикаторы (по природе – органические кислоты или основания) | Большая трудность определения точки эквивалентности. |
В зависимости от титранта различают методы:
Ø ацидиметрии (acidum – кислота): в качестве титранта используют 0,01 – 0,1 н. растворы сильных кислот (серная кислота, соляная кислота). Применяют для определения сильных и слабых оснований и некоторых солей слабых кислот (NaOH, NH4OH, Na2CO3, NaHCO3 и т.д.)
Ø алкалиметрии (alkalis – щелочь): в качестве титранта используют 0,01 – 0,1 н. растворы щелочей (NaOH, KOH, Ва(ОН)2). Применяют для определения сильных и слабых кислот и некоторых солей слабых оснований (HCl, H3BO3, CH3COOH и т.д.)
Понятие «водородный показатель» было введено датским химиком Серенсоном в 1909 г. Буква «р» — начальная буква датского слова «потенц» — степень, буква «Н» — символ водорода.
Концентрации ионов Н + и ОН — в воде и любом водном растворе взаимосвязаны. Увеличение концентрации ионов Н + (например, при добавлении кислоты) вызывает уменьшение концентрации ионов ОН — , и наоборот.
Растворы, в которых концентрация ионов водорода равна концентрации гидроксид-ионов, называют нейтральными. Если концентрация ионов водорода больше, то среда в растворе кислотная, если меньше — раствор щелочной, так как концентрация гидроксид-ионов будет больше.
Кислотность растворов обычно выражают через концентрацию ионов водорода Н + . Однако выражать такими числами, как 10 -8 моль/дм 3 или 10 -4 моль/дм 3 , концентрацию ионов водорода неудобно, и в химии применяют водородный показатель рН, который численно равен показателю степени молярной концентрации, взятому с обратным знаком. Например, при молярной концентрации ионов Н + , равной 10 -5 моль/дм 3 , рН равен 5, а при концентрации ионов Н + , равной 10 -8 моль/дм 3 , рН равен 8. Водородный показатель характеризует кислотность или щелочность раствора.
Чем рН меньше 7, тем больше кислотность раствора. Чем рН больше 7, тем больше щелочность раствора. При рН 7 среда раствора нейтральная. Это означает, что молярные концентрации ионов водорода Н + и гидроксид-ионов ОН — равны.
Увеличение кислотности Увеличение щелочности
 |  |
рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Величина рН играет большую роль в промышленности, химических и биологических процессах. Большинство из них может протекать только при определенной кислотности среды. На молочных комбинатах свежесть молока определяется по величине рН. В человеческом организме различные жидкости имеют различную величину рН: желудочный сок – рН 1,7 (сильнокислая среда), кровь – рН 7,4 (слабощелочная среда). Величина рН – показатель состояния здоровья человека.
Выбор титранта для кислотно-основного титрования.
Предпочтительно использовать либо сильные кислоты, либо сильные основания. В качестве индикаторов в методе нейтрализации используют слабые органические кислоты или основания.
Характеристика индикаторов метода нейтрализации:
Ø меняют окраску в зависимости от концентрации водородных ионов в растворе
Ø имеют интервал перехода окраски (значения рН раствора, в пределах которого индикатор меняет свою окраску)
Ø характерен показатель титрования (концентрация ионов водорода, при которой наиболее резко меняется окраска индикатора) – рТ.
Показатель титрования основных индикаторов
 индикатор рТ индикатор рТ | Метиловый оранжевый | Метиловый красный | Лакмус | фенолфталеин |
| рТ |
Требования к индикаторам в методе нейтрализации:
1. резкое отличие в окраске двух форм индикатора в небольшом интервале рН, при добавлении малого количества гидроксид-ионов или протонов Н + ;
2. изменение окраски должно быть обратимо; видимая окраска индикатора наблюдается лишь внутри интервала перехода окраски.
Часто используемые индикаторы.
· Столбец «х» — характер индикатора: к—кислота, о—основание.
| Индикатор | х | Цвет более кислой формы | Интервал перехода pH | Цвет более щелочной формы |
| фенолфталеин | к | бесцветный | 8,2 – 10,0 | Малиново-красный |
| Лакмус (азолитмин) | красный | 5,0 – 8,0 | синий | |
| Метиловый красный | о | красный | 4,2 – 6,2 | Желтый |
| Метиловый оранжевый | о | красный | 3,1 – 4,4 | Оранжево-желтый |
Интервал перехода индикатора не является вполне точной характеристикой. Он зависит от различной интенсивности окраски обоих растворов и от различной восприимчивости глаза к разным цветам. Тем не менее, при выборе индикатора для титрования необходимо знать интервал перехода различных индикаторов. При каждом титровании следует применять определенный индикатор, который позволит свести ошибку титрования к минимуму. Информация о применении основных индикаторов в методе нейтрализации приведена в таблице.
Выбор индикаторов в методе нейтрализации
| Условия титрования | рН в момент эквивалентности | Индикатор |
| сильную кислоту титруют сильным основанием | метиловый оранжевый, метиловый красный, фенолфталеин | |
| сильное основание титруют сильной кислотой | То же | |
| слабую кислоту титруют сильным основанием | больше 7 (слабощелочная) | фенолфталеин |
| Слабое основание титруют сильной кислотой | меньше 7 (слабокислая) | метиловый оранжевый, метиловый красный |
Для правильного выбора индикатора в методе нейтрализации строят кривые титрования.
В методе нейтрализации титрования выражают зависимость изменения рН среды от объема добавленного в процессе титрования титранта.
Кривые титрования — кривые, показывающие изменение концентраций веществ в процессе прохождения химических и электрохимических реакций титрования.
• дают возможность обнаружить, в какой мере та или иная реакция проходит количественно, т.е. можно ли ее использовать для титрования (оценка целесообразности титрования);
• дают возможность установить, за изменениями какой величины лучше всего следить в ходе титрования, как эта величина изменяется и как можно обнаружить конец титрования;
• дают возможность найти точку эквивалентности;
• дают возможность подобрать подходящий индикатор.
На рисунках 1,2,3 представлены примеры различных случаев титрования с характерными кривыми титрования.
Рисунок 1. Кривая титрования раствора сильной кислоты раствором сильного основания
Рисунок 2. Кривая титрования слабой кислоты сильным основанием
Рисунок 3. Кривая титрования слабого основания сильной кислотой
Гидролиз – взаимодействие ионов соли с ионами воды, в результате которого образуется слабый электролит.
Результат гидролиза: изменение среды раствора
1. Соль, образованная сильным основанием и сильной кислотой: не гидролизуется
2. Соль, образованная слабым основанием и сильной кислотой: MgSO4, CuCl2 и т.д.
MgSO4 ↔ Mg 2+ + SO4 2- — гидролиз по катиону (анион сильной кислоты не реагирует с водой)
Mg 2+ + НОН ↔ MgОН + + Н + — кислая среда (рН меньше 7)
MgОН + + НОН ↔ Mg(ОН)2 + Н + — протекает при жестких условиях
3. Соль, образованная сильным основанием и слабой кислотой: Na2CO3, K2SO3 и т.д.
Na2CO3 ↔ 2Na + + CO3 2- — гидролиз по аниону (катион не реагирует)
CO3 2- + НОН ↔ НCO3 — + ОН — — щелочная среда (рН больше 7)
4. Соль, образованная слабым основанием и слабой кислотой: СН3СООNН4, Al2S3 и т.д.
СН3СООNН4 ↔ СН3СОО — + NН4 + — гидролиз по катиону и аниону
СН3СОО — + NН4 + + НОН ↔ СН3СООН + NН4ОН – среда нейтральная (рН = 7)
1. Панкратова Г.В., Жванко Ю.Н., Мамедова З.И. Аналитическая химия и технохимический контроль в общественном питании. – М.: Высшая школа, 1980. – с. 95 – 104/
2. Шапиро С.А., Шапиро М.А. Аналитическая химия. – М.: Высшая школа, 1979. – с. 228 – 241.
http://pandia.ru/text/80/088/10281.php
http://helpiks.org/8-88045.html