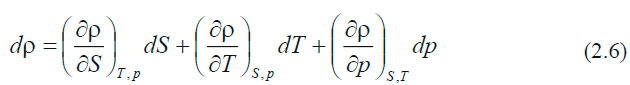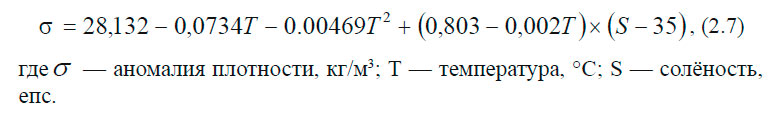Океанология. Часть I. Физические явления и процессы в океане — Безруков Ю.Ф.. Океанология. Часть I. Физические явления и процессы в океане — Б. Министерство науки и образования Украины Таврический национальный университет им. В. И. Вернадского
| Название | Министерство науки и образования Украины Таврический национальный университет им. В. И. Вернадского |
| Анкор | Океанология. Часть I. Физические явления и процессы в океане — Безруков Ю.Ф..doc |
| Дата | 27.05.2017 |
| Размер | 14.3 Mb. |
| Формат файла |  |
| Имя файла | Океанология. Часть I. Физические явления и процессы в океане — Б.doc |
| Тип | Документы #8077 |
| Категория | Геология |
| страница | 7 из 21 |
Подборка по базе: История развития психологии как науки.docx, Национальный исследовательский институт дополнительного образова, Тема 3.6 Применение педагогом дополнительного образования информ, Роль учителя русского языка и литературы в социализации и интегр, ответы по истории философии науки.docx, СР1. Специфика педагогической науки..docx, Процесс развития науки.pdf, Автономная некоммерческая организация высшего образования.docx, МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ.docx, Тавдишвилли_Н_С_История и онтология науки_пз2.docx6. Основные физические характеристики морской воды6.1. Плотность, удельный вес и удельный объем.Уравнение состояния морской водыПлотность является одной из основных характеристик морской воды. Изменения плотности во времени и пространстве определяют распространение звука в воде, горизонтальную и вертикальную циркуляцию вод, перемешивание и устойчивость слоев в Мировом океане. Плотность морской воды, в отличие от пресной, зависит от температуры, солености и давления, т.е. Эта формула в общем виде выражает уравнение состояния морской воды. Связь между плотностью воды и определяющими ее параметрами нелинейна, и простой теоретической формулы для нее еще не получено. Поэтому предложены приближенные уравнения состояния, по которым вычисляется плотность in situ. Основным фактором, влияющим на плотность, является температура, поэтому для океанологических расчетов иногда применяют приближение Буссинеска: где β – коэффициент, выражающий зависимость изменения плотности от изменения температуры (β приводится в Океанологических таблицах), T – температура воды, ρ – плотность в г·см -3 . В настоящее время используется Международное уравнение состояния морской воды, принятое в 1980 г. В этом уравнении плотность (ρ кг·м -3 ) морской воды при давлении в одну стандартную атмосферу (Р = 0)вычисляется по температуре (Т 0 С) и солености (S)согласно следующему уравнению: ρ (Т, S, 0) = ρw + (8.24493·10 -1 – 4.0899·10 -3 Т + 7.6438·10 -5 Т 2 — 8.2467·10 -7 Т -3 + 5.3875 ·10 -9 Т 4 ) S - (5.72466 ·10 -3 – 1.0227·10 -4 Т + 1.6546 ·10 -6 Т 2 S 3/2 + 4.8314 ·10 -4 S 2 ), где ρw – плотность стандартной средней океанской воды, принятой в качестве эталона чистой воды, определяется как: ρw = 999.842594 + 6.793952 ·10 -2 Т – 9.095290 ·10 -3 Т 2 + 1.001685·10 -4 Т 3 –1.120083·10 -6 Т 4 + 6.536332·10 -9 Т 5 . Международное уравнение состояния морской воды при атмосферном давлении действительно в диапазонах солености от 0 до 42‰ и температуры от — 2 до +40 0 С. Имеются и другие уравнения состояния морской воды, предложенные советскими учеными П.С.Линейкиным и О.И.Мамаевым. В физике плотность определяется массой, содержащейся в единице объема, и имеет размерность г·см -3 . Морская вода при Т=20 0 С и S=35‰ имеет физическую плотность ρ = 1.024781 г·см -3 . В океанологии используется специфическое определение плотности. Под плотностью морской воды Хотя численно плотность морской воды В физике удельный вес вещества определяется как вес единицы его объема. Удельный вес морской воды для удобства сравнений и расчетов имеет в океанологии 1. Удельный вес морской воды при температуре 17.5 0 С, отнесенный к удельному весу дистиллированной воды при той же температуре: 2. Удельный вес морской воды при температуре 0 0 C, отнесенный к удельному весу дистиллированной воды при 4 0 С:S Эти определения плотности и удельного веса отличаются от аналогичных физических понятий тем, что являются безразмерными величинами. Так как плотность морской воды больше единицы (среднее значение ρ для океанов равно 1,025 г·см -3 ), а первый десятичный знак всегда нуль, для удобства записи и расчетов по предложению Кнудсена были введены понятия условной плотности и удельного веса: 1) условная плотность морской воды: σt= ( ρ17..5 = ( 3) стандартный условный удельный вес при температуре 0 0 С: σо = (S Например, значению физической плотности ρ=1,024781 г·см -3 соответствует безразмерное значение условной плотности σt= 24,781. Наиболее точным выражением для плотности морской воды являются эмпирические формулы, предложенные группой авторов (Кнудсен, Экман, Свердруп, Хессельберг). Каждая из этих формул устанавливает взаимосвязь плотности с одним или несколькими параметрами, а последовательное их применение позволяет вычислить плотность с учетом всех влияющих факторов. Эти формулы приведены в Океанологических и Океанографических таблицах (Н.Н.Зубов. Океанологические таблицы: — Л.: Гидрометеоиздат, 1957; Океанографические таблицы. — Л.: Гидрометеоиздат, 1975). Достаточно просто условную плотность можно вычислить и по таблицам Калле и Торадэ (K.Kalle und H.Thorade “Tabellen und Tafeln fűr die Dichte des Seewassers (σt)”. – Hamburg, 1940). При некоторых океанологических расчетах удобнее пользоваться не плотностью морской воды, а обратной ей величиной – удельным объемом:
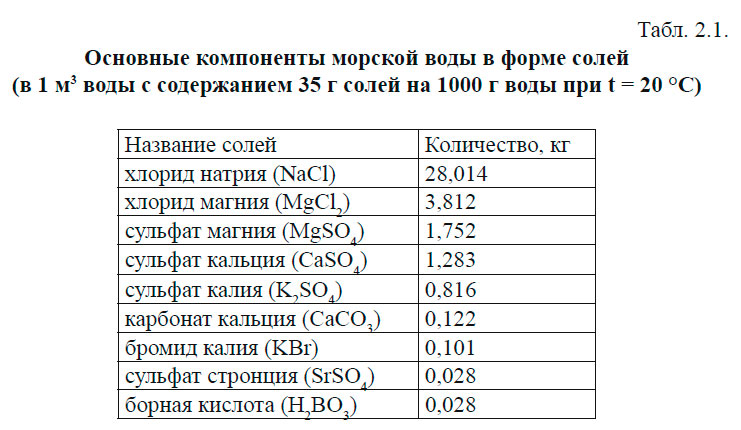
Значения Условный удельный объем Vt представляет собой безразмерную величину. Так, значению Плотности in situ, т. е. при температуре, солености и давлении в точке наблюдения, соответствует удельный объем in situ, который в форме условного удельного объема обозначается Vstp . Океанологические таблицы для вычисления плотности и удельного объема in situ составлены таким образом, что удобнее определить условный удельный объем Vstp.Для этого сначала по соответствующей таблице находят по температуре и солености условный удельный объем Vt на поверхности моря, затем находят ряд поправок, учитывающих влияние отдельно только давления δp, совместно температуры и давления δtp, солености и давления δspи суммарную поправку δstp. В результате Vstp получается как Vtс учетом всех поправок: Это формула Бьеркнеса, которой пользуются при практических расчетах условного удельного объема Vstp. Для нахождения условной плотности и условного удельного объемаудобнее, чем таблицами, пользоваться специальными графиками — T, S-дuаграммами,на которых в поле координат «температура-соленость» проведены изолинии σt или Vt. В природных условиях (in situ) морская вода находится на различных глубинах и подвержена воздействию гидростатического давления вышележащих слоев, которое вызывает сжатие воды и соответствующее уменьшение ее удельного веса (увеличение плотности). Поэтому при определении истинных значений плотности и удельного объема морской воды, которые она имеет на глубине своего залегания, необходимо учитывать ее сжимаемость. 6.2. Давление и сжимаемость морской водыВес столба атмосферного воздуха с единичной площадью определяется как 1 бар (10 5 Па). Величину давления, равную 0,1 бара, называют децибаром, 0,001 бара — миллибаром. Нормальное атмосферное давление на уровне моря составляет 1.013 бар или 1013 мбар. Ниже поверхности моря давление с глубиной быстро растет вследствие высокой плотности воды. Давление воды в океане увеличивается на каждые десять метров глубины примерно на 1 бар. Следовательно, на каждый метр глубины давление увеличивается на один децибар. Это обстоятельство позволяет легко переходить от глубины, выраженной в метрах, к давлению, выраженному в децибарах: 1 метр глубины ≈ 1 дбар давления. Легко видеть, что глубине 1000 м ≈ соответствует давление 1000 дбар. Формальное соответствие глубины в метрах и давления в децибарах широко используется в океанологической практике для замены одной величины на другую. Несмотря на высокое давление в глубинах океана, морская вода сжимается незначительно. Но даже из-за малой сжимаемости, уровень Мирового океана расположен примерно на 30 метров ниже уровня, который он бы занимал при несжимаемости воды. Сжимаемость морской воды влияет на ее физические свойства и на некоторые процессы в океане. Так изменения плотности, связанные со сжимаемостью, существенны для циркуляции вод, распространения скорости звука. Под действием давления вышележащих слоев происходит сжатие морской воды и уменьшение ее удельного объема αна величину k = Коэффииент сжимаемости зависит от температуры, солености, давления и с их увеличением уменьшается. Вместо истинного коэффициента сжимаемости при определении удельного объема α пользуются средним коэффициентом сжимаемости μ: где αо — удельный объем на поверхности моря, P — давление. 6.3. Термические свойства морской водыК ним относятся температура, удельная теплоемкость, теплопроводность, теплота испарения (конденсации) и теплота плавления (льдообразования), температура наибольшей плотности и температура замерзания морской воды, потенциальная температура. Удельная теплоемкость определяется количеством тепла, которое необходимо затратить на нагрев 1 г вещества на 1 0 С. Удельная теплоемкость морской воды зависит от температуры, солености и давления и уменьшается с их увеличением. Различают теплоемкость при постоянном давлении Ср и теплоемкость при постоянном объеме Сv. Для твердых тел и жидкостей более важной физической характеристикой является теплоемкость при постоянном давлении Ср, которая может быть практически измерена. Теплоемкость при постоянном объеме Сvимеет значение при изучении распространение звука в воде. В этом случае она определяется по теплоемкости при постоянном давлении, так как измерить ее непосредственно затруднительно. При расчетах используется отношение γ = Ср/ Сv приблизительно равное 1 для морской воды. Теплоемкость воды выше, чем у большинства веществ (кроме водорода и жидкого аммиака). Воздух и горные породы имеют удельную теплоемкость значительно меньше, чем вода. Высокая теплоемкость воды по сравнению с теплоемкостью атмосферы и суши оказывает огромное влияние на характер тепловых и динамических процессов, протекающих в атмосфере и океане. Она способствует накоплению больших запасов тепла в теплую часть года в океане, которое затем постепенно отдается атмосфере зимой. При охлаждении на 1°С одного объема воды море отдает в атмосферу тепло, которое нагревает на 1°С более 3000 таких же объемов воздуха. Известно, что только верхний 10-метровый слой океана содержит тепла в 4 раза больше, чем вся атмосфера. Даже незначительные изменения температуры этого слоя связаны с мощными потоками тепла в атмосферу. Обладая способностью поглощать и высвобождать большое количество тепловой энергии, вода смягчает резкие колебания климата на Земле, особенно над самим океаном и прибрежными частями материков. Теплопроводностью морской водыназывается количество тепла, переносимое в единицу времени через единичную площадку, расположенную перпендикулярно направлению градиента температуры, равного единице. Она наибольшая среди всех распространенных в природе жидкостей. Теплопроводность морской воды характеризуется коэффициентом молекулярной теплопроводности, который возрастает с увеличением температуры и давления и уменьшением солености. Но перенос тепла за счет молекулярной теплопроводности идет очень медленно, поэтому для Мирового океана основную роль играет турбулентная теплопроводность (передача тепла большими объемами воды при их вихревом движении), коэффициент которой в тысячи раз больше коэффициента молекулярной теплопроводности. Но даже на молекулярном уровне тепло передается через воду примерно в 100 раз быстрее, чем соли. Эта разница в скорости обеспечивает существование уникального механизма перемешивания, называемого двойной диффузией, благодаря которому массы воды в толще океана обмениваются теплом и солями. Удельная теплота испарения (конденсации) морской воды – количество тепла, которое расходуется на превращение 1 г воды в пар при неизменной температуре. Вода не переходит из одного состояния в другое просто так. Каждый переход требует затрат тепловой энергии, а общепринятой единицей для измерения тепловой энергии является калория. Чтобы превратить воду в пар, нужно сообщить ей определенное количество калорий тепла. Чтобы превратить пар в воду, от него нужно отнять столько же калорий. По сравнению с другими веществами вода обладает очень большой теплотой испарения. 1 грамму нагретой до кипения дистиллированной воды нужно сообщить 540 кал, чтобы превратить ее в пар. Это достаточно большая величина – ее хватило бы на то, чтобы повысить температуру чашечки чая на 6 о С. Испарение играет важную роль в теплообмене между океаном и атмосферой и является одним из основных климатообразующих факторов. С поверхности Мирового океана в среднем за год испаряется слой воды толщиной 1.2 м. При этом с поверхности океана вместе с паром передается в атмосферу громадное количество тепла – почти 25% поступающего от Солнца. Перенос пара в атмосфере играет определяющую роль в переносе в полярные районы избытка тепла, образующегося при поглощении солнечной радиации в тропиках. Процесс высвобождения этого скрытого тепла обеспечивает энергию для образования тропических циклонов, тайфунов и ураганов. Удельная теплота плавления (кристаллизации) морской воды — количество тепла, необходимого для плавления 1 г морского льда данной температуры и солености. Теплота плавления как пресного, так и морского льда значительно больше, чем теплота плавления других веществ, за исключением аммиака. 1 г воды при замерзании и превращении в лед должен потерять около 80 кал, и, наоборот, столько же тепла высвобождается при таянии льда. Лед играет важную роль в концентрации тепловой энергии, переносимой вокруг земного шара. Во-первых, ледяной покров изолирует поверхностные воды океана от атмосферы. Вследствие этого океаны получают меньше солнечной радиации, т.к. значительная часть ее отражается ледяной поверхностью, но и меньше тепла уходит из океанов, поскольку океан изолирован льдом от атмосферы. Во-вторых, при образовании морского льда большая часть солей из него переходит в нижележащие слои воды, увеличивая ее плотность, что приводит к погружению воды и формированию новых водных масс. В масштабах всех океанов ежегодно замерзает и тает около 18000 км 3 воды. Тепло, высвобождаемое или поглощаемое в процессе образования и таяния льда, дает существенный вклад в глобальный тепловой баланс Мирового океана. Температура наибольшей плотности и температура замерзания морской воды. П Морские воды в отличие от пресных и солоноватых с понижением температуры всегда увеличивают свою плотность вплоть до замерзания. Эти особенности влекут за собой различия в конвекции, замерзании, тепловом режиме в морских и солоноватых водоемах. При замерзании морской воды происходит выделение соли из образовавшегося льда, из-за чего соленость незамерзшей воды возрастает. Но с увеличением солености понижается температура замерзания. Следовательно, одной из особенностей льдообразования в морской воде будет то, что этот процесс происходит только при непрерывном понижении температуры. В пресной же воде замерзание происходит при неизменной температуре 0 0 С. Вторая особенность льдообразования в морской воде связана с точкой пересечения кривых температуры наибольшей плотности и температуры замерзания. Температура наибольшей плотности воды с соленостью меньше 24.695‰, так же как и пресной воды, лежит выше температуры ее замерзания. Поэтому процесс замерзания развивается в такой воде так же, как в пресной. Осенью начинается общее выхолаживание водоемов. Охлаждается, прежде всего, поверхностный слой, плотность воды которого при этом повышается, и вода с поверхности опускается вниз, а на ее место поднимается более теплая, но менее плотная вода. Благодаря перемешиванию вся толща воды достигает сначала определенной температуры (гомотермии), равной температуре наибольшей плотности. При дальнейшем охлаждении плотность воды поверхностного слоя начинает уменьшаться и перемешивание прекращается. Для образования льда в воде с соленостью меньше 24.695‰ оказывается достаточным ее охлаждение до температуры замерзания сравнительно тонкого поверхностного слоя. Температура наибольшей плотности воды с соленостью большей 24.695‰ лежит ниже температуры ее замерзания. При охлаждении такой воды перемешивание во время замерзания не прекращается. Поэтому для образования льда необходимо охладить значительно больший по толщине поверхностный слой, чем при замерзании пресной и солоноватой воды. Если под действием каких-либо факторов происходит сжатие или расширение объема воды без теплообмена с окружающей средой, то оно сопровождается изменением температуры, которое называется адиабатическим. Опускающийся в глубину некоторый объем воды, попадая в область большого давления, сжимается, что приводит к адиабатическому повышению температуры. При подъеме воды происходит обратное явление. Температура, которую принимает вода, адиабатически охладившись при подъеме с глубины на поверхность, называется потенциальной температурой. Для нахождения потенциальной температуры надо температуру in situ исправить адиабатической поправкой, приводимой в «Океанографических таблицах». Для воды на глубине в несколько тысяч метров различия между температурой in situ и потенциальной температурой составляют несколько десятых долей градуса. Поскольку для изучения процессов в придонных слоях воды океанологам нужно знать температуру до сотых долей градуса, эта разница в температуре имеет решающее значение. Так, если 1 м 3 с поверхности опустить на глубину 5 км, где давление в 500 раз выше атмосферного (5000 дбар), то этот объем уменьшился бы на 2%. Более того, при сжатии температура воды повысилась бы почти на 0,5 о С. Поскольку адиабатические изменения температуры морской воды невелики, для практических целей адиабатические поправки вычисляют на каждые 1000 м. Уплотнение при смешении — увеличение плотности морской воды при смешении слоев, различающихся температурой и соленостью. Уплотнение при смешении обусловлено нелинейностью зависимостью плотности воды от ее температуры и солености, что вызвано перестройкой молекул воды при изменении этих величин. Вследствие нелинейной зависимости плотности от температуры и солености вода может иметь одинаковую плотность при двух различных значениях температуры и солености. Если смешать два объема воды в точках А и Б с одинаковой плотностью σ =27.00, один из которых имеет температуру 3.2 0 С и соленость 33.5‰, другой температуру 6.7 0 С и соленость 34.0‰, то смесь приобретает среднюю температуру 5.0 0 С и соленость 34.8‰, которым в точке С соответствует более высокая плотность σ =27.05 (рис.5). Как видно, плотность, соответствующая точке С, больше, чем в точках А и Б, т. е. наблюдается уплотнение при смешении. В результате смешения двух объемов воды произошло повышение плотности смеси. У 6.4. Диффузия и осмосЧастицы растворенного вещества в слабых растворах, каким является морская вода, отдалены друг от друга на большие расстояния. Находясь в неупорядоченном движении, они устремляются в сторону наименьшего сопротивления среды. Такой средой является либо чистый растворитель, либо вода с меньшей концентрацией солей. Поэтому, когда соприкасаются два раствора различной концентрации, частицы растворенного вещества начинают переходить из раствора с большей концентрацией в раствор с меньшей концентрацией. Переход будет продолжаться до тех пор, пока концентрации обоих растворов не выравняются. Переход частиц из слоя в слой, осуществляемый без помощи механического перемешивания, назвается молекулярной диффузии. Процесс молекулярной диффузии растворенных в воде веществ происходит очень медленно. Его интенсивность определяется соотношением: M = — Если под Sрассматривается соленость, то формула определяет диффузию солей, а если концентрация растворенных в воде газов, то диффузию газов. Молекулярная диффузия не играет существенной роли при изучении реальных процессов в океане, так как коэффициент диффузии очень мал и им обычно пренебрегают. Основным процессом, определяющим перенос солей и газов в океане в горизонтальном и особенно в вертикальном направлении, является турбулентная диффузия. С соленостью морской воды связано физическое свойство — осмос, отсутствующее в дистиллированной воде. Это свойство имеет важное биологическое значение, обеспечивая проникновение в морские организмы необходимых им для питания веществ, растворенных в морской воде. Явление осмоса наблюдается в том случае, когда раствор отделен от растворителя полупроницаемой пленкой, которая пропускает молекулы растворителя, но не пропускает молекулы растворенного вещества. В этом случае молекулы растворителя, стремясь выравнять концентрацию, начинают переходить в раствор, повышая его уровень до положения равновесия. Выравнивание концентраций по обе стороны такой мембраны возможно лишь при односторонней диффузии растворителя. Поэтому выравнивание всегда идёт от чистого растворителя к раствору или от разбавленного раствора к концентрированному. В результате этого создается давление на пленку, называемое осмотическим давлением. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить осмос, т. е. создать условия осмотического равновесия. Величина осмотического давления, создаваемая раствором, зависит от количества, а не от химической природы растворенных в нем веществ. Чем больше концентрация раствора, тем больше создаваемое им осмотическое давление. Это правило носит название закона осмотического давления. Закон осмотического давления используется для расчета молекулярной массы данного вещества. Растворы с одинаковым осмотическим давлением называются изотоническими или изоосмотическими. Если один раствор в сравнении с другим имеет более высокое осмотическое давление, его называют гипертоническим, а имеющий более низкое осмотическое давление — гипотоническим. Осмос имеет важнейшее значение в биологических процессах, его широко используют при определении концентрации растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко минерализованной воды, для опреснения морской воды. Новое уравнение состояния TEOS-10Posted By: admin 3 августа, 2009 Этим летом ЮНЕСКО и Международеная Океанографическая Комиссия приняли новую редакцию уравнения состояния морской воды, названную TEOS-10. Морская вода это сложная динамическая смесь растворённых минералов, солей и органического материала, поэтому определение ее физико химических свойств всегда вызывало определённые трудности. В течении 30 лет использовался набор уравнений, который называется Международное уравнение состояние морской воды — EOS-80 которое изпользует практическую шкалу солёности. При помощи этого уравнения определяли давление, объём и температурные свойства морской воды. Другие динамические характеристики, такие как теплоёмкость, энтальпия и скорость звука получались при помощи других уравнений. Научный кометет Океанических Исследований (SCOR) создал рабочую группу для рассмотрения термодинамических свойств морской воды в 2005 году. Эта команда включала учёных из Leibniz-Institut für Ostseeforschung в Warnemünde (Germany), University of Miami (USA), Desert Research Institute — Nevada System of Higher Education (USA), Bedford Institute of Oceanography (Canada), Commonwealth Scientific and Research Organization (Australia),National Oceanographic Centre (United Kingdom) и Institute of Marine Geology and Chemistry (China). Этот комитет разработал свежий взгляд на термодинамику морской воды. Новое уравнение состояние выведено в форме функции свободной энергии, которая включает все термодинамические свойства морской воды. Новое термодинамическое уравнение состояния придёт на смену широко используемому EOS-80, с новым набором высокоточных формул, которые обеспечат необходимые поправки и пояснения к изначальной формуле. «Предидущее уравнение состояние, которое выражает плотность морской воды как функцию Практической Солёности, температуры и давления, хорошо служило океанографическому сообществу в течении трёх десятилетий,» говорит Dr. Frank Millero, профессор морской и атмосферной химии в University of Miami’s Rosenstiel School of Marine and Atmospheric Science, который является единственным человеком учавствовавшим в разработке и нового и старого уравнения состоянияю «Тем не менее, новое уравнение использует Абсолютную солёность и учитывает много переменных которые раньше не брались в расчёт, а также позволяет получать более точные цифры, что в свою очередь, сделает климатические прогнозы ещё более точными». Сайт на котором собраны ссылки на публикации посвящённые новому уравнению состояния, а также его реализации в кодах на различных языках программирования. Основные химические и физические свойства морской водыСодержаниеСолёностьМировой океан содержит 96,5 % всей воды нашей планеты, и в его воде растворены практически все элементы, встречающиеся на Земле. Их общая масса составляет 48 × 10 18 кг. Достаточно подробно солевой состав морской воды был исследован английским химиком Дитмаром, который имел в своем распоряжении 77 проб воды, собранных в различных частях Мирового океана и с различных глубин во время плавания «Челленджера» в 1872–1876 гг. Было установлено, что 99,9 % всех растворённых веществ приходится на первые 20 элементов таблицы Менделеева. Основные компоненты морской воды представлены в табл. 2.1 в форме солей. В открытых частях Мирового океана процентное отношение основных компонентов солевого состава приблизительно постоянно (закон Дитмара), т. е. соотношения Na/Cl, К/Cl, SO4/Cl и Br/Cl являются константами. Это позволяет определять общую солёность по измерению одного из компонентов. Им является ион хлора Cl- , так как он составляет 55,3 % от общего количества и легко определяется. Определение солёности. Истинная солёность должна быть определена как «отношение массы растворённого твёрдого вещества в морской воде к её массе». Однако это определение не используется, так как невозможно определить точное количество растворённых веществ. При выпаривании воды до сухого остатка требуется длительное нагревание, и на его последней стадии происходит разложение карбонатов и солей магния. Метод, дающий воспроизводимые результаты, был предложен группой исследователей, в которую входили М. Кнудсен, К. Соренсен, С. Форх [2]. Обезвоживание до постоянного веса производилось в среде хлора при температуре 480 °С. При этой процедуре органическая часть разлагается, карбонаты переходят в окислы, а бромистые и йодистые соединения — в хлориды. Применение этого метода привело к следующему условному определению солёности: солёностью считается количество твёрдого вещества в граммах, содержащееся в 1 кг морской воды, когда карбонаты перешли в окислы, бромиды и йодиды заменены их хлористыми эквивалентами и органическая часть окислена. Использовать этот метод на практике для массовых определений солёности невозможно в виду его сложности. В настоящее время для определения солёности используются два метода: метод Мора — Кнудсена и определение солёности по электропроводности воды. Метод Мора — Кнудсена основан на постоянстве солевого состава морской воды. В нем солёность определяется по содержанию иона хлора, которое легко найти осаждением галогенов из пробы морской воды азотнокислым серебром. Солёность обозначается символом S и измеряется в г/кг или промилле ( 0 /00) по формуле: где Cl — хлорозность (масса серебра, потребная для полного осаждения галогенов в 0,3285234 кг морской воды). Попытки определять солёность по электропроводности предпринимались ещё в 1930-е гг. Однако многочисленные технические трудности удалось преодолеть только к 1970-м гг. Были созданы приборы (солемеры), позволяющие измерять электропроводность не только в лаборатории, но и in Situ (на месте в воде), что в настоящее время широко используется в практике экспедиционных исследований с использованием зондирующих комплексов, в частности СТД-зондов (солёность, температура, давление). В 1978 г. для определения солёности по электропроводности была разработана Шкала практической солёности (ШПС–78).Она основана на эмпирической зависимости электропроводности растворов стандартной морской воды. Эталоном в этом методе является водный раствор хлористого калия (КCl) при температуре 15 °С и давлении в одну стандартную атмосферу (101325 Па). Солёность, измеренная по электропроводности, была названа практической солёностью. При написании практической солёности знак промилле ( 0 /00) опускается. В отечественной литературе используется аббревиатура «eпc» (единицы практической солёности), в англоязычной — «psu» (practical salinity units) или «PSS–78» (practical salinity scale). Численные значения практической солёности совпадают с численными значениями солёности, выраженной в промилле. Солёность большинства океанских вод заключена в пределах от 33 до 37 епс. Исключением являются воды приустьевых участков рек, бассейнов опреснения (Балтийское и Чёрное моря), где солёность значительно меньше, и бассейны осолонения (Средиземное и Красное моря), где солёность превышает 38 епс. В открытых районах Балтийского моря солёность около 10 епс, в Невской губе — 2–3 епс. В Чёрном море солёность вод 17,5–18 епс. Средняя солёность Мирового океана равна 34,72 епс. Наименьшая солёность поверхностных океанских вод 34,43 епс наблюдается между 5 и 10 градусами широты, как Северном, так и в Южном полушариях. С удалением к северу в Северном полушарии солёность увеличивается и достигает максимума на пространстве между 25 и 30 градусами северной широты. В Южном полушарии максимальная солёность наблюдается между 20 и 25 градусами южной широты. Это так называемые субтропические максимумы солёности со значением 35,8 0 /00. С удалением к полюсам солёность уменьшается. Плотность. Удельный объёмВ океанографии параметр состояния «масса» при использовании заменяется параметром «плотность», а объём — удельным объёмом. Физическое понятие плотности — это масса единицы объёма. В случае однородного тела его плотность одинакова по всему объёму и может быть определена по формуле: Так как в океанографии эти параметры используются во многих практических расчётах, то вместо абсолютных значений плотности и удельного объёма используются:
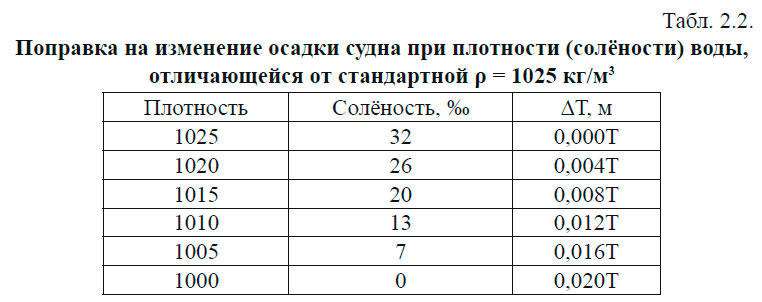
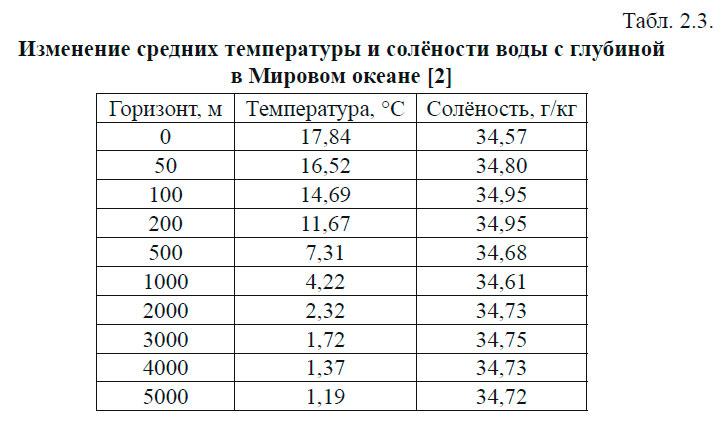
Эта замена не имеет физического смысла и используется только для того, чтобы сократить число знаков при проведении вычислений. Рассмотрим это на примере: средняя плотность морской воды при атмосферном давлении, температуре 17 °С и солёности 34,5 eпc ( 0 /00) равна: ρ (34.5; 17; 0) = 1025,15 кг∙м -3 . Условная плотность (аномалия плотности) обозначается обычно буквой σ и будет равна: В толще воды существуют поверхности одинаковой плотности — изопикнические и поверхности одинакового удельного объёма — изостерические. В зависимости от плотности воды изменяется осадка судна. Величина изменения дана в табл. 2.2. Давление. Уравнение гидростатикиДавлением называется отношение силы, действующей по нормали к поверхности тела, к площади этой поверхности. Если вода находится в состоянии равновесия, то давление — величина скалярная, т. е. оно одинаково во всех направлениях и не зависит от ориентации площадки ΔZ, на которую действует. В толще воды океана, находящегося в состоянии покоя, давление на двух разных горизонтах будет отличаться на величину, равную ρgΔz, где ρ — плотность воды, g — ускорение силы тяжести, Δz — расстояние между горизонтами. Таким образом, давление на глубине z будет равно: Это выражение называется уравнением гидростатики. Поверхности равного давления называются изобарическими. В Международной системе единиц СИ за единицу давления принят паскаль (Па): 1 Па = 1 кг∙м -1 ∙с -2 = 1 н/м 2 В океанологии долгое время применялись внесистемные единицы, которые применяются и поныне: 1 бар = 10 5 Па; 1 дбар = 10 4 Па. Последняя единица очень удобна для применения, так как при изменении глубины на 1 м, давление изменяется на 1 дбар. Поэтому очень часто в океанологии вместо глубины в метрах, глубину дают в величинах давления. Например: глубина в 1000 дбар ≈ 1000 м. В единицах СИ: где кПа — килопаскали; МПа — мегапаскали. Температура морской водыИзмерение температуры производится косвенным путём, то есть измеряются физические свойства тел или материалов, которые зависят от температуры. В качестве начала отсчёта шкалы температуры и единицы её измерения применяются температуры перехода чистой воды из одного агрегатного состояния в другое, т. е. температура плавления льда (Т0) и кипения воды (Тк) при нормальном атмосферном давлении. В океанографии температура измеряется в градусах шкалы Цельсия. Различают температуру in Situ, т. е. температуру, измеренную на определенной глубине, и потенциальную температуру — это температура частицы воды, адиабатически приведённая от давления в точке измерения к заданному давлению (например, поднятой на поверхность). Кроме градусов Цельсия применяется температура в единицах абсолютной шкалы Кельвина (°К). Шкала Кельвина начинается от абсолютного нуля, равного −273,15 0С, т. е. Температура воды в океане изменяется в пределах от +30 °С. Нижний предел зависит от температуры замерзания, которая является функцией солёности морской воды. Вода солёностью 35 епс начнёт замерзать, когда её температура понизится приблизительно до −2 °С. Верхний предел зависит от теплообмена между океаном и атмосферой. В прибрежной мелководной зоне, в замкнутых морях температура может быть и больше 30 °С. Самая высокая среднегодовая температура воды наблюдается на пространстве между 5 и 10° с. ш. и равняется 27,4 °С (термический экватор). С удалением к северу и югу температура понижается и проходит через 0 °С (т. е. в область отрицательных температур) в Северном полушарии между 70 и 75° с. ш., а в южном — 60–65° ю. ш. С глубиной температура воды убывает. В верхних слоях примерно до 1500 м характер убывания неодинаков и зависит от географической зоны. Однако, начиная с 1500 м, температура воды во всех океанах медленно понижается от 4–5 °С на верхней границе до 2–0 °С у дна. Исключение составляют полярные районы, которые имеют чётко выраженный промежуточный максимум в слое 300–500 м (1,75–1,83 °С) и подповерхностный минимум в слое 50–100 м (0,99–0,55 °С). На глубине 1500 м температура равна 1,14 °С. Изменение средних температур и солёностей воды с глубиной представлены в табл. 2.3. Уравнение состояния морской водыЗависимость, связывающая между собой плотность, температуру, солёность и давление, называется уравнением состояния морской воды. В общем виде его можно записать так: Это полный дифференциал плотности морской воды. В настоящее время из-за сложности этой зависимости уравнение состояния морской воды не может быть найдено теоретически. Поэтому в практике расчётов используются эмпирические формулы. Однако эмпирические формулы также очень громоздки, что препятствует их непосредственному применению в теоретических моделях, которые применяются для изучения океанских течений. Поэтому часто используются более простые зависимости: ЛитератураГидрометеорологическое Обеспечение Мореплавания — Глухов В.Г., Гордиенко А.И., Шаронов А.Ю., Шматков В.А. [2014] источники: http://test.oceanographers.ru/?p=1526 http://mirmarine.net/sudovoditel/gidrometeorologiya/1307-osnovnye-khimicheskie-i-fizicheskie-svojstva-morskoj-vody |
 в океанологии понимается отношение массы единицы объема морской воды при температуре t в момент ее определения (in situ 1 ) к массе единицы объема дистиллированной воды при температуре 4 0 С.
в океанологии понимается отношение массы единицы объема морской воды при температуре t в момент ее определения (in situ 1 ) к массе единицы объема дистиллированной воды при температуре 4 0 С. две формы выражения:
две формы выражения: .
. . Эту величину называют плотностью морской воды при температуре 0 0 C.
. Эту величину называют плотностью морской воды при температуре 0 0 C. =
= 
 . Отношение изменения удельного объема под действием давления
. Отношение изменения удельного объема под действием давления 
 ресная вода имеет наибольшую плотность при +4 0 С и замерзает при 0 0 С. С повышением солености температура наибольшей плотности (Тмах.плт.) и температура замерзания (Тзамерз.)понижаются почти линейно (рис.4), причем температура наибольшей плотности понижается быстрее, чем температура замерзания. Из графика видно, что при значении солености S =24.695‰ кривые пересекаются, образуя характерную точку, в которой температура замерза-ния и температура наибольшей плотности равны: Тмах.плт = Тзамерз. = — 1.33 0 С.
ресная вода имеет наибольшую плотность при +4 0 С и замерзает при 0 0 С. С повышением солености температура наибольшей плотности (Тмах.плт.) и температура замерзания (Тзамерз.)понижаются почти линейно (рис.4), причем температура наибольшей плотности понижается быстрее, чем температура замерзания. Из графика видно, что при значении солености S =24.695‰ кривые пересекаются, образуя характерную точку, в которой температура замерза-ния и температура наибольшей плотности равны: Тмах.плт = Тзамерз. = — 1.33 0 С. плотнение при смешении вызвает конвекцию в море. Оно имеет большое значение в формировании глубинных и придонных вод океана.
плотнение при смешении вызвает конвекцию в море. Оно имеет большое значение в формировании глубинных и придонных вод океана. , т.е. плотность потока вещества М (в см 2 с -1 ) пропорциональна коэффициенту диффузии D и градиенту концентрации
, т.е. плотность потока вещества М (в см 2 с -1 ) пропорциональна коэффициенту диффузии D и градиенту концентрации  . Это уравнение выражает первый закон Фика 2 .
. Это уравнение выражает первый закон Фика 2 .