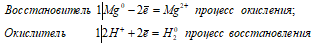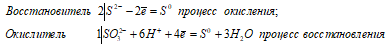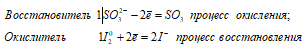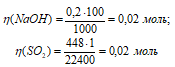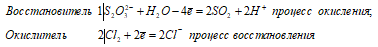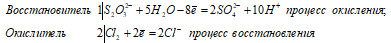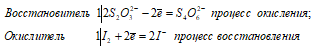Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de90412ae1d7a55 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
составьте по два молекулярных уравнения реакций по данным ионным уравнениям Mg+2H(+)=Mg2(+)+H2
Mg + 2HCl = MgCl2 + H2
Mg + 2HF = MgF2 + H2
Если ответ по предмету Математика отсутствует или он оказался неправильным, то попробуй воспользоваться поиском других ответов во всей базе сайта.
1. глюкоза А. +140 °С
2. водород Б. +1539 °С
3. железо В. –259 °С
Запиши ответ в виде сочетания цифр и букв, например: 1А2В3Б.
Характеристика окислительно-восстановительных свойств сернистой кислоты
Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
Mg 0 + 2H + = Mg 2+ + H2 0
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
2S 2- + SO3 2 — + 6H + ↔ 3S 0 + 3H2O
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
Находим количество NaOH и SO2:
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na 2SO 3) = M( Na 2SO 3) . n( Na 2SO 3) = 126 . 0,01 = 1,26 г.
Ответ: m( Na 2SO 3) = 126 г.
Тетратионовая кислота
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
S2O3 2- + 2Cl2 0 + H2O ↔ 2SO 2 ↑ + 4Cl — + 2H +
Na 2 S 2 O 3 + 2Cl 2 + H 2 O ↔ 2NaCl + 2SO 2 ↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
S2O3 2- + 4Cl2 0 + 5H2O ↔ 2SO4 2- + 8C l- + 10H +
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ↔ + 2H 2 SO 4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2 Na 2 S 2 O 3 + I 2 ↔ Na 2 S 4 O 6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H 2 S 4 O 6 .
http://troechka.com/chemistry/358976
http://buzani.ru/zadachi/khimiya-glinka/1282-sernistaya-kislota-zadachi-863-865